SEMA4D修饰钛表面通过巨噬细胞调控内皮细胞功能的研究
2024-03-13周洁仪张建兰谢玲玲
周洁仪,张建兰,谢玲玲,柳 姚,邱 憬
钛及钛合金材料因其良好的化学稳定性和生物相容性,被视为“亲生物金属”之一,被广泛应用于口腔医学领域[1-3]。近年来,种植义齿逐渐成为许多缺牙患者的首选修复方案[4-5]。在种植治疗中,种植体与周围骨组织之间形成良好的骨结合是治疗成功的关键,但种植体周围软组织的修复和维持同样具有不可忽视的关键作用。软组织紧密附着在种植基台表面,在种植体穿龈处形成良好的软组织封闭,作为保护下方牙槽骨的生物屏障,防止细菌侵入,为骨改建提供良好的微环境,是种植体周围组织保持长期健康和稳定的基础[6-8]。种植手术后,种植体周围软组织是在局部软硬组织发生创伤后开始愈合。在生物材料存在的条件下,多种细胞协作产生一系列的炎症反应、血管生成以及新组织形成[9]。巨噬细胞在适当条件下可以转化为M1型促进炎症反应或转化为M2型引导组织修复[10],而内皮细胞主导的血管生成能够为组织再生提供必要的氧气和营养物质[11]。在此过程中,种植体周围的炎症反应与血管生成相辅相成,共同构建有利于组织再生修复的生理微环境。
信号素家族第4组成员SEMA4D,其高亲和力受体PlexinB1多表达于非淋巴细胞如神经细胞和内皮细胞,低亲和力受体CD72多表达于淋巴细胞如T细胞、B细胞、DC细胞、巨噬细胞等,在上调血管生成和调节免疫反应中发挥重要作用[12-13]。在前期研究中,我们已成功采用碱热处理和自组装技术制备出SEMA4D修饰钛表面,并通过构建内皮细胞-巨噬细胞间接共培养模型,证实其直接成血管及间接抗炎作用[14]。考虑到内皮细胞和巨噬细胞表面均表达SEMA4D受体,并且细胞之间存在相互作用,故本研究拟以SEMA4D修饰钛表面为基础,构建巨噬细胞-内皮细胞间接共培养模型,探究其直接抗炎和间接成血管作用,更全面地分析SEMA4D修饰钛表面内皮细胞和巨噬细胞间的交互作用,探索其促进软组织愈合的潜力,为未来实现临床转化或新一代功能化种植体表面的研发提供参考依据。
1 材料与方法
1.1 实验材料与设备
纯钛片(99.5%,宝鸡钛业,中国),SiC砂纸(鹰牌,中国),氢氧化钠(国药,中国),PBS(Gibco,美国),多聚左旋赖氨酸(PLL,上海源叶,中国),牛血清白蛋白(BSA,广州赛国,中国),SEMA4D(武汉华美生物,中国),小鼠源性巨噬细胞系RAW264.7、小鼠脑血管内皮瘤细胞系bEnd.3(中国科学院细胞库,上海,中国),胎牛血清、DMEM培养基、青霉素-链霉素溶液、0.25%胰蛋白酶-EDTA(Gibco,美国),CCK-8试剂盒(碧云天,中国),总RNA快速提取试剂盒(北京百泰克,中国),引物(上海生工,中国),PrimeScript RT Master Mix(Takara,日本),SYBR Premix ExTaqⅡ(Takara,日本),恒温水浴箱(国华电器,中国),场发射扫描电子显微镜(LEO,德国),JC2000D接触角测量仪(Powereach,中国),细胞恒温培养箱(Thermo,美国),超净工作台(Thermo,美国),多功能酶标仪(MD Spectramax 190,美国),QuantStudioTM7 Flex System(Applied Biosystem,美国),DM4000正置荧光显微镜(Leica,德国),DMILLED倒置显微镜(Leica,德国)。
1.2 样品制备及表征
使用碳化硅砂纸将纯钛试件逐级打磨、抛光、洗涤和干燥。以光滑钛表面为对照组,记为Ti。将光滑钛浸入2 mol/L氢氧化钠溶液,80 ℃条件下水浴加热12 h,记为Ti-OH。将Ti-OH置于2.5 mg/mL多聚左旋赖氨酸(PLL)溶液中,于4 ℃避光过夜孵育,记为Ti-PLL。根据说明将SEMA4D稀释成不同浓度(50、100、200 ng/mL),并与相同体积的10 mg/mL BSA溶液混合,于37 ℃孵育至少1 h。最后将Ti-PLL钛片置入不同浓度的SEMA4D-BSA溶液中(25、50、100 ng/mL),于37 ℃下孵育至少3 h,分别记为Ti-4D25、Ti-4D50和Ti-4D100。每组随机选择3个试件,采用场发射扫描电子显微镜(SEM)观察表面微形貌,使用JC2000D接触角测量仪检测材料表面能。
1.3 细胞培养
将RAW264.7细胞和bEnd.3细胞复苏后,加入DMEM培养基(含10%胎牛血清和1%青霉素/链霉素),静置于37 ℃、5% CO2的恒温加湿培养箱中。每2~3 d更换一次新鲜的培养基。当达到80%的细胞融合时,培养的细胞传代。RAW264.7每3 d传代一次,bEnd.3每5 d传代一次。
1.4 试件表面巨噬细胞的增殖活性检测
将RAW264.7(2×103个/孔)接种到96孔板中4组试件表面。培养1、2、3 d后,弃培养液,PBS清洗,每孔加入110 μL含有10% CCK-8试剂的完全培养基,置于37 ℃恒温培养箱孵育2 h,多功能酶标仪测定各孔吸光度值(波长=450 nm)。每组随机检测3个样本并计算平均值。
1.5 RT-qPCR检测巨噬细胞的炎症基因和VEGF表达水平
将RAW264.7(4×105个/孔)接种到6孔板中4组试件表面,培养48 h后,弃培养液,PBS清洗,采用试剂盒提取巨噬细胞的总RNA,加入PrimeScript RT Master Mix逆转录为cDNA,将cDNA与相应的引物和SYBR Premix Ex Taq Ⅱ混合后,以GAPDH为内参,检测TNF-α、IL-6和IL-1β炎症基因的表达水平和VEGF表达水平,基因引物序列见表1。通过2-ΔΔCt法计算基因表达的相对量。

表1 引物序列Tab.1 Primer sequence
1.6 巨噬细胞/内皮细胞间接共培养模型的构建
将RAW264.7(4×105个/孔)接种到6孔板中4组试件表面,培养48 h后,取培养液,4 ℃,1 000 r/min,10 min离心至少3次,将部分上清液以1∶1的比例与完全培养基混合,配制成条件培养基,分别记为Ti-CM、4D25-CM、4D50-CM和4D100-CM。将另一部分上清液1∶1与无血清培养基混合配制条件培养基,分别记为Ti-CM0、4D25-CM0、4D50-CM0和4D100-CM0。
1.7 内皮细胞增殖活性检测
将bEnd.3(3×103个/孔)接种到96孔板。用条件培养基Ti-CM、4D25-CM、4D50-CM和4D100-CM分别培养1、3、5 d后,弃培养液,PBS清洗,每孔加入110 μL含有10% CCK-8试剂的完全培养基,置于37 ℃恒温培养箱孵育2 h,多功能酶标仪测定各孔吸光度值(波长=450 nm)。每组随机检测3个样本并计算平均值。
1.8 内皮细胞黏附观察
将bEnd.3(1×104个/孔)接种到置于12孔板内的细胞爬片上,条件培养基Ti-CM、4D25-CM、4D50-CM和4D100-CM分别培养8 h后,4%多聚甲醛室温固定30 min,鬼笔环肽染色30 min,DAPI染色3 min后,通过倒置荧光显微镜观察各组细胞黏附铺展情况。
1.9 内皮细胞划痕实验
用Marker笔在6孔板背后划好均匀的横线作标记,将bEnd.3(4×105个/孔)接种到此6孔板中。保证细胞密度达到90%后用200 μL枪头尽量垂直于细胞平面沿线划痕,PBS清洗后,分别加入条件培养基Ti-CM0、4D25-CM0、4D50-CM0和4D100-CM0进行培养。选取0、12、24 h进行显微镜观察细胞迁移并拍照。
1.10 统计学分析
采用SPSS 22.0统计软件对各组试件的检测结果进行方差齐性检验,显示数据方差齐,进行单因素方差分析和SNK多重比较,当P<0.05时,认为具有统计学差异。采用GraphPad Prism 5软件绘制图表,使用字母标记法进行标注。
2 结 果
2.1 表面微形貌
图1为扫描电子显微镜观察4组试件的表面微形貌。对照组钛表面相对光滑,高倍镜下可见在处理过程中产生的机械摩擦痕迹。碱热处理后钛表面表现出疏松的多孔结构,经过SEMA4D溶液处理后试件表面形成一层有机薄膜,并且随着SEMA4D浓度的增加,覆盖的薄膜越来越致密。

图1 扫描电子显微镜观察4组试件的表面微形貌( ×40 000)Fig.1 Scanning electron microscope images of surface morphology of four specimens( ×40 000)
2.2 表面亲水性
表面亲水性检测包括水接触角和表面能,结果见图2。结果显示,Ti、Ti-4D25、Ti-4D50和Ti-4D100 4组试件的水接触角逐渐减小,其表面能平均值分别为35.6、54.9、62.3、64.9 mN/m,呈逐渐增大趋势。由此可见,与光滑钛相比,改性后的钛表面具有更好的亲水性,并且随着SEMA4D浓度的增加,表面亲水性逐渐不断增强。
2.3 试件表面巨噬细胞的增殖活性
RAW264.7细胞在4组试件表面增殖活性的CCK-8检测结果如图3所示。第1天未见明显差异,第2天实验组RAW264.7细胞的增殖活性高于对照组,并具有显著性差异,尤其是Ti-4D50组和Ti-4D100组,第3天Ti-4D100组RAW264.7细胞的增殖活性最佳。
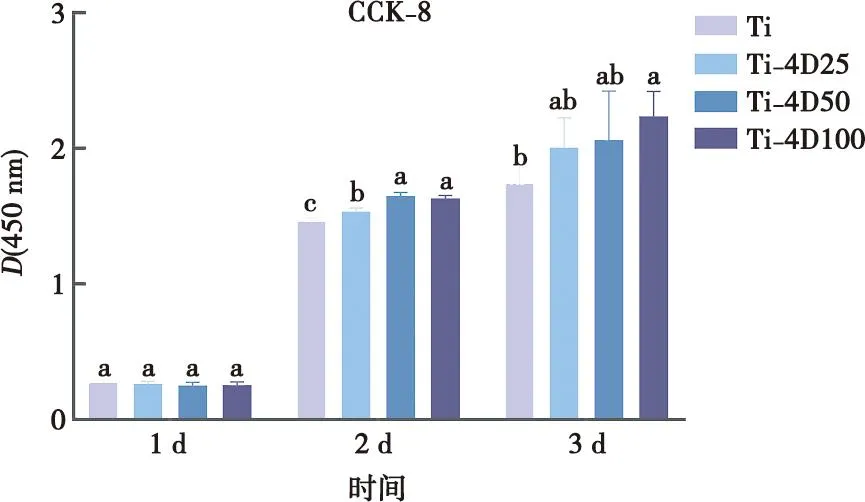
标注不同字母表示有统计学差异(P<0.05)。
2.4 试件表面巨噬细胞的炎性表达和VEGF表达
RT-qPCR检测4组试件表面RAW264.7细胞中TNF-α、IL-6和IL-1β的基因表达水平,结果如图4所示。与光滑钛对照组相比,SEMA4D处理组RAW264.7细胞中TNF-α、IL-1β、IL-6的表达量均呈下降趋势,尤其是Ti-4D100组。同时,SEMA4D处理组的VEGF表达均优于光滑钛对照组,且Ti-4D100组的表达量最多。

标注不同字母表示有统计学差异(P<0.05)。
2.5 内皮细胞的增殖活性
Ti-CM、4D25-CM、4D50-CM和4D100-CM培养bEnd.3细胞的CCK-8检测结果如图5所示。每组细胞数量均随时间变化而增长,第1、3、5天各组间均未见明显差异。
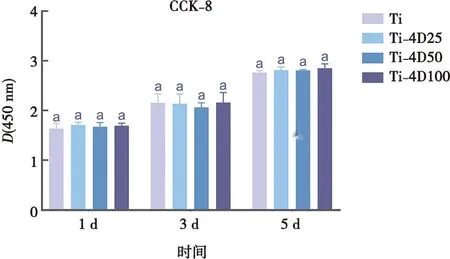
标注相同字母表示无统计学差异(P>0.05)。
2.6 内皮细胞的黏附能力
4组条件培养基培养8 h后bEnd.3细胞的黏附形态如图6所示。镜下可见SEMA4D处理组试件表面细胞的铺展面积更大,并且显示出更清晰的细长肌动蛋白丝。

图6 条件培养基培养 8 h后的bEnd.3细胞黏附铺展形态Fig.6 Adhesion and spreading of bEnd.3 cells after 8 hours of conditional medium culture
2.7 内皮细胞的迁移能力
4组条件培养基培养的bEnd.3细胞迁移能力检测结果如图7所示。12 h时,Ti、Ti-4D25和Ti-4D50三组的愈合率未见明显差异,但Ti-4D100组具有显著优势。24 h后,相较于光滑钛对照组,SEMA4D处理组均表现出优势,且Ti-4D100组的愈合率仍为最高。
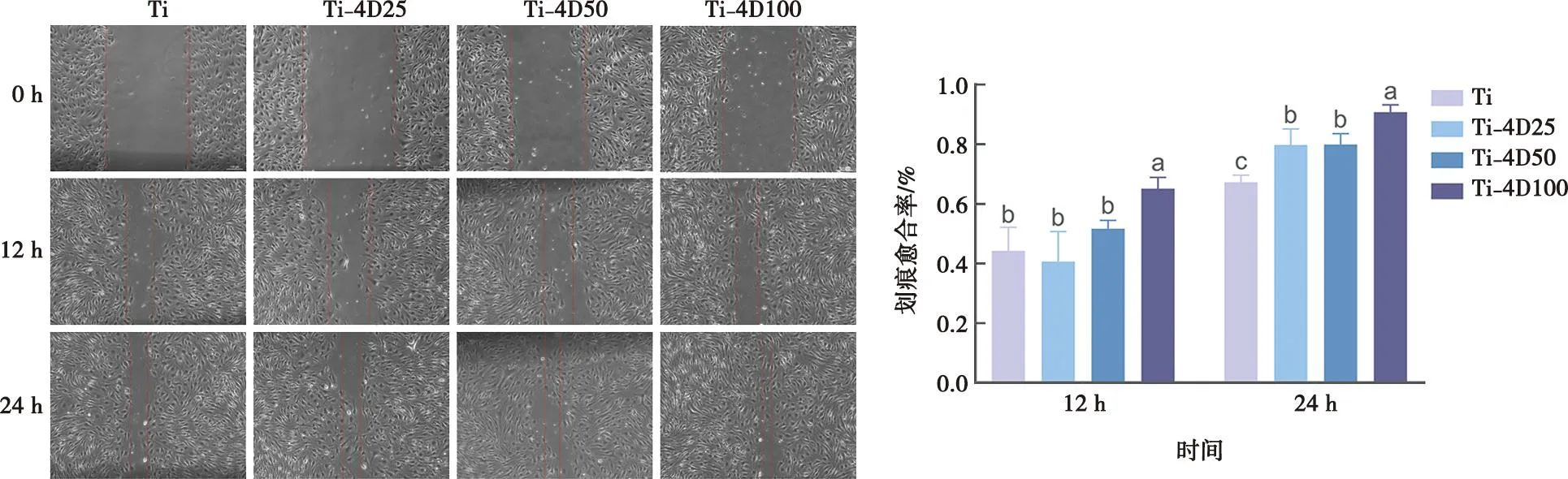
标注不同字母表示有统计学差异(P<0.05)。
3 讨 论
基于本课题组的前期研究结果[14],本实验通过碱热法+自组装技术将SEMA4D固定在纯钛表面,初步证实其具有一定的促进血管生成和免疫调节作用。生物材料的表面亲水性是蛋白吸附和细胞黏附的决定性因素之一[15-16]。接触角测量结果表明,与光滑钛相比,SEMA4D修饰钛表面具有更好的亲水性,这有利于组织愈合初期蛋白质的吸附和细胞反应。随着SEMA4D浓度的增加,亲水性也随之增强,这可能归因于表面改性后负载的BSA[17]。扫描电镜观察显示,SEMA4D修饰钛表面组呈现出多孔结构且表面被有机薄膜覆盖。随着更多SEMA4D-BSA复合物组装至碱化钛表面,覆盖的薄膜变得更加致密,表面负载的BSA不断增加,故而亲水性也随之改善。
生物材料表面的理化特性可参与调控细胞中基因表达的级联激活,进而影响细胞的生物学行为[18-19]。大量研究证实,中度亲水性的生物材料表面可促进细胞生长,表现出优良的生物相容性[15,20]。CD72作为SEMA4D的低亲和力受体,多表达于巨噬细胞等免疫细胞[21-22]。本研究在SEMA4D修饰钛表面直接接种巨噬细胞,力图探索此改性钛表面的理化特性对巨噬细胞生物学行为的影响。根据CCK-8结果,SEMA4D修饰钛表面可以显著提高RAW264.7巨噬细胞的增殖能力,并且以Ti-4D100组为最佳。通过PCR检测各组试件表面巨噬细胞的炎性表达显示,与光滑钛相比,SEMA4D修饰钛表面巨噬细胞的促炎因子基因表达降低,但降低程度并未呈现出严格的SEMA4D剂量依赖性。据研究报道,SEMA4D能够抑制单核细胞迁移,也可促进外周血单核细胞极化为M2表型[23-25]。SEMA4D通过与受体CD72相互作用参与免疫调节,且SEMA4D的免疫调节作用依赖于生物学环境[26]。本实验中,SEMA4D与BSA自组装后倾向于发挥积极的免疫调节作用,SEMA4D浓度为100 ng/mL时最佳。PCR检测巨噬细胞的VEGF表达结果显示,SEMA4D组对其分泌具有促进作用。SEMA4D与受体CD72结合后通过其尾部的ITIM基序募集蛋白酪氨酸磷酸酶SHP1,通过诱导酪氨酸去磷酸化和信号蛋白失活来抑制免疫细胞活化[27]。同时,酪氨酸磷酸酶SHP1在缺氧条件下可以调控HIF-1α的表达,进而影响VEGF的生成[28]。巨噬细胞分泌的血管内皮生长因子可以作用于内皮细胞表面的VEGF受体,促进内皮细胞存活、迁移和血管形成等,以发挥免疫调节和组织修复的重要作用。
本课题组在前期通过构建内皮/巨噬细胞间接共培养模型,验证了SEMA4D修饰钛表面可以通过内皮细胞间接促进巨噬细胞的抗炎表达。由于生理环境下生物材料与细胞、细胞与细胞之间都是相互作用的[29],间接共培养模型可以更好地模拟体内情况。基于这一点,前述研究结果已表明SEMA4D修饰钛表面具有直接的正向免疫调控作用和间接促进巨噬细胞分泌VEGF的效应,本实验则进一步构建巨噬/内皮细胞间接共培养模型,以完善SEMA4D修饰钛表面促血管-抗炎双重作用的表型研究。CCK-8结果显示,各组条件培养基培养的内皮细胞随时间推移均呈现出细胞数量的显著增长,表明无细胞毒性作用。文献证据表明,当巨噬细胞炎症表达降低并分泌内皮血管生长因子时,可以促进内皮细胞的迁移、黏附,从而改善受损血管的再内皮化[30]。鬼笔环肽染色实验显示,条件培养基培养8 h后SEMA4D处理组的内皮细胞铺展更充分,而划痕实验结果显示,24 h后SEMA4D处理组较对照组呈现显著优势,且SEMA4D浓度为100 ng/mL时内皮细胞的迁移黏附能力最佳,该现象与文献证据保持一致。
本研究通过体外实验证实,SEMA4D修饰钛表面不仅可直接改善巨噬细胞的炎性表达,还可通过巨噬细胞间接促进内皮细胞的运动能力。与本课题组的前期研究结果相结合,能初步解析SEMA4D修饰钛表面内皮细胞和巨噬细胞间的交互作用表型,但其内在分子机制仍有待进一步探究。此外,关于种植体基台的另一重要考量为细菌黏附。碱热处理后钛表面的粗糙化不可避免,但大量研究表明,材料表面的理化特征均会影响细菌的黏附及成膜行为,这些特征包括:形貌模式、粗糙度、亲水性和表面功能性化学基团修饰等[31]。Singh等[32]研究认为,粗糙度的增大并非一定导致细菌黏附的增加,通常会存在一个临界值。Whitehead等[33]则研究发现,细菌形态也会影响其在不同粗糙度表面的黏附。因此,关于SEMA4D修饰钛表面的细菌黏附及成膜行为亦有待后续的进一步探索。
