可吸收手术缝合线研究进展
2024-03-13杨智超刘淑强吴改红李慧敏
杨智超, 刘淑强, 吴改红, 贾 潞, 张 曼, 李 甫, 李慧敏
(太原理工大学 轻纺工程学院, 山西 太原 030024)
可吸收缝合线是指在人体内外组织或器官出现破损或切口时用于将伤口进行结扎、止血并且缝合,并在一定周期内可以自行被机体组织吸收,而对人体组织和器官不产生有害影响的一种常见的医用纺织品。可吸收手术缝合线一般在2~6个月从植入点消失[1],无需拆线等操作,是当今国际上外科手术和临床应用中使用量最大的医用纺织品之一,也是当今国际生物医用纺织领域的研究热点之一。
缝合线可根据是否具备生物降解能力分为2类:可吸收缝合线和不可吸收缝合线。不可吸收缝合线在使用过后,无法被机体组织自行吸收,在伤口痊愈时需要进行二次拆线的操作,这在一定程度上会对患者带来较大的痛苦,此外,拆线后很大可能会在皮肤表面形成瘢痕,对患者皮肤的美观程度会造成较大的影响。而可吸收手术缝合线由于其消除了患者二次拆线的痛苦,成为新一代缝合线中患者的福音,同时,对于情况各异的伤口环境,在实际手术操作中,可以选择降解时间不同的缝合线[2]。另外,在实际手术过程中,用于闭合组织切口的材料还有许多,例如手术夹、手术胶、微孔手术带以及螺钉[3]等,但这些材料存在操作时效过长、组织渗漏、增加感染、引发瘢痕等问题。
针对不可吸收缝合线与可吸收缝合线的应用,有众多学者进行研究。Lee等[4]通过对英国、爱尔兰、澳大利亚与新西兰的各大医院的临床医生做出大量调查评估发现,大部分的医生与患者均会选择使用可吸收缝合线,并提出可吸收缝合线会降低去除缝合线或供应相关的医疗保健成本。Egbunah等[5]研究了修复唇裂疾病所用到的几种材料:可吸收缝合线、不可吸收缝合线、组织黏结剂,对这几种伤口闭合材料进行评估发现,当使用不可吸收缝合线进行唇裂修复时,更有利于伤口愈合,但术后并发症的发生率明显较高,综合比较得出可吸收缝合线总体效果更有利,同时表明可吸收缝合线拥有较好的闭合伤口能力,较少地发生伤口渗漏,在消除组织瘢痕,简化操作方面都有积极作用。
本文就可吸收缝合线的发展历程以及缝合线的相关性能要求,详细阐明了构成可吸收缝合线的不同材料和分类、国内外对于可吸收缝合线的研究进展,并对可吸收缝合线在发展中存在的问题以及未来的发展趋势进行了分析。
1 发展历程及性能要求
1.1 缝合线发展历程
人类使用缝合线用来闭合伤口已经有4 000多年的历史[6],但可吸收缝合线的出现是在公元前1800年,就是诞生于亚历山大的肠线,它是当时唯一可以使用的可吸收缝合线。
随着合成纤维行业的逐渐发展,人工合成类可吸收缝合线登上舞台。20世纪60年代初期,国外首次开发出聚乙醇酸(PGA)可吸收缝合线,商品名为Dexon,在这个时期,一种通过化学交联处理,可控制体内吸收速率的胶原线也被开发;20世纪70年代,聚对二氧环己酮(PDS)可吸收缝合线实现商业化,与此同时,国外首次研发出甲壳素及其衍生物类可吸收缝合线;90年代以来,国外通过对聚乳酸进行物理、化学改性以及优化纺丝工艺来提高聚乳酸的各项性能,如Schmack等[7]采用高速熔融纺丝和纺丝拉伸工艺制备出力学性能优异的聚乳酸纤维,从而提高聚乳酸缝合线的韧性和打结强度。制备可吸收手术缝合线材料的发展历程详见表1。

表1 可吸收缝合线材料的发展历程Tab.1 History of absorbable suture materials
目前市面上主流的可吸收手术缝合线仍以进口为主导,大多数国产可吸收缝合线90%以上是基于进口原线贴牌封装。各大品牌无自主生产原线能力,原线严重依赖进口。市场部分可吸收手术缝合线产品列于表2。
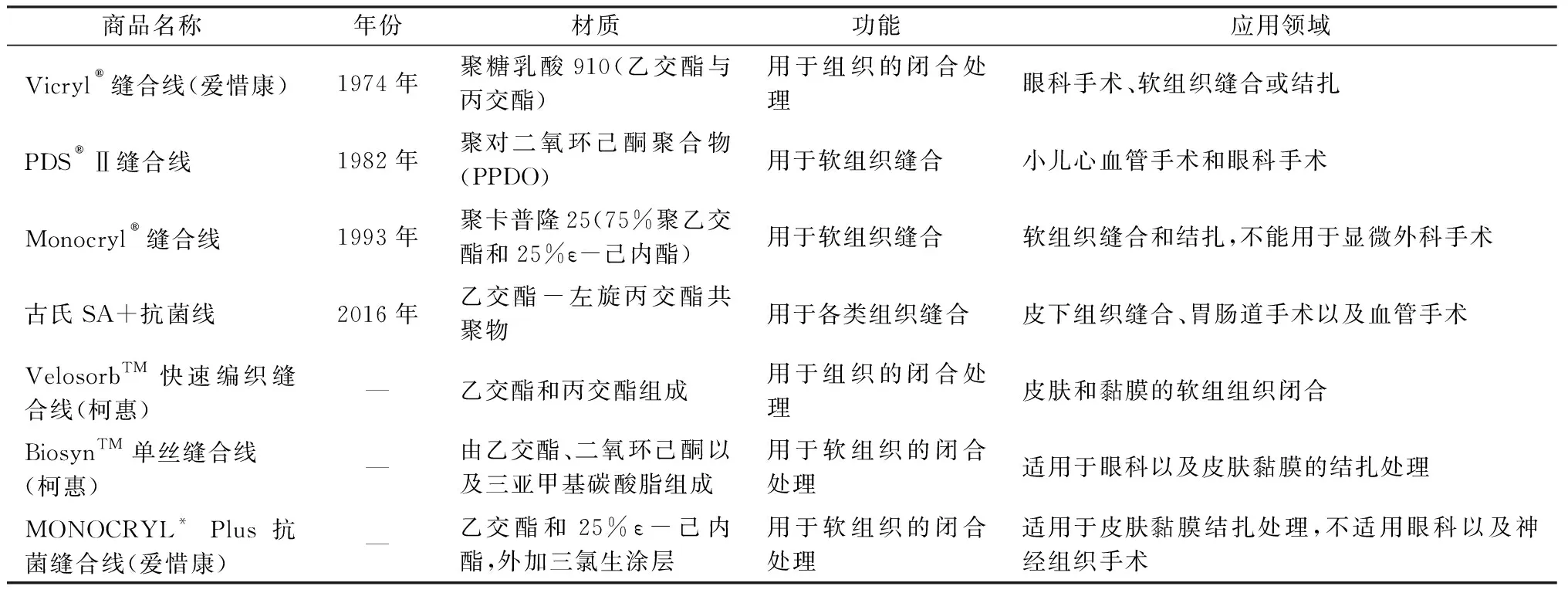
表2 部分市面可吸收手术缝合线产品Tab.2 Partial commercially available absorbable surgical suture products
1.2 可吸收缝合线性能要求
理想的可吸收缝合线应该具备优良的力学性能和生物学性质。在力学性能方面:缝合线的设计应该考虑在低应变时具有理想的弹性和弹性模量,还应当具有较高的抗张打结强度,在实际外科手术操作过程中,以此来适应打结后的缝合线其力学性能仍能保持在一定范围内的要求。另外,缝合线在被植入组织后,应当在相当长的一段时间内依旧保持其力学性能不受影响,对于可吸收缝合线,其断裂强度应保持的时间为1~4周[13]。在生物学性质方面:首当其冲的是缝合线应当具有良好的生物相容性,并不与伤口部位发生组织反应,不对细胞产生毒性,不对伤口部位造成感染风险,更不应在伤口愈合后,组织部位出现血凝块、裂口以及细菌的黏附。另外,最终制备的缝合线应不易与外科手术所使用的橡胶手套过分纠缠,以免增加总耗时使手术变得繁琐,这就需要在选取制备缝合线材料时和在后整理上考虑,以增加缝合线的表面光滑度。王成芳[14]选用硬脂酸钙为涂层剂,通过对未涂层的聚乙交酯可吸收编织缝合线与涂层后的缝合线作对比,发现编织线表面涂层后,能够增加表面的润滑性,使缝合线表面光滑平整,从而使缝合线能够平滑地通过人体组织,以此保护整个手术顺利进行并减少病人痛苦。
在开发可吸收手术缝合线时,应当牢牢把握缝合线的操作性能要求,通常在力学性能方面,学者应当侧重于缝合线原材料的选取,在保证断裂强力符合标准的同时,还要增加其断裂伸长率,以此来适配缝合线应有的柔韧性。聚乳酸长丝直接制备出的缝合线存在柔韧性不足的缺点,朱斐超等[15]通过综述关于聚乳酸母粒改性的相关内容,总结出一系列能够纺制增强增韧性能的聚乳酸长丝,以此制备手术缝合线,另外,对纤维进行改性也可改变缝合线原材料的力学性能;在生物学性质方面,最重要的是要确定原材料的无毒害性,其次要考虑其生物相容性,以此来使缝合线穿入组织后拥有良好的细胞黏附性,以加快伤口的愈合。
2 可吸收缝合线分类及其应用
2.1 天然可吸收缝合线
2.1.1 羊肠线
羊肠线作为人类历史上诞生的第1类可吸收缝合线,已经有上千年的历史,在相当长一段时间内被用作闭合伤口的材料。
天然羊肠线的材料来源是绵羊、牛、袋鼠、马或骡等动物的肠绒毛膜,在去除脂肪和其它多余组织后,通过铬盐、甲醛、明矾等弱交联剂对羊肠线进行处理,然后将1~5根肠线并合拉伸加捻,最终制成不同数量的股线,它可被人体吸收,制作工艺流程简单,成本低廉,但同时,羊肠线也存在一些缺点,如打结强度较差,降解速率过快等,针对此类问题,可将加捻后的羊肠线经过打磨处理,并将其浸泡于碱性溶液中,可以适当增加其韧性,此外,羊肠线可以抵抗身体中酶的分解,从而具备有比普通肠线长约2倍降解时间的性能并且还拥有较好的抗拉强度。另外,在外科手术操作过程中,羊肠线易引发组织反应,从而造成伤口部位的感染(SSI,surgical site infection),加碘肠线在一定程度上可以缓解继发感染的发生。
近五年来,肠线不单单被用于缝合伤口,有较多学者利用肠线的可吸收性来研究穴位埋羊肠线的方法,用于治疗诸多疾病,如Xu等[16]利用填埋羊肠线的方法改善机体免疫能力,从而达到抑制肝癌细胞生长的目的;王鸣等[17]研究了不同长度羊肠线通过穴位埋线的方法治疗肥胖症的效果对比,对于单纯性肥胖病患者进行穴位埋线治疗,可有效降低体脂率,并且穴位埋线疗法具有疗程短、操作便捷、对患者的伤害较小等特点。
2.1.2 胶原线
胶原线是从一些哺乳动物体内提取出骨骼或筋腱,经过煮炼等工序处理提取出其中的胶原蛋白,之后通过纺纱工艺制成的一种可吸收缝合线。胶原线与羊肠线最大的区别在于胶原线与人体组织的相容性较好,不会产生较大的排斥反应[18],胶原线具有天然丝的优异力学性能,满足外科手术中的打结强度等力学指标,并具有手术缝合线应有的平滑度,和较好的弹性,又有利于人体吸收。
可吸收缝合线植入人体后,其降解速率是一个非常重要的指标。对于胶原线而言,可以采用化学交联的方式来调节分子的交联程度,从而达到控制胶原线降解速率的目的。温永堂等[19]利用交联剂与胶原蛋白进行交联,进而制备胶原可吸收缝合线,并研究了缝合线的力学性能与交联剂浓度的关系。此外,胶原蛋白缝合线在骨科[20]等I、II类手术切口缝合[21]的应用都很广泛,并且缝合效果好,后期愈合效果和平整度好,伤口瘢痕少,术后切口的疼痛感轻。Zhang等[22]回顾性分析了2021年1月—2022年1月在整形外科632例面创儿童患者的诊治痊愈形况,其中采用可吸收胶原线458例,不可吸收锦纶线174例。采用可吸收胶原线和美容缝合技术治疗面部紧急创伤患儿伤口,伤口愈合良好,疤痕扩张小,红斑和色素异常发生率低,无明显手术痕迹,无瘢痕肥大或萎缩。总体印象良好,避免了儿童患者拆线的痛苦,家属满意度高。尽管如此,胶原线还是存在一些缺点,如强度和降解速率不稳定,耐加工性差等。近年来,有学者扩大原料研究范围,从源头上解决了传统胶原蛋白强度不高等缺点的限制,发明出新型胶原蛋白类手术缝合线。Luan等[23]利用鱼鳔,通过择取鱼鳔中的纤维组织膜,并去除附着的脂肪黏膜和血管,之后再分离细胞内层膜制备出一种脱细胞交联的单链鱼鳔(DCSS)缝合线,鱼鳔作为鱼源性胶原蛋白,独具其本身的优势特点,即组织相容性极佳,强韧度较高,另外还具备传统哺乳动物胶原蛋白的优点,完全满足缝合应用的强度,无菌性,吸收性,组织相容性和多功能性等关键参数。
2.1.3 甲壳质
甲壳质又称甲壳素、几丁质,壳聚糖则是甲壳素脱除乙酰基的产物,被认为是比纤维素具有更大应用潜力的功能性生物材料[24]。以甲壳质为原料制备的缝合线具有很好的生物相容性,化学惰性,极低的组织反应,此外,甲壳质本身具有良好的抗菌性能,能够对感染的伤口进行杀菌消炎,从而加快伤口愈合,甲壳质缝合线在体内的降解速率为25 d左右,可完全被组织吸收,在胆汁,尿液,胰腺炎中的抗拉强度高于Dexon和羊肠线[25],甲壳质中的乙酰基数量决定甲壳质缝合线降解速度,其数目越少,降解速度越快[26]。在甲壳质可吸收缝合线的研究初期,普遍采用湿法纺丝工艺,东华大学实现了甲壳素纤维利用编织和加捻工艺制备甲壳质可吸收缝合线[27],性能较好,可应用于临床使用。
力学性能是评估手术缝合线极为重要的指标之一,因此海内外众多学者通过不同方法来加强缝合线的力学性能。Wu等[28]通过细菌纤维素纳米晶体(BCNC)强化再生甲壳素纤维(RC),开发出一种制备缝合线的新型材料,结果显示,制备的缝合线抗拉强度为(9.8±0.6)N,其降解速率也可通过对BCNC的浓度进行调节,表明细菌纤维素的加入有效地提高了产品的力学性能并对细胞增殖有促进作用。Tan等[29]通过碱性处理和超声降解,从鱿鱼软骨中制备了一系列具有不同脱乙酰化程度和黏均分子量的超高分子质量壳聚糖,并通过湿纺工艺制备了相应的壳聚糖单丝以作为缝合线的制备原料,结果显示脱乙酰化程度为85%、黏均分子量为1.16×106时表现出最佳的力学性能,干/湿抗拉强度为38.96 N/23.24 N,干/湿伸长率为14.6%/16.2%。
抗菌型可吸收缝合线因其靶向施药,可控释放等优点,近年来被广泛研究。而壳聚糖天然的抗菌性也成为许多开发新型缝合线首选的材料。Zhang等[30]开发出壳聚糖-明胶/单宁酸/聚吡咯复合涂层并修饰于缝合线表面,当皮肤产生伤口时,周围完好皮肤会产生电场并向伤口中心移动,而此时的电信号传输会有效调节细胞行为,包括黏附、增殖、迁移和分化,从而加速伤口愈合。聚吡咯是常见的导电聚合物,具有优异的导电性能以及生物相容性,壳聚糖充当抗菌剂,以此开发出具有电活性和抗菌性能的功能性可吸收缝合线。此研究为探索新一代生物活性缝合线提供了新思路。
2.1.4 海藻酸盐
海藻酸盐又称海藻酸胶,是一种由β-D-甘露糖醛酸和α-L-古罗糖醛酸2种结构单元组成的多聚糖。海藻酸盐为原料制成的可吸收手术缝合线具有极好的吸湿性、凝胶性,抗菌性和生物相容性,高透氧性以及可降解性。
Harpe等[31]制备了一种新型的生物可吸收缝合线并能进行局部药物输送。缝合线由海藻酸钠、果胶、和明胶组成,后整理工艺选择甘油作为塑化剂。由于海藻酸盐能够在各种多价阳离子存在下瞬时交联,而这种直接的交联过程避免了使用无机溶剂,也不会改变生物聚合物结构固有的生物相容性,体外分析显示,药物持续释放至第28天完成,表现出优异的缓释性能,另外,所制备的缝合线可安全地降解并被机体吸收;Huang等[32]将阳离子聚电解质ε-聚赖氨酸(PL)和阴离子天然多糖海藻酸钠(SA)混合制备成SA/PL混合液,该混合液可自行通过静电组装的形式在接触界面形成SA/PL复合膜,并可直接通过镊子即从溶液中拉取得到复合长丝,在室温下干燥后便得到成品缝合线。力学性能表征显示,随着PL含量的增加,SA/PL纤维的断裂伸长率变低,而抗拉强度变高并且该复合纤维的尺寸可控。小鼠实验以及抗菌等实验结果显示,SA/PL复合纤维可通过抵抗病原体感染、减少炎症、抗伤口的异体过敏来促进小鼠背部皮肤伤口的愈合和修复。该研究提供了一种全新制备可吸收缝合线的新方法新思路,并且该研究的制备工艺过程安全绿色无污染。
海藻酸盐还多被用于功能涂层整理剂来改善缝合线的相关性能。Selvaraju等[33]利用海藻酸钠的高度水溶性充当固化剂,并将其与乙醇蜂胶提取物合成的银纳米颗粒相结合,通过上浆浸渍技术将蜂胶银纳米颗粒涂覆在手术缝合线上。体外抗菌分析表明,蜂胶银纳米颗粒涂层缝合线对临床致病微生物具有显著的抗菌活性;Lauren等[34]通过制备一种纤维素纳米纤维与海藻酸盐复合的水凝胶涂层整理材料(NFCA),将其涂覆于3-0号可吸收手术缝合线,以增强细胞黏附性和活性能够,从而加快伤口的愈合。
2.2 合成类高分子可吸收缝合线
2.2.1 聚乳酸类缝合线
聚乳酸(PLA)作为新世纪最有潜力的生物医用材料之一,已经被广泛开发为各种基聚乳酸材料的生物医用品,尤其在手术缝合线方面,因其优异的可降解性,良好的生物相容性,无毒性,优良的力学性能,聚乳酸被视为制备手术缝合线最为理想的材料之一。
聚乳酸虽然具备降解性能,但是作为手术缝合线而言,纯聚乳酸的降解速度过于缓慢且难以控制,对于伤口的闭合恢复不是很灵活,另外,聚乳酸天然结晶困难而表现出脆性较大,导致其作为缝合线的韧性无法满足要求。Wu等[35]制备了一种聚乳酸(PLLA)和聚己内酯(PCL)涂覆的聚二氧六环酮(PDO)缝合线,扫描电子显微镜(SEM)观察发现,涂层后的缝合线表面光滑,体内研究表明缝合线涂层后,其降解特性发生了明显变化。未涂层的缝合线在12周内表现出最快的降解,显示出力学强度的明显下降。经涂层的缝合线在植入12周后能够保持20%以上的原始拉伸强度。张晓芳[36]开发出一种释药可控聚乳酸手术缝合线,采用PCL和PGA 2种降解速率不同的生物降解材料,通过调节组分配比,配制成载药涂层整理液,针对情况不同的伤口,可选择释药速率、释药周期不同的缝合线处理伤口。刘明芳等[37]利用脂肪酶处理缝合线,使表面羟基数量增多,然后接枝壳聚糖,结果显示明显改善了聚乳酸手术缝合线的亲水性。刘淑强等[38]开发了载药微球聚乳酸手术缝合线,首先采用乳化-溶剂挥发法成功制备了聚乳酸载药微球,然后通过黏合剂醋酸淀粉将微球牢固负载于缝合线上,释药期达到8 d,达到良好的药物缓释效果。并且处理后的缝合线也保持了优良的柔韧性和力学强度。
2.2.2 聚乙醇酸类缝合线
聚乙醇酸(PGA)具有优良的力学性能、生物相容性、生物可降解性,无毒性且组织反应小。PGA的分子间氢键作用力强,分子链结构高度规整,结晶度较大,一般为46%~52%。1970年,美国公司发布商品名为Dexon的PGA可吸收缝合线,是在肠线之后最为普遍商业化的缝合线[39]。
近五年关于PGA类缝合线国内外报道较少,PGA天然降解速度过快,纯PGA制备的缝合线不足以在一定时间内为伤口提供相应的力学支撑,因此,已有的关于PGA缝合线的研究是利用PGA材料降解速度快这种特性改善现有缝合线的降解性能,多作为涂层剂和载药载体应用于缝合。载药缝合线的药物释放时间应与伤口愈合时间保持一致,因此对缝线释药速率的调整就显得尤为重要。Liu等[40]应用聚己内酯(PCL)和聚乙二醇(PGA)这2种具有不同降解率的可降解聚合物来负载茶多酚(TP)药物,主体缝合线选用聚乳酸(PLA)材料进行制备。通过调整PCL/PGA的组分配比,以此来调节药物的释放速率和释放时间且缝合线的药物释放率在早期较快,后期较慢。另外,随着药物载体中PCL的增加,缝合线的抗张强度逐渐增加。当PCL/PGA质量比为70/30时,缝合线的断裂伸长率达到最高。Marimallappa等[41]通过对62名患者使用2种不同类别的缝合线:丝绸缝合线和PGA缝合线,在缝合处理一段时间后对比,发现PGA类缝合线相对于丝绸类缝合线表现出较低的细菌黏附,而丝绸类缝合线表现出较高的好氧性细菌黏附,结果表明,较少的细菌黏附和可吸收的PGA缝合线是口腔内手术的更好选择。
2.2.3 聚己内酯类缝合线
聚己内酯(PCL),又称聚ε-己内酯。PCL具有优异的生物降解性和良好的生物相容性,并且具有优良的有机高聚物相容性,可作为细胞生长的载体,不会与组织发生不良反应,在自然环境下6~12个月即可完全降解。此外,PCL具有较好的温控性质,可以开发多种具有良好形状记忆的产品。PCL已被广泛应用于生物医用方面,尤其在缝合线的开发制备,成为最热门的应用材料之一。
Jing等[42]通过双螺杆挤出机将热塑性聚氨酯(TPU)和聚ε-己内酯(PCL)进行熔融复合,发现含有25%的TPU和75%的PCL的混合物具有最好的形状记忆特性,其形状固定率为98%,形状恢复率为90%。最终制备出具有形状记忆的手术缝合线,室温下保持临时形状,在热水浴中只需2 s即可自行打结。余璠[43]通过浸渍涂层法将聚己内酯负载盐酸川芎嗪作为药物缓释系统涂覆于PGA基编织缝合线上,制备出药理与物理双重刺激共存的载药埋植线,埋线随着 PCL 浓度的增大,涂层次数的增多,主体缝线的宏观编织结构趋于光滑。Hu等[44]通过静电纺制备聚己内酯(PCL)纤维,并与胶原蛋白(COL)和生长因子(bFGF)结合,以制备bFGF-COL/PCL缝合线,显微观察缝合线的纤维微观结构整齐度良好、并且具有较好的力学性能,bFGF-COL/PCL缝合线通过加速肉芽组织形成、胶原蛋白沉积和再上皮化,显著促进不同阶段的伤口愈合。
2.2.4 聚乙烯醇类缝合线
近年来,聚乙烯醇(PVA)在生物医用材料领域十分热门,医用型聚乙烯醇的安全性极高,对人体无害无毒副作用,具有优异的生物可降解性和生物相容性,广泛被制备成人工肾膜等药用膜。
Lee等[45]开发了一种药物释放电子缝合系统(DRESS)以实时监测缝合的完整性及伤口情况,能够实现连续的应变监测和热通量控制并通过触发药物释放增强组织再生。该系统由“壳-芯”结构组成,芯层由银纳米粒子嵌入到聚氨酯多丝纤维中构成,银纳米粒子的高导电性赋予整个缝合系统的高导电性;壳层由柔性聚乙烯醇接枝到聚(N-异丙基丙烯酰胺)组成一种热膨胀涂层,该涂层在温度变化时显示出良好的膨胀和脱泡行为,从而使其适用于药物输送,以便按需释放。Ranjbar等[46]通过对喷静电纺技术制备聚乳酸(PLA)/盐酸四环素(T)-聚乙烯醇(PVA)/壳聚糖(CS)纳米纤维。将CS/PVA纺丝液从一个注射器喷出,PLA/T纺丝液从另一个注射器喷出,之后将收集好的复合纳米纤维进行加捻来制备缝合线,另外,盐酸四环素的加入可以改善缝线的亲水性,但其使用量超过2 g/d时将会引起肝毒性。抗菌实验显示缝线对金黄色葡萄球菌和大肠杆菌显示出理想的抗菌效果,并能有效防止细菌的附着。
2.3 抗菌免疫新型可吸收手术缝合线
尽管现代医疗保健水平取得了重大进展,但对于外科手术部位的感染问题仍然对术后伤口的护理和痊愈构成严重威胁。对于大部分伤口出现的感染问题,临床通用的做法是口服抗生素类药物施药全身,此行为会直接对体内部分脏器官造成影响,且间接治疗伤口炎症,长期服用不仅会使受损组织产生耐药性,还会极大地威胁人体安全健康,因此,对于伤口处的抗菌处理,应当对其进行靶向释药,此手段能够高效地缓解伤口的感染问题。Otto等[47]通过29项随机对照研究的meta分析发现,三氯生抗菌涂层的手术缝合线显著降低了术后感染率(24%)。另外,随着手术缝合线的更新换代,拥有越来越高附加值的抗菌型可吸收手术缝合线也相继问世,目前赋予手术缝合线抗菌性能也成为当今缝合线研究不可或缺的一部分。
纳米涂覆是当今制备抗菌型手术缝合线较为热门的方法之一,将选定的抗菌性物质加工成为纳米颗粒,随后通过涂层、沉积以及吸附等方法与缝合线相结合,赋予缝合线抗菌性能。Mehmet等[48]利用低温真空沉积的方法,将纳米银均匀涂覆在聚乙醇酸类可吸收手术缝合线上,抗菌实验结果显示,在温度为200 K和300 K环境下进行银涂层的缝合线周围可以看到明显的细菌生长抑制区,证明了此缝合线的灭菌效果良好,在预防手术感染和消除感染方面具有显著优势。该研究提出了一种银包覆抗菌生物材料在临床应用中的新方法,此外,也表明可通过低温下的真空沉积来制备量子效应的缝合线,但缝合线力学性能研究提出,在温度300 K时涂覆银离子的手术缝合线抗张强度明显下降,发生了应变恶化的现象,力学性能不能很好地保持。Sunitha等[49]开发出一种盐酸环丙沙星(CPH)负载的金纳米颗粒(CPG-NPs),然后通过吸附的手段将其结合到手术缝合线上,最终使用海藻酸钠通过离子交联进行强化,作为缝线的刚性涂层。抗菌实验显示,CPG-NPs缝合线的抑菌区为CPH包覆的缝合线抑菌区的2倍,此外,由于金纳米颗粒的存在,使得CPH的负载面积大幅增加,从而使CPG-NPs缝合线的抗菌活性更强,释药时间可持续72 h。该研究提出了一种新型手术缝合线的抗菌作用机制,能够增加药物的负载量并且可以在一定时间内持续释放药物,对于缝合伤口管理模式提供了新思路。
3 结束语
医用手术缝合线已成为当今医疗行业不可或缺的一部分,而可吸收类(可降解)手术缝合线依据其优异的性能也势必将取代非吸收手术缝合线成为外科医疗手术中的主角,虽然其发展日趋成熟,但仍存在一些问题,具体如下:
1)天然类可吸收手术缝合线的相关研究较少,初代的天然可降解缝线如羊肠线存在力学性能差,易引发组织细胞反应等不良机体反应;天然甲壳素纤维的生物相容性好,不易引发组织反应并且还有天然的广谱抗菌性能,成为当今研究手术缝合线的热点材料之一,但多数研究方向将壳聚糖作为功能性抗菌涂层涂覆于缝合线的表面,以增加抗菌性能,而在缝合线的制备方面,采用甲壳素纤维进行组装的研究甚少。
2)合成类可降解材料成为近二三十年来开发新型手术缝合线的热门材料,随着科技的进步与发展,越来越多的具备优异性能的合成高分子材料将用于手术缝合线的开发,但大多数的合成材料的降解速率及时间不可控,伤口的愈合程度应与缝合线的降解程度相互匹配,若缝合线的降解过快,会导致伤口愈合迟滞并继发感染,若缝合线的降解过慢,则会在皮肤表面留下瘢痕,因此,对于缝合线的降解可控显得尤为重要。
3)负有抗菌性的可吸收缝合线仍是当今乃至未来的研究主题,如何将抗菌性物质稳定均匀长效的负载到缝合线上仍是一大难题,虽有学者在不断创新开发各种抗菌缝合线,但市售的抗菌类可吸收缝合线仍以进口为主导。
目前为止,我国可吸收类缝合线的相关研究仍处于实验室阶段,在实际产业化中仍然存在瓶颈并亟待解决,比如质量稳定性不够导致的力学性能欠佳,高档次的可吸收缝合线没有自主知识产权等,因此在未来的研究中,应当在提高可吸收缝合线附加值的同时考虑缝合线的匀质化。
