盐酸氨溴索注射液玻璃安瓿包装中20种元素迁移量的测定与风险评估
2024-03-13齐艳菲贾菲菲王颖赵霞杨会英中国食品药品检定研究院北京100050
齐艳菲,贾菲菲,王颖,赵霞,杨会英(中国食品药品检定研究院,北京 100050)
盐酸氨溴索注射液是一种呼吸系统药物,具有促进黏液溶解的功能,可促进呼吸道内黏稠分泌物的排除及减少黏液的滞留,主要用于各种慢性呼吸道疾病的祛痰治疗,早产儿及新生儿的肺炎的治疗等。临床应用广泛,疗效好,无明显毒副作用,且耐受性较好[1-4]。盐酸氨溴索注射液的包装容器为棕色玻璃安瓿。玻璃安瓿的生产工艺有两步,首先由石英砂、长石或氢氧化铝、硼砂、纯碱等物料按一定比例混合后经高温熔融制成玻璃管,然后再借助火焰热二次加工成型[5-6]。其主要成分有SiO2、B2O3、Al2O3、Na2O、K2O、CaO、MgO、BaO等,另外还有一些辅助玻璃成分,用以获得玻璃的某种特性,如Li2O能够降低玻璃的黏度,提高玻璃的化学稳定性,As2O3、Sb2O3、CeO2可作为澄清剂,以及TiO2、MnO、Fe2O3、CoO等为玻璃着色剂,玻璃原材料以及生产过程亦会引入一定量的有害元素,如Pb、Cd等[7]。
药物长时间贮存于玻璃包装容器内,会对玻璃容器内表面产生侵蚀,导致玻璃组分迁移至药液中,严重时产生玻璃脱片,玻璃脱片若进入人体,会造成人体局部血管堵塞、过敏等严重不良反应。玻璃主要成分如Si、B、Al等元素的迁移量可反映玻璃包装容器被药液侵蚀的程度,预测发生玻璃脱片的风险[8-9]。同时,浸出组分可能与药物结合导致沉淀的产生或药品性状的改变,而影响药品的质量。另外,毒性较大的元素迁移进入药液也会产生潜在的安全性风险[10-11]。因此,玻璃包装容器元素迁移量的测定是药物与玻璃容器相容性研究及安全性评价中至关重要的一部分。
目前元素分析方法主要有原子吸收分光光度法(AAS)、电感耦合等离子体原子发射光谱法(ICP-OES)、电感耦合等离子体质谱法(ICPMS)与原子荧光光谱法(AFS)等。原子吸收光谱法每次只能测1个元素,应用于多批次样品的多种元素测定时费时耗力,并且测定部分元素时灵敏度较差。原子荧光光谱法虽具有较好的灵敏度,并且可实现多元素同时检测,但可测的元素种类很少。ICP-MS与ICP-OES可同时进行多元素分析,方法简便、快速、高效。两种仪器所适用的待测元素浓度范围不同,可根据不同元素的特点及含量,选择不同的方法[12]。
本文建立了ICP-MS与ICP-OES法测定盐酸氨溴索注射液玻璃安瓿包装中20种元素的迁移量,并对测定的结果进行风险评估。根据元素迁移趋势,分析盐酸氨溴索注射液与玻璃包装容器的相互作用情况,为盐酸氨溴索注射液与玻璃包装容器的相容性研究结果的评价提供依据,为玻璃包装容器元素迁移量的测定提供参考。
1 仪器与试药
iCAP RQ型电感耦合等离子体质谱仪(Thermofisher科技有限公司);岛津ICPE-9820型电感耦合等离子体发射光谱仪(岛津科技有限公司)。
Si、K、Ca、Ce、Zr、Ge、In、Rh、Tb、Sc、Lu单元素标准溶液(国家有色金属及电子材料分析测试中心,1000 μg·mL-1);Al、As,B、Ba、Be、Bi、Cd、Co、Cr、Cu、Fe、Ca、Li、Mg、Mn、Ni、Pb、Sb、Sn、Sr、Ti、TI、V、Zn 24种元素混合标准溶液(国家有色金属及电子材料分析测试中心,100 μg·mL-1);65%硝酸(德国默克密理博公司)。盐酸氨溴索注射液(国内A公司,批号分别为20181105、20181106、20181107,规格:2 mL/15 mg)。中硼硅玻璃安瓿(棕色,国内B公司,批号分别为181003、181004、181005,规格:2 mL)。3批药液与3批包材对应得到5批药品,对应关系如表1。
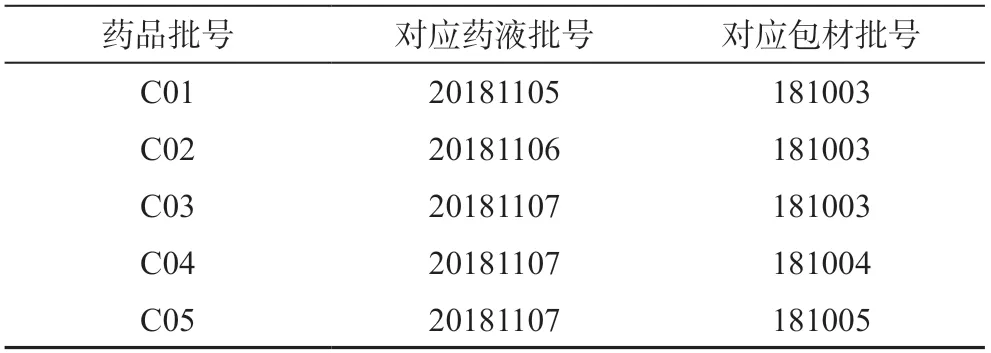
表1 药品与包材批号的对应关系Tab 1 Correspondence of batch number between drug and package
2 方法与结果
2.1 元素测定种类的选择
测定元素范围参考国际人用药品注册技术协调会(ICH)Q3D 元素杂质指南注射剂风险评估建议考虑的元素种类,并结合其中关于包装材料中浸出的元素杂质风险评估的建议,对于该类包装材料中不涉及的元素杂质,无需进行额外的风险评估[13],最终选择了第一类元素Cd、Pb、As,第2A类元素Co与第三类元素Li、Sb、Ba、Cr。另外参考《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》元素迁移试验中建议的元素种类以及棕色玻璃安瓿的主要成分及可能添加的辅助成分[8],增加了Si、B、Al、Na、K、Ca、Mg、Fe、Mn、Ti、Zn、Ce、Zr元素。由于本药品含有大量的Na元素,Na元素的测定结果难以准确反映玻璃容器中Na元素的迁移量,因此本文测定了上述除Na元素以外的20种元素。
2.2 仪器参数
2.2.1 ICP-MS 用调谐溶液对仪器条件进行优化,射频功率1.55 kW,等离子体氩气流速l4 L·min-1,载气压力0.65 MPa,载气流速1.04 L·min-1,采样深度5.0 mm,蠕动泵速40 r·min-1。氦碰撞模式,氦气流速4.86 mL·min-1。内标元素校正方式采用内插法,以45Sc、73Ge、103Rh、115In、159Tb、175Lu为内标元素,校正因子根据各内标元素的回收率及内标元素与待测元素质量数的差异进行加权计算。测定7Li、11B、24Mg、27Al、48Ti、52Cr、55Mn、57Fe、59Co、65Zn、75As、90Zr、111Cd、121Sb、137Ba、140Ce、208Pb共17种元素,以45Sc、73Ge、103Rh、115In、159Tb、175Lu混合溶液作为内标。
2.2.2 ICP-OES 射频功率1.2 kW,等离子体气流量10 L·min-1,辅助气流量0.6 L·min-1,载气流量0.7 L·min-1,泵速40 r·min-1,溶剂冲洗时间20 s,样品冲洗时间15 s,曝光时间15 s,观测模式:轴向。测定Si、K、Ca 3种元素,测定波长分别为251.611 nm、769.896 nm、422.673 nm。
2.3 标准溶液的制备
2.3.1 ICP-OES测定用标准溶液 分别精密量取Si元素标准溶液1 mL至100 mL塑料量瓶中,以2%硝酸溶液稀释至刻度得到质量浓度为10 μg·mL-1的标准储备液1。精密量取标准储备液1适量,以2%硝酸溶液稀释成质量浓度分别为0.05、0.1、0.5、1.0、2.0 μg·mL-1的系列标准溶液。精密量取K、Ca标准溶液适量,以2%硝酸与0.09%氯化钠溶液配制质量浓度分别为0.05、0.1、0.5、1.0、2.0 μg·mL-1的系列标准溶液,配制方法同Si元素。
2.3.2 ICP-MS测定用标准溶液 精密量取多元素标准溶液1 mL与Zr、Ce元素标准溶液0.1 mL至100 mL量瓶中,以2%硝酸溶液稀释至刻度得到质量浓度为1000 ng·mL-1的标准储备液2。精密量标准储备液2适量,以2%硝酸溶液配制成质量浓度分别为2、5、10、20、50、100 ng·mL-1的系列标准溶液。精密量取Ge、In、Rh、Tb、Sc、Lu标准溶液适量,以2%硝酸溶液配制质量浓度为50 ng·mL-1的ICP-MS内标校正溶液。
2.4 供试品溶液的制备
分别取各批次盐酸氨溴索注射液20支,将药液混匀,精密量取药液1 mL,以2%硝酸溶液稀释至15 mL,摇匀,即得。
2.5 方法学考察
2.5.1 线性关系考察 取“2.3”项下系列标准溶液,分别测定各元素的响应值,以质量浓度为横坐标,标准溶液的响应值为纵坐标,绘制各元素的标准曲线,计算回归方程和相关系数,结果见表2。

表2 20种元素线性、检测限、定量限、精密度测定结果Tab 2 Lineary,LODs,LOQs,and precision of 20 element
2.5.2 检测限与定量限 取空白溶液即2%硝酸溶液连续测定11次,以测定结果的3倍标准偏差所对应的浓度值作为检测限,以测定结果的10倍标准偏差所对应的浓度值作为定量限,结果见表2。
2.5.3 精密度 取“2.3”项下ICP-MS测定用质量浓度为50 ng·mL-1的17种混合元素标准溶液,ICP-OES测定用质量浓度为1 μg·mL-1的Si、K、Ca元素标准溶液,分别连续测定6次,计算各元素测得浓度的RSD,结果见表2,RSD均小于3%,表明仪器精密度良好。
2.5.4 加标回收率 取批号为C03的盐酸氨溴索注射液20支,混匀,精密量取1 mL至15 mL量瓶中,平行9份,根据样品中不同元素的浓度范围,分别加入一定量的标准储备液(Li、Cr、Mn、Fe、Co、As、Zr、Cd、Sb、Ce、Pb 11种元素的加标质量浓度为8、10、12 ng·mL-1。Al、Ti、Zn、Ba 4种元素的加标质量浓度为16、20、24 ng·mL-1。B、Mg元素的加标质量浓度为32、40、48 ng·mL-1。Si元素的加标质量浓度为400、500、600 ng·mL-1,K、Ca元素的加标质量浓度为160、200、240 ng·mL-1),加2%硝酸溶液稀释制成80%、100%、120%浓度水平的加标供试品溶液,每个加标浓度平行制备样品3份,按“2.4”项下方法制备供试品溶液。结果20种元素低、中、高浓度的加样回收率均在90.6%~107.7%,各元素测定值的RSD均小于5%,表明本方法回收率良好。
2.5.5 重复性 取批号为C03的盐酸氨溴索注射液6份,按“2.4”项下方法制备供试品溶液,测定B、Mg、Al、Ti、Fe、Ba、Si、Zn等8种元素的浓度,并计算RSD。其余元素含量极低或未检出,故采用加标的方法进行考察,加标浓度为“2.5.4”项下加标回收率项下低浓度水平。结果各元素测定值的RSD均小于5%,说明本法重复性良好。
2.6 样品的测定
取不同批次加速0、3、6个月的盐酸氨溴素注射液,进样测定,每份样品平行测定3次,计算平均值,结果见表3。5批样品中均未检出Ca、Sb、Pb、Cd、Ce,均检出一定量的Si、B、Al、K、Fe、Ti、Ba、Zn、Mg、Mn、Co、Cr、Li、As、Zr元素。其中玻璃主成分Si、B、Al元素随着加速时间的延长,迁移量明显升高,另外Fe、Ti、Ba、Li元素亦随着加速时间的延长,迁移量有轻微的升高,预示盐酸氨溴索注射液对玻璃安瓿产生了一定的侵蚀作用,导致玻璃配方组分及添加的着色剂、澄清剂等浸出。
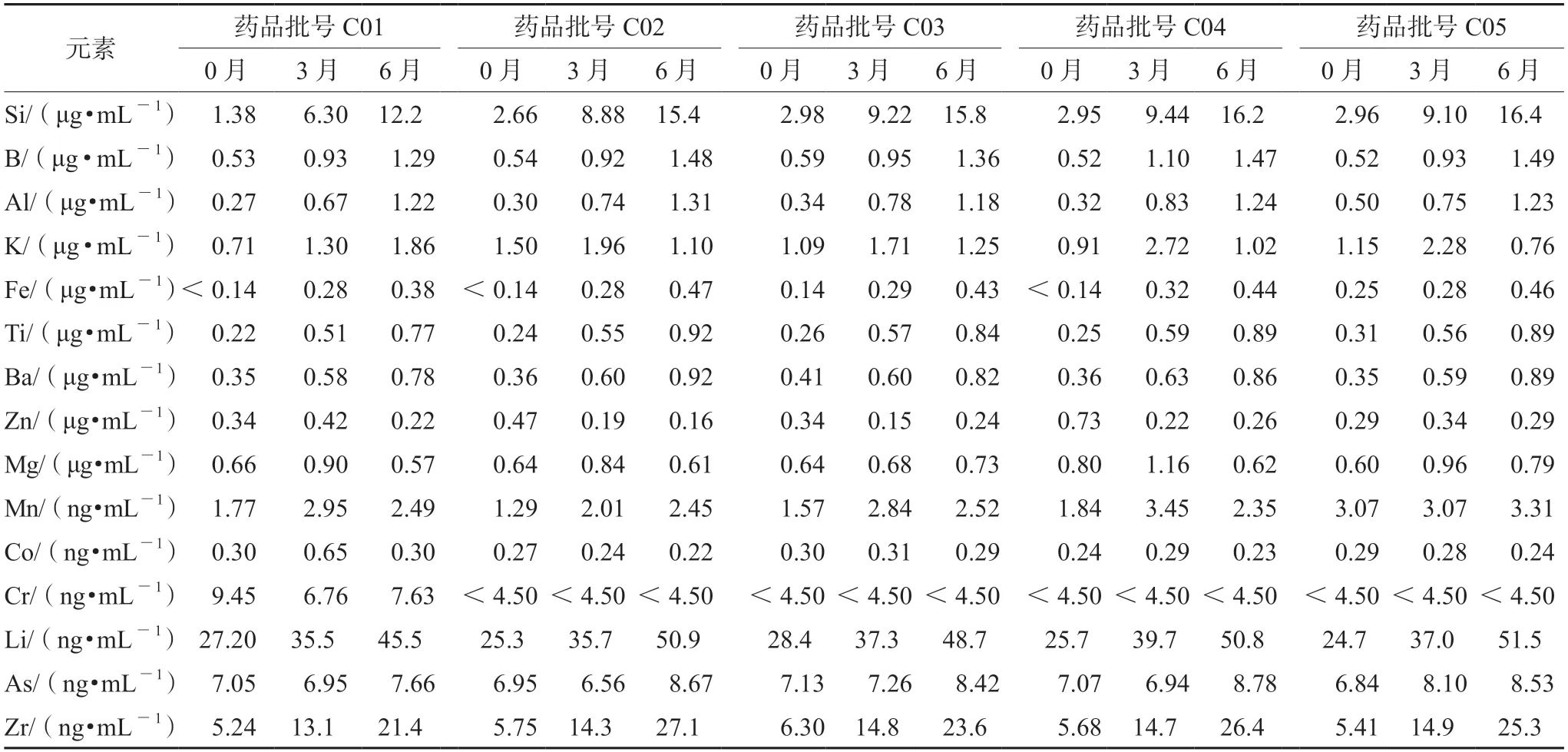
表3 20种元素在不同加速时间样品中的含量Tab 3 Content of 20 elements in different acceleration time samples
2.7 风险评估
参考ICH Q3D和《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》中的附件6,将药品中已建立日允许最大暴露量(PDE)的30%定义为控制阈值,对已建立PDE数据的Li、Cr、Co、As、Cd、Sb、Ba、Pb、Fe、Zn 10种元素进行风险评估[10,13]。其他10种元素由于毒性较低等原因,尚未建立PDE标准。参考欧洲药品管理局(EMEA)颁布的金属催化剂或金属试剂残留量限度的规定文件,Mn元素是第二类元素,注射剂中PDE值为250 μg·d-1[14]。Ce、Ti元素均有文献报道其具有一定的毒性,例如欧盟委员会(EC)将TiO2分类为两类吸入致癌物,但还缺少充分的毒理学数据建立PDE值[15-17]。因此将其安全性视为与第二类金属元素相似,PDE值为250 μg·d-1。K、Ca、Mg元素为人体必需的常量元素,未见相关毒理学数据的报道,因此将其安全性视为第三类元素,注射PDE值为1300 μg·d-1。参考相关文献,Si、B、Al元素的推算PDE值分别为25 000 μg·d-1、160 μg·d-1、250 μg·d-1[18]。
根据样品的20种元素的测定结果,计算每日最大摄入量,均远低于控制阈值(30%PDE)(见表4,该药品的每日最大剂量为3瓶,折合每日用量为6 mL,根据表3检测的元素浓度结果,计算出元素每日实际摄入量,未检出的样品按检出限计算),表明元素迁移量在安全范围内。另一方面,玻璃组分的迁移量及趋势可反映玻璃容器被侵蚀程度,Si、B、Al元素随着加速时间的延长,迁移量显著增加,预示发生玻璃脱片的倾向性,虽然盐酸氨溴索注射液中未见玻璃脱片,且不溶性微粒等指标未见变化,但仍需继续监测其发生玻璃脱片的风险。

表4 元素迁移结果的风险评估Tab 4 Risk assessment of element migration results
3 总结与讨论
3.1 测定方法的选择
ICP-MS法与ICP-OES法均能同时测定多种元素,ICP-MS法检测灵敏度高,且注射液中大部分元素的迁移量较低,因此选择ICP-MS法测定其中的17种元素。ICP-MS法测定Si、K、Ca时,由Ar、C、O、H等原子组成的多原子离子质谱干扰非常严重,虽可以采用碰撞模式消除,但结果灵敏度、重复性、准确性等均不理想,且玻璃包装容器中Si、K、Ca 3种元素的迁移量也相对较高,因此采用ICP-OES法测定。
3.2 供试品溶液制备方法的选择
元素分析时样品常需要进行一些前处理,微波消解是一种常用的前处理方法,常用于一些基质较为复杂的样品。盐酸氨溴索注射液由于结构简单,且浓度较低(2 mL/15 mg),供试品溶液的制备对比了直接稀释法与微波消解法,测定结果基本一致。考虑到微波消解法比较耗时,且赶酸过程对环境要求较高,易引入元素杂质,因此,供试品的制备采用了直接稀释法,能够满足测定需要。
3.3 干扰的消除
ICP-MS法测定As元素时,由于溶液中含有大量的Cl-与载气形成40Ar35Cl的多原子离子,影响75As的测定,本文采用氦碰撞模式,消除多原子离子的干扰。盐酸氨溴索注射液辅料中含有磷酸氢二钠、氯化钠等成分、对部分元素的测定存在基质干扰问题,当采用ICP-OES法测定K元素时,由于Na、K等碱金属很容易电离,大量Na存会使得K电离平衡向原子态转变,抑制K的电离,使K的原子线信号增强,导致结果偏高,因此本文采用了基体匹配法测定了K、Ca元素。
3.4 盐酸氨溴索注射液对玻璃安瓿包装的侵蚀作用及包装容器选择的建议
玻璃安瓿包装盐酸氨溴索注射液后,终端灭菌及加速放置过程中,盐酸氨溴索注射液会与玻璃安瓿的内表面发生相互作用。一是注射液中的大量水对玻璃产生侵蚀作用,水中的H+与玻璃中的金属阳离子发生离子交换,部分金属氧化物迁移至药液中[19]。二是配方中含有枸橼酸、磷酸氢二钠、氯化钠等组分,枸橼酸盐、磷酸盐、Cl-等一方面作为亲核试剂,对玻璃骨架产生侵蚀作用,另一方面,与玻璃组分形成络合物,加速侵蚀过程,导致玻璃主要成分迁移至药液中[20]。两种机制共同作用导致了玻璃组分迁移至盐酸氨溴索注射液中。
盐酸氨溴索注射液配方中存在多种与玻璃容器发生相互作用的组分,导致玻璃中部分元素的浸出。并且盐酸氨溴索注射液对光不稳定,需要棕色玻璃安瓿包装,但棕色玻璃容器会加入一定量的着色剂如MnO、TiO2等,一定程度上降低了玻璃主要成分的比例,从而降低其化学稳定性。建议盐酸氨溴索注射液的生产企业在选择棕色玻璃安瓿时,严格把控玻璃容器的质量,开展风险评估,关注玻璃成分和杂质元素的浸出风险以及玻璃容器内表面化学耐受性和脱片风险,以保证药品的质量和安全。
3.5 小结
本文建立了ICP-MS法与ICP-OES法同时测定盐酸氨溴索注射液玻璃安瓿瓶中20种元素的迁移量,测定方法快速、简便,结果准确。各元素按每日最大摄入量计,均在安全范围内。玻璃主要成分Si、B、Al元素迁移量随着加速时间的延长明显升高,预示玻璃安瓿被药液侵蚀,玻璃组分迁出,虽未最终影响药品质量,但应持续关注其可能产生玻璃脱片的风险。本文可为盐酸氨溴索注射液的包材相容性及安全性评价提供技术支撑,为注射剂与玻璃包装容器相容性研究中元素迁移量的测定提供参考。
