肺动脉高压治疗药物新靶点的研究进展
2024-03-13李昱辰李欣玫吴凡李特大理大学药学院云南大理671000云南省阜外心血管病医院药剂科昆明65010
李昱辰,李欣玫,吴凡,李特*(1.大理大学 药学院,云南 大理 671000;.云南省阜外心血管病医院 药剂科,昆明 65010)
肺动脉高压(pulmonary hypertension,PH)是以肺动脉(主要是肺小动脉)病变导致的肺血管阻力和肺动脉压升高为主要特征的恶性进行性疾病,严重者可致右心衰竭(RHF)甚至死亡。最新数据表明,PH的成人发病率和患病率分别为每百万人0~6例和48~55例[1-2]。由于病情发展迅速,具有高致死率、致残率,一度被视为心血管领域的“恶性肿瘤”[3]。根据2022欧洲心脏病学会/欧洲呼吸病学会(ESC/ERS)肺动脉高压指南[1],其分为动脉型肺动脉高压(PAH)、左心疾病相关肺动脉高压、肺部疾病和/或低氧相关肺动脉高压、肺动脉阻塞病相关肺动脉高压以及未明和/或多因素所致肺动脉高压五类。其中,主要推荐PAH患者使用靶向药物[1]。
当前我国PH药物治疗包括常规治疗和特异性治疗。常规治疗涵盖抗凝、利尿、其他心血管药物以及贫血治疗;特异性治疗包括钙通道阻滞剂和靶向治疗[1-2]。靶向药物主要包括作用于前列环素途径、内皮素途径和一氧化氮(NO)途径的药物。在我国,已上市的靶向治疗药物包括前列环素类似物、内皮素受体拮抗剂(ERA)、5型磷酸二酯酶抑制剂(PDE5i)以及可溶性鸟苷酸环化酶(sGC)刺激剂等,显著改善了患者的症状和肺血流动力学,提高了患者的生存率[4-5]。《2021中国心血管健康与疾病报告》概要表明,自2006年靶向药物波生坦在我国上市,我国正式进入了靶向药物时代,特发性肺动脉高压(IPAH)患者的三年生存率从38.9%提升至75.1%[6-7]。因此,国内外指南均强调需早日启用靶向药物治疗。然而,当前靶向药物在满足患者治疗需求方面仍有待提升,仍需不断探索新的治疗靶点[3]。
本文对现有靶向药物的治疗情况进行了回顾,并对PH新的靶点治疗药物进行总结,以期为后续PH靶向药物治疗的研究提供参考。
1 PH靶向药物治疗现状
PH的发病机制尚未完全明确,当前研究表明,血管内皮功能障碍、NO合成受损以及一氧化氮-鸟苷酸环化酶-环鸟苷酸(NO-sGC-cGMP)途径刺激不足是其最主要的病理特征,血管内皮损伤可致细胞增殖、肺血管重构以及血管收缩,继而导致肺血管阻力(PVR)升高,最终导致RHF甚至死亡[4,8]。目前,靶向治疗旨在通过前列环素途径、内皮素途径和NO途径来恢复血管活性介质的失衡,目前应用的靶向药物主要包括前列环素类似物、前列环素受体激动剂、ERA、PDE5i以及sGC刺激剂等(见表1)[8-9]。

表1 PAH传统靶向治疗药物Tab 1 Traditional target therapy drugs for PAH
据2022ESC/ERS肺动脉高压指南[1],对于无心肺并发症的急性血管反应试验阴性的IPAH、遗传性PAH(HPAH)及药物和毒物相关的PAH(DPAH),靶向药物联合治疗方案推荐见表2;伴有心肺并发症的患者,初始治疗给予PDE5i/ERA单药治疗,随访过程中,若出现中/高危风险,则可根据个体差异加用PH靶向药物。
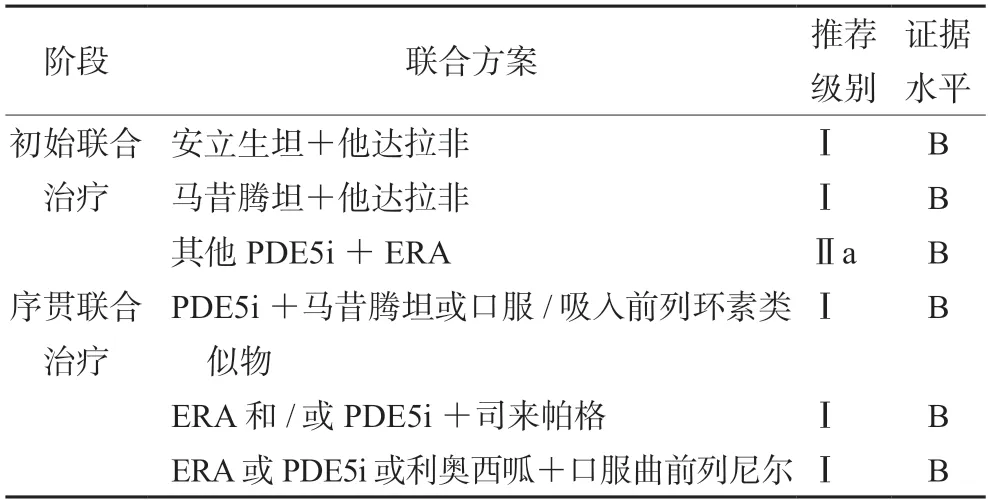
表2 PAH靶向治疗药物联合治疗方案Tab 2 Combination therapy with PAH target drugs
根据已有的临床证据,靶向药物的应用在改善PH患者的临床表现、血流动力学、心功能以及运动能力等方面效果显著,明显提升了患者的生命质量[10-14]。然而,当前治疗药物仅仅能延缓病情恶化,患者的长期预后仍不尽如人意[15]。因此,深入了解PH发病机制对于寻找新的治疗靶点具有极其重要的意义。
2 PH新靶点治疗药物
近年来,通过对PH病理生理机制研究的不断深入,许多新靶点的治疗药物逐步被发现,如TLR3激动剂Poly(I∶C)、STAT3信号通路的Corosolic acid等(见表3)[16-29]。

表3 PAH新靶点治疗药物Tab 3 New target therapy drugs for PAH
3 老药新用
与此同时,许多已广泛应用的药物(如布洛芬、左西孟旦等),也从中发现了针对PH的新靶点[30-43](见表4)。

表4 其他药物对PAH的作用Tab 4 Effect of other drugs on PAH
上述药物为PH的治疗提供了更多的可能,其中,紫杉醇单药制剂由于靶向性差、生物利用度低等,尚未用于PH的治疗;而徐瑞等[43-44]的研究表明紫杉醇的纳米晶-caspase-3复合物及脂质体能够对PH产生积极影响。近年来,亦有对联合用药改善PH展开研究,其中,研究主要集中在雷帕霉素与其他药物的联用,如联用STAT3抑制剂HO-3867,可降低肺和心脏组织中STAT3和mTOR两种信号通路的蛋白磷酸化水平,从而降低PH,改善肺血管重构,减少RVH;联合低剂量伊马替尼抑制mTORC1、mTORC2和血小板衍生生长因子受体(PDGFR),提高了PASMC抗增殖、抗迁移能力,降低了RVSP、Fulton指数和右心室/体重(RV/BW)[45-46]。此外,p53激动剂Nutlin3a和HIF-2α拮抗剂PT2385联合治疗可同时抑制缺氧诱导的平滑肌细胞(SMC)增殖和肺动脉内皮细胞(PAEC)凋亡[47]。因此,今后可以加强对传统药物的新剂型的研究以及传统药物间联合应用的研究,从而使PH患者获得更多收益。
4 小结与展望
PH靶向药物的广泛应用,虽显著提高了患者的生存率,但也存在一定的局限性,新靶向药物的研发仍然有重要意义。上述PH新靶点的潜在治疗药物,多数通过对抗炎症反应、线粒体氧化应激、细胞凋亡等维持肺血管结构和功能;在动物实验阶段,部分药物(如C75、CL316243、ROC-325、奥美昔芬、双硫仑等)可改善低氧小鼠/大鼠模型的心肺功能,这些药物或将填补现有靶向药物治疗的不足[16-17,19-21,33-34]。随着研究的深入,越来越多的致病靶点[如整联蛋白连接激酶(ILK)、TANK结合激酶1(TBK1)、免疫细胞、氯离子通道蛋白(CLIC)、代谢型谷氨酸受体5(mGluR5)、脯氨酰羟化酶2(PHD2)等]被发现,未来可加强PH发病机制的研究,从而发现更多靶点并开展药物研发工作[48-53]。
老药新用也是一种思路。一些治疗心力衰竭、高脂血症的药物如左西孟旦、阿托伐他汀等,在PH靶向治疗中疗效显著,提示我们可关注已上市心血管药物在PH中的运用[31,41]。另有研究表明,PH与UA有密切联系,且UA水平越高,PH的后续发展越快、严重程度越高和预后越差[54]。而别嘌醇可以通过减轻氧化应激和UA水平来预防血管重构改善PH[35]。因此还应关注并发症治疗药物在PH的治疗潜力。
现如今,新技术如基因组学、网络药理学在PH机制研究中发挥着越来越重要的作用。这些技术的应用将为治疗PH提供新的可能,如通过基因组学研究寻找与PH相关的基因变异和突变,以及通过网络药理学研究寻找新的药物作用靶点等[55-56]。今后,可考虑将上述新技术与传统方法相结合,在PH的发病机制、生物标志物方面进行探索,以期发现更多新的潜在治疗靶点及药物。
