猕猴桃BBX 基因家族成员鉴定与转录特征分析
2024-03-12路喻丹刘晓驰冯新陈桂信陈义挺
路喻丹 刘晓驰 冯新 陈桂信 陈义挺
(1.福建农林大学园艺学院,福州 350002;2.福建省农业科学院果树研究所,福州 350013;3.福建省落叶果树工程技术研究中心,福州 350013)
2009 年,Khanna 等[2]首次从拟南芥(Arabidopsis thaliana)中获得了32 个N 末端具有 B-box 结构域的蛋白,分别命名为AtBBX1-AtBBX32。根据 B-box结构域的数目、序列特征以及蛋白质是否含有 CCT结构域,将其分为5 个组。前期研究表明,植物BBX 基因家族的功能具有多样性,可应答植物的生物胁迫(如细菌胁迫[3])和非生物胁迫(如干旱[4]、低温[5]、盐胁迫[6]等)。BBX 也参与光形态建成,如在不同光质条件下介导矮牵牛(Petunia hybrida)花瓣对不同光质信号的转导[7];通过蓝光处理,抑制草莓(Fragaria×ananassa Duch.)开花负调控因子FaBBX28c1 的表达水平,可以促进栽培草莓的开花[8]等。BBX 可以参与植物的次生代谢物的合成,如通过光诱导苹果(Malus pumila Mill.)MdBBX21 的表达,促进果皮花青苷的生物合成[9]。BBX 在植物的不同组织部位有特异性表达,如辣椒(Capsicum annuum L.)CaBBX19 在种子中表达量极高,而CaBBX4 和CaBBX20 在植株除了种子外的所有组织中表达,且在果实特别是果皮中表达最高[10];二倍体草莓(Fragaria vesca)‘Ruegen’和‘Yellow Wonde’中,FveBBX13 和FveBBX16 均仅在成熟果实中表达[11]。BBX 还可以对植物的生长发育进行调控,如月季(Rosa chinensis Jacq.)花瓣中PIF8-BBX28 通过响应昼夜节律信号并调节RhAPX1 基因表达,来控制H2O2含量的昼夜动态平衡,进而维持花瓣体内氧化还原平衡,防止花瓣过早衰老[12];葡萄(Vitis vinifera L.)VvBBX22 在果实经外源ABA 和乙烯处理后表达上调,表明VvBBX22 参与调节葡萄果实成熟并起积极作用[13]。
猕猴桃(Actinidia chinensis)为原产于中国的猕猴桃科猕猴桃属落叶藤本植物,具有极高的营养价值,丰富的生物活性和综合利用潜能[14]。近年来,我国各地猕猴桃产业发展迅速,栽培面积和产量均居世界首位。然而,作为呼吸跃变型果实,果实贮藏方式选择不当所造成的损耗制约了猕猴桃产业的发展。目前BBX 基因家族已从水稻(Oryza sativa)[15]、马铃薯(Solanum tuberosum L.)[16]、小麦(Triticum aestivum L.)[17]、玉米(Zea mays L.)[18]、香蕉(Musa nana Lour.)[19]等植物中陆续被鉴定。已有研究表明植物BBX 基因家族参与植物生长发育的调控,而猕猴桃BBX 基因家族未见系统研究。
为了解猕猴桃BBX 基因家族生物学功能,本文从猕猴桃全基因组水平鉴定BBX 家族基因,系统分析其基因进化关系、蛋白理化性质特征、蛋白质保守结构域以及同源特性等,并研究其在猕猴桃不同组织部位及果实贮藏期间不同处理下的转录表达模式,为果实后熟软化机制及保鲜技术研发提供基因资源,为进一步开展猕猴桃BBX 基因功能研究奠定基础。
1 材料与方法
1.1 材料
本研究以福建省农业科学院果树研究所基地种植的4 年生‘米良1 号’猕猴桃为材料。于2017 年6-9月选取健康、长势相当、无病虫害的猕猴桃植株进行样品采集,期间的土水肥、花果等田间管理参照行业标准NY/Y 5108-2002《无公害食品猕猴桃生产技术规程》进行统一管理。
1.2 方法
1.2.1 猕猴桃BBX 基因家族成员鉴定 从Ensembl Plants(http://plants.ensembl.org/)下载猕猴桃基因组信息,包括DNA、GFF、GTF、CDS、cDNA 和蛋白质文件。通过Phytozome(https://phytozome-next.jgi.doe.gov/)下载拟南芥、番茄(Solanum lycopersicum L.)、马铃薯及水稻基因组数据。以拟南芥和番茄BBX 家族成员蛋白序列为模板,使用TBtools 软件对猕猴桃全基因组蛋白质序列同源检索,删去冗余序列后获取候选猕猴桃BBX 家族蛋白序列。通过DNAMAN比对筛选以避免重复。采用NCBI 的在线工具CDD(conserved domain database)(https://www.ncbi.nlm.nih.gov/cdd)分析蛋白质序列中的保守结构域,剔除不含B-box 保守结构域的蛋白质序列,并将筛选后获得的序列上传到PFAM(http://pfam-legacy.xfam.org/)、SMART(http://smart.embl-heidelberg.de/)进一步验证其结构域,获得猕猴桃BBX 基因家族成员。
1.2.2 猕猴桃BBX 基因系统发育分析 利用MegaX(https://www.megasoftware.net/)内置的ClustalW 进行多重对比,通过邻接NJ(neighbor-joining)算法对48 个猕猴桃BBX 家族成员和32 个拟南芥BBX 家族成员构建系统发育进化树,校验参数Bootsrtrap 重复1 000 次。
1.2.3 猕猴桃BBX 基因理化性质及蛋白结构域分析 采用NCBI 在线工具CDD 分析猕猴桃BBX 基因家族的保守结构域,采用weblogo(http://weblogo.berkeley.edu/)对结构域保守基序进行在线分析,使用TBtools 绘制基因结构域图。使用TBtools 绘制基因在染色体上的分布图及密度。应用Expasy(https://web.expasy.org/protparam/)分析等电点、相对分子质量、氨基酸数量、不稳定指数等。利用WoLF PSORT(https://wolfpsort.hgc.jp/)预测亚细胞定位。
创设是生成的基础,生成的结果和课堂创设密切相关。在英语词汇课堂中,创设包含两方面的含义,首先是课堂预设,即计划性,它包括教学目标、内容、教学方法和模式的制定等活动。其次,这些活动不同于传统意义上教师对课堂模式化和固定性的预设,而要具有一定的创造性,即教学设计要考虑学生主动参与性、师生的互动性、课堂的生态性等。以创设为基础,英语词汇课堂的动态生成过程避免了盲目性,具有科学性、计划性和系统性。
1.2.4 猕猴桃BBX 基因结构及蛋白保守结构分析 采用TBtools 绘制基因在染色体上的分布图及外显子-内含子结构图。利用MEME(https:// memesuite.org/meme2/tools/meme)分析蛋白保守基序,并利用TBtools 绘制保守基序图。
1.2.5 猕猴桃BBX 基因启动子顺式作用元件及种内共线性分析 提取基因组中翻译起始点ATG 上游2 000 bp 的启动子序列,并提交Plant CARE(http://bioinformatics.psb.ugent.be/webtools/)顺式作用元件分析,通过TBtools 进行可视化。利用TBtools 软件进行物种内共线性分析。
1.2.6 猕猴桃BBX 基因的转录分析 将猕猴桃根、茎、叶、花、幼果(花后16 d)和成熟果(花后160 d)的组织进行液氮速冻,保存-80℃冰箱备用,每组样品3 次重复。通过转录组测序分析猕猴桃BBX 基因家族在不同组织器官的表达特征。
选用大小和成熟度近似、无病虫害、无表面机械损伤的猕猴桃成熟果(花后160 d)为材料,分为5 组,分别进行鲜果取样(CK)、采后室温贮藏1周(RT_1W)、采后经50 mg/L 的ABA 浸泡2 min 后室温贮藏1 周(ABA_1W)、采后4℃条件下贮藏1(Four_1W)、2(Four_2W)、3 周(Four_3W)处理,每组30 个果,3 次生物学重复,处理结束后,取中果皮进行液氮速冻,用于转录测序和猕猴桃BBX 基因家族在果实贮藏过程的转录模式分析。
使用Illumina/Solexa Hi Seq 2000 进行转录组测序,获得的原始数据去除带接头、含N 和低质量的reads 后,采用HISAT2 v2.0.5 软件进行注释,并通过featureCounts 程序计算映射到每个基因的读数,然后根据基因的长度计算基因的FPKM 值,最后提取猕猴桃BBX 基因家族基因的FPKM 值,采用TBtools 绘制表达量聚类热图。
1.2.7 数据统计分析 采用Excel 2019 进行数据统计,SPSS(v24.0)软件进行方差分析,通过TBtools、Adobe Photoshop CC 2019、Adobe Illustrator 2020 进行图形绘制。
2 结果
2.1 AcBBX基因鉴定与系统发育分析
以拟南芥、番茄和土豆的BBX 基因作为种子序列对猕猴桃基因组进行检索,获得79 条候选序列,经保守域筛查并去除冗余序列后,共鉴定到48 条BBX 基因。根据它们在染色体上的分布,分别命名为AcBBX1-AcBBX48。
通过构建猕猴桃与拟南芥中BBX 蛋白序列的系统发育进化树(图1),分析BBX 家族间进化关系。所有BBX 成员聚为5 个分支(组I-V),每个分支均包含2 个物种的BBX 蛋白。组I 的6 个AcBBXs含有2 个B-box 结构域和1 个CCT 结构域;组II 的13 个AcBBXs 含有2 个B-box 结构域;组III 的13个AcBBXs 含 有1-2 个B-box 结构域 和1 个CCT 结构域,在结构上第2 个B-box 结构域与组I 有所差别,其中AcBBX2、AcBBX22、AcBBX23、AcBBX25和AcBBX29 没有第2 个B-box 结构域;组IV 的5 个AcBBXs 含有1 个B-box 结构域和1 个CCT 结构域;组V 有11 个AcBBXs,仅含有1 个B-box 结构域。
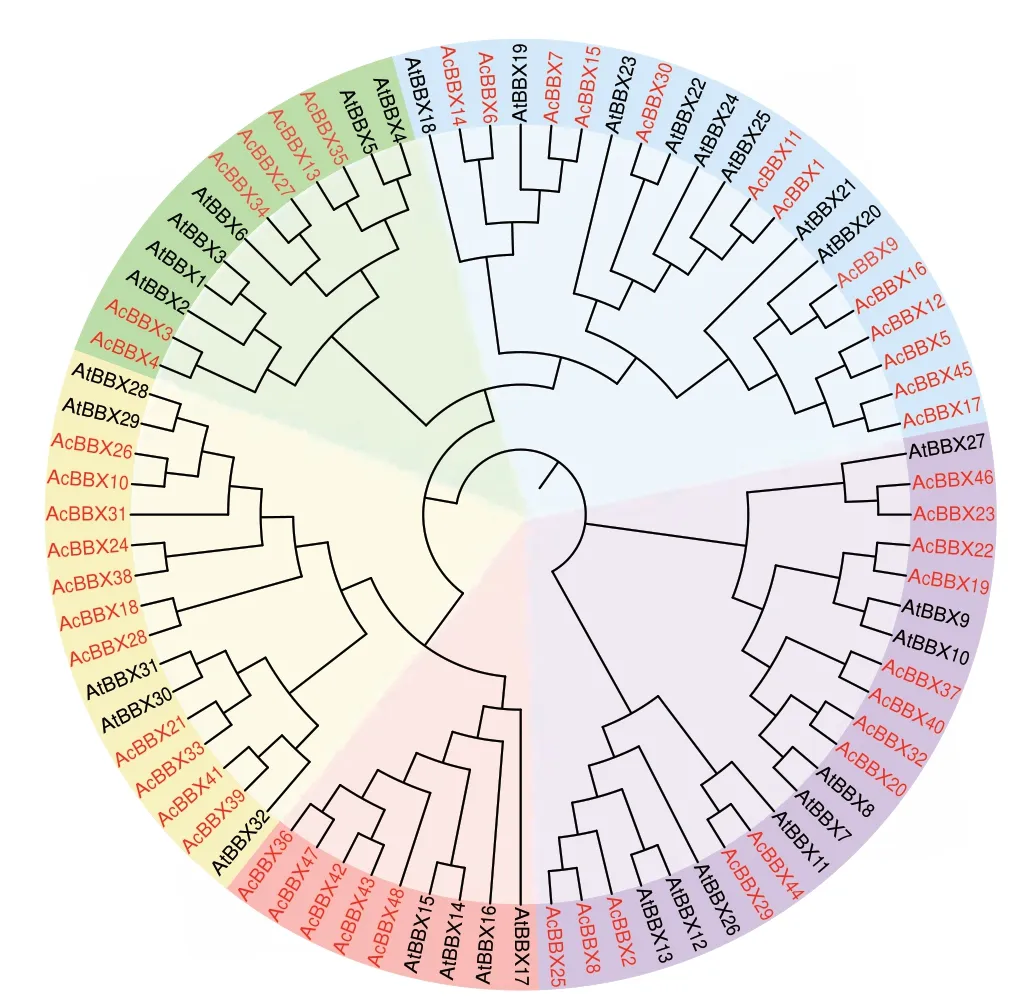
图1 猕猴桃与拟南芥BBX 基因的系统进化树Fig.1 Phylogenetic analysis of the BBX genes between kiwifruit and Arabidopsis
2.2 AcBBX基因家族成员的理化性质分析
48 个AcBBXs 的基因大小存在较大差异(附表1),AcBBXs 蛋白长度在126(AcBBX21)-515(AcBBX23)aa 之间,编码区序列长度最短为381 bp,最长为1 548 bp。分子量介于14 172.09(AcBBX33)-57 905.84 Da(AcBBX23)之 间,蛋白理论等电点(pI)为4.1-9.75,其中43 个为酸性蛋白,5 个为碱性蛋白。亲水性平均指数为-0.981--0.109,脂肪系数在48.11-86.99 之间,不稳定指数均大于40,说明所有AcBBXs 均为亲水性不稳定蛋白。亚细胞定位预测显示,组I 除AcBBX3(细胞核)外,其他基因均定位于叶绿体;组III 所有成员均定位于细胞核;组II、IV 和V 的成员主要定位于细胞核、叶绿体和细胞质,仅有组IV 的AcBBX47 定位于线粒体。
2.3 AcBBX基因家族成员的motif分析及基因结构
以20 个motif 作为查询上限,结果(图2-A)显示,AcBBXs 不同聚类组间的motif 分布差异较大,组III 拥有最多的motif 数量(6-9 个),而组V 的数量最少(1-3 个)。除组V 的11 个成员缺少motif 5 外,其余组的成员均有近5'端的motif 5 和motif 1。不同组内部的motif 分布较为均匀,具有较高的保守性,推测其结构域和功能单位基本相似。
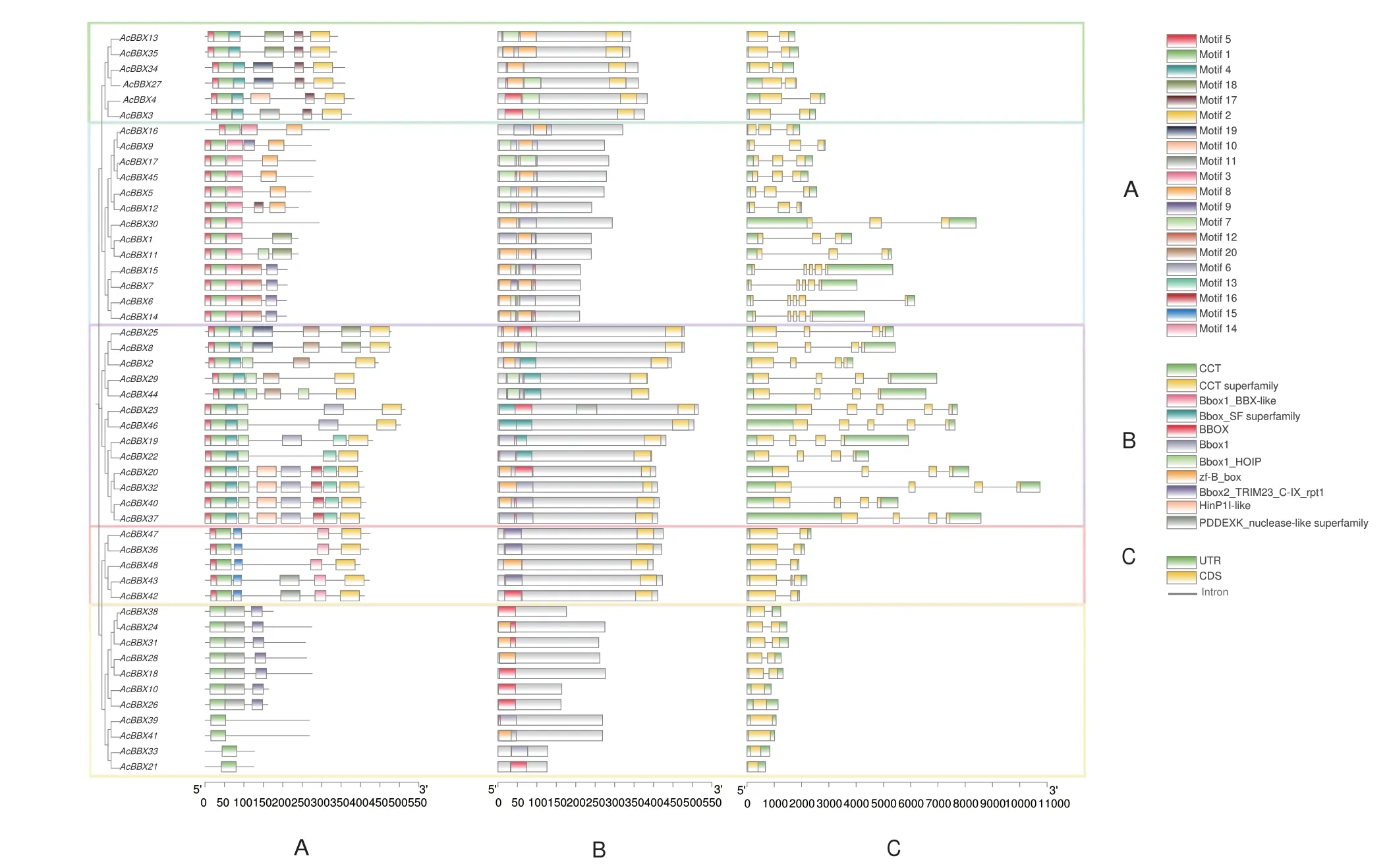
图2 AcBBX 基因家族的motif(A)、基因保守域(B)及基因结构(C)Fig.2 Motif(A),conserved domains(B)and gene structures(C)of AcBBX gene family
AcBBXs 的保守结构域分析表明(图2-B),组I、III 和IV 均具有CCT-superfamily 保守域。此外,AcBBX23 的保守域除了包含2 个B-box 外,还存在一个类似HinP1I 限制性核酸内切酶的结构域,该现象在其他成员中未发现。
进一步分析AcBBX 基因家族48 个成员的基因结构(图2-C),AcBBXs 有1-5 个外显子,不同聚类组的外显子内含子组成差异较大,各组内成员的基因结构具有相似性。除AcBBX43(组IV)外,组I 和组IV 的AcBBXs 均包含2 个外显子,组II 包含3 或5 个外显子;组III 包含4 或5 个外显子;组V 的AcBBX10、AcBBX21、AcBBX26、AcBBX33、AcBBX39 和AcBBX41 只包含1 个外显子,其余5 个成员均包含2 个外显子。
2.4 AcBBX基因家族成员的顺势作用元件分析
AcBBX 基因家族成员启动子区除启动子核心的基础元件TATA-box、CAAT-box 外,共包含63 种顺式作用元件(图3),以光反应、植物激素调控、逆境胁迫响应及生长发育调控元件为主。100%的家族成员含有光反应和植物激素调控相关元件,91.67%的家族成员含有逆境胁迫响应元件,81.25%的成员含有生长发育调控元件,75%的成员均含有上述4 种元件。所有成员中,AcBBX45 所含光反应元件GT1-motif 元件数量最多(20 个),推测光照对其表达的影响较大。85.42%的家族成员含有光反应元件G-box,其中AcBBX19 所含元件数量最多(13 个)。植物激素调控相关元件中,有79.17%的成员包含有脱落酸响应元件ABRE,AcBBX19 所含元件数量最多(11 个),推测AcBBX19 对激素调节和光照方面均有响应。逆境胁迫响应相关元件中,AcBBX47 含有干旱胁迫响应元件MBS 最多(7 个),同时还有抗氧化反应元件ARE(3 个)。生长发育调控元件中,AcBBX27 含有最多的分生组织表达相关元件CATbox(4 个)。组IV 相较于其他4 个组所含顺势作用元件数量少。
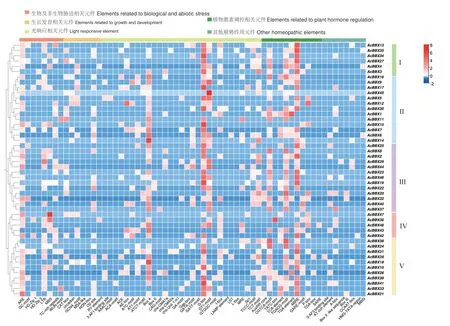
图3 AcBBX 基因的顺势作用元件分析Fig.3 Analysis of cis-acting elements in AcBBX genes
2.5 AcBBX基因家族成员的染色体定位、基因重复事件与种内同源性分析
染色体定位结果(图4)显示,48 个AcBBXs不均匀地分布在22 条染色体上,其中17 号和23 号染色体上的猕猴桃BBX 成员数量最多(均有6 个),而大部分染色体(11 条)均只含1 个BBX 基因。
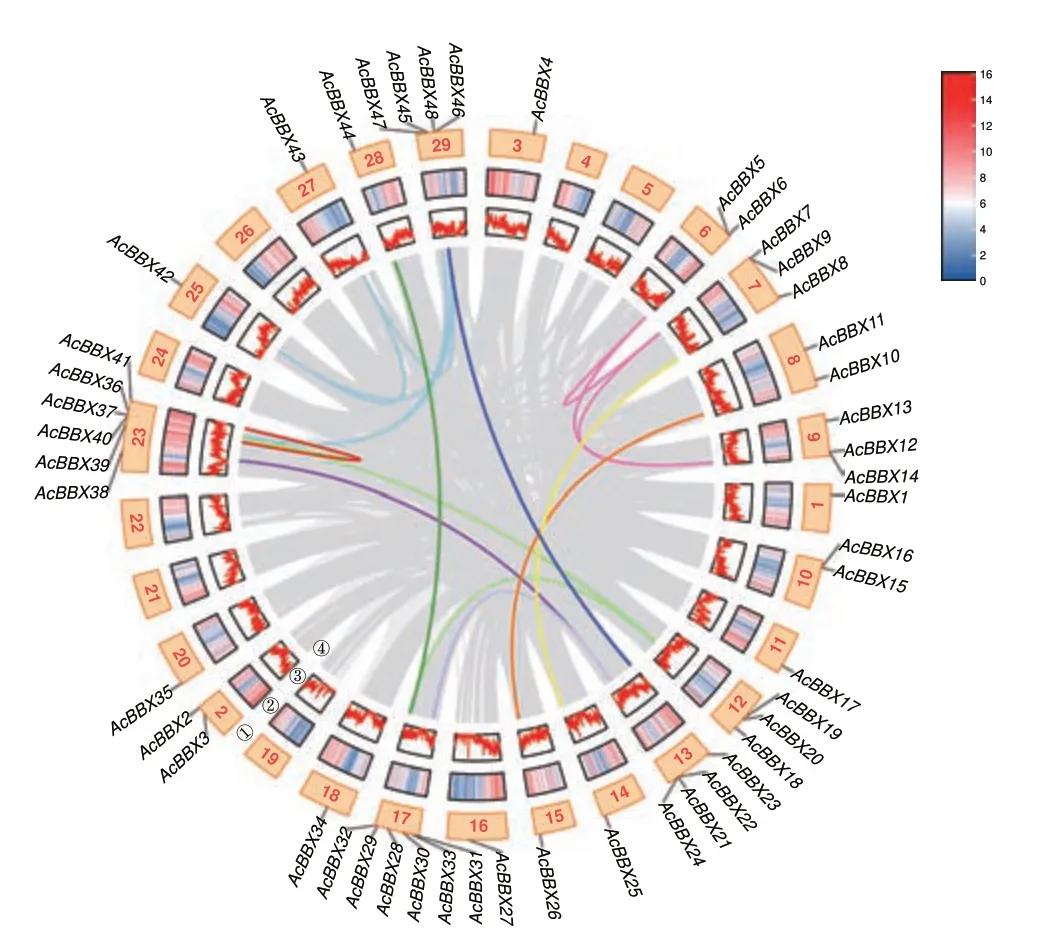
图4 AcBBX 基因的种内共线性、染色体密度及染色体定位Fig.4 Intraspecific collinearity of AcBBX genes and their chromosome density and locations
AcBBXs 中有3 组串联基因,包括7 号染色体的AcBBX7 和AcBBX9,10 号染色体的AcBBX15和AcBBX16,13 号染色体的AcBBX21、AcBBX22和AcBBX24。共线性分析得到22 个片段重复对,共有29 个基因发生片段复制,其中AcBBX6 与AcBBX7 和AcBBX14 分别具有共线性关系。AcBBX24与AcBBX31 和AcBBX38 两个基因存在片段重复,AcBBX31 同时与AcBBX38 存在片段重复,同样的情况 发生于AcBBX40、AcBBX19 和AcBBX20。AcBBX36 分别与AcBBX47 和AcBBX48 有片段重复,AcBBX42 也分别与AcBBX47 和AcBBX48 有片段重复,AcBBX48 又与AcBBX43 有片段重复,且这5 个基因均属于组IV 成员。
2.6 AcBBX基因家族成员转录水平表达分析
2.6.1 AcBBXs 在不同组织部位的表达分析 表达量热图显示(图5),AcBBXs 在猕猴桃叶、茎、花、幼果、成熟果中的表达量差异明显。7 个成员(AcBBX6、AcBBX8、AcBBX14、AcBBX17、AcBBX21、AcBBX30、AcBBX39)在成熟果中表达较其他部位高,3个成员(AcBBX9、AcBBX16、AcBBX35)在幼果中表达较其他部位高,5 个成员(AcBBX3、AcBBX27、AcBBX34、AcBBX47、AcBBX48)在叶中表达较其他部位高,3 个成员(AcBBX11、AcBBX37 和AcBBX40)在花中表达较其他部位高。AcBBX35 在成熟果中的表达量明显低于其他部位。AcBBX13 在猕猴桃不同组织部位中都有较高表达,AcBBX42、AcBBX34 在叶中的表达量最高,其次是幼果和茎。9 个成员(AcBBX5、AcBBX10、AcBBX12、AcBBX15、Ac-BBX19、AcBBX22、AcBBX41、AcBBX43、AcBBX46)在各个部位基本不表达(0 ≤FPKM ≤1),10 个成员在猕猴桃各部位的表达量均较低(1 ≤FPKM ≤8)。不同AcBBX 成员在各组织部位的差异表达,可能与其在特定组织部位行使的功能有关。

图5 AcBBX 基因在猕猴桃不同组织部位的表达模式Fig.5 Expression patterns of the AcBBX genes in different tissues of kiwifruit
2.6.2 AcBBXs 在果实贮藏过程的表达分析 果实贮藏过程的表达量热图结果(图6)显示,除AcBBX48 没有测到表达,其余47 个成员在不同采后处理过程中表达量差异较大。3 个成员(AcBBX27、AcBBX34 和AcBBX40),在ABA_1W 时的表 达量高于其他处理组且高于对照,其中AcBBX34在ABA_1W 时的表 达量是CK 的14.62 倍,推测与其启动子含有脱落酸响应元件有关。6 个成员(AcBBX17、AcBBX23、AcBBX29、AcBBX31、AcBBX32、AcBBX39)在RT_1W 时的表达量高于其他处理组且高于对照,其中AcBBX39 在RT_1W 时的表达量是CK 的6.61 倍,说明这6 个成员参与室温贮藏下的果实后熟。4℃低温贮藏处理下,10个成员(AcBBX2、AcBBX4、AcBBX13、AcBBX17、AcBBX20、AcBBX23、AcBBX24、AcBBX31、AcBBX32、AcBBX38)的表达量随低温贮藏时间的增加而上调,其中AcBBX24 在Four_3W 时的表达量是Four_1W 的2.56 倍,AcBBX21 在低温处理下3 个时间点的表达量均高于100,在Four_2W 时的表达量(177.89)最高,是CK(17.42)的10.21 倍;而5个成员(AcBBX8、AcBBX11、AcBBX19、AcBBX25、AcBBX27)的表达量随低温贮藏时间的增加而逐渐下调,说明这15 个成员参与低温贮藏过程的果实后熟。AcBBX7、AcBBX13、AcBBX18、AcBBX35 和Ac-BBX37 在CK 时的表达最高,在ABA 处理、室温贮藏处理和低温处理后表达量均下调。12 个成员基本不表达(0 ≤FPKM ≤1)。AcBBXs 在采后不同贮藏处理中的表达模式的差异,表明不同成员可能在不同贮藏条件下参与果实的后熟软化过程的调控。
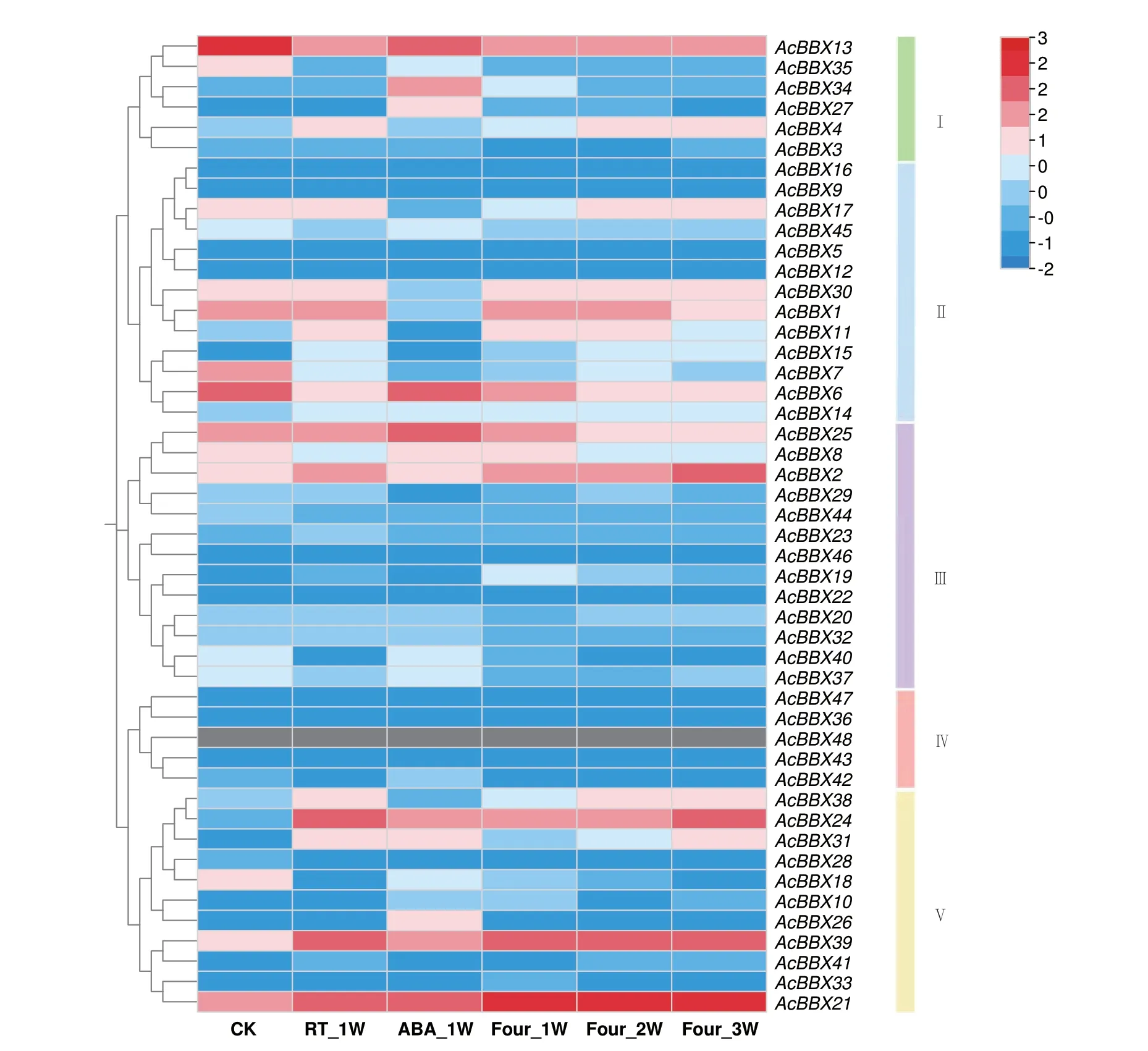
图6 AcBBX 基因在猕猴桃果实不同贮藏处理下的表达模式Fig.6 Expression patterns of the AcBBX genes under different storage treatments
3 讨论
3.1 AcBBXs成员特征概述
本研究筛选出了48 个猕猴桃BBX 基因家族成员。已报道植物中,水稻有30 个[15]、小麦87个[17]、香蕉38 个[19]、葡萄25 个[20],表明植 物BBX 基因家族成员的数量在不同植物中有较大差别。AcBBXs 的理化性质特征,如编码区长度、亲水性、等电点和亚细胞预测等与已报道的拟南芥[2]和番茄[21]BBX 基因家族成员特性相似。AcBBX 的组III(2 个B-Box 结构域和1 个CCT 结构域)中有5 个成员缺少1 个CCT 结构域,同样的情况发生于矮牵牛BBX 基因家族的G2 组中[7]。AcBBX 不同组间的外显子和内含子的数量存在一定差异,组V 中 的AcBBX10、AcBBX21、AcBBX26、AcBBX33、AcBBX39 和AcBBX41 没有内含子,这在已报道的双子叶植物BBX 基因家族中较为少见。
3.2 AcBBXs具有高度同源性
AcBBXs 具有3 个串联基因簇(共7 个AcBBX基因),基因数量占AcBBXs 的14.56%;29 个片段重复基因组成了22 个片段重复对,重复基因占AcBBXs 的60.42%。这种家族内大量基因复制现象在植物界并不少见,StGAUT 基因家族存在12 对片段重复基因且均在纯化选择下进化[22]。AcCAT 的串联基因簇和片段复制基因的比例分别达到55.56%和66.67%[23]。小麦MADS-box 转录因子的复制在一定程度上增加了其对不同环境的适应性[24]。本研究中猕猴桃BBX 基因家族组IV 的5 个成员均与组内其他成员有片段重复,可以推测猕猴桃BBX 基因特别是组IV 的进化过程高度保守,各个基因的功能和结构可能具有关联性和相似性,后续可以进行挖掘。
3.3 AcBBXs在植物不同部位和果实贮藏过程中发挥重要作用
根据AcBBXs 启动子的顺式元件归类结果推测,AcBBXs 可能对光照作出响应,并受到低温、干旱、缺氧等非生物胁迫环境因子及内源激素的调控,同时参与调节生长发育过程。这也与现有的植物BBX基因家族功能分析和验证报道结果相一致[25-28]。此外,在AcBBXs 中还发现有栅栏叶肉细胞分化、胚乳表达等元件,在后续研究中可以深入发掘并验证。
本研究中,48 个猕猴桃BBX 基因参与了猕猴桃不同组织部位的生长发育,47 个AcBBXs 参与了猕猴桃果实贮藏过程的后熟,表达均有明显差异。AcBBX6 在成熟果中、AcBBX42 在叶中、AcBBX11 在花中有较高表达。在不同贮藏处理中,AcBBX34 在ABA_1W 时的表达量最高,而AcBBX39 在RT_1W时的表达量最高。AcBBX21 在Four_2W 处理下的表达量最高,推测该基因对于果实贮藏期间的低温胁迫环境可作出积极应答。基因的表达模式在一定程度上可以反映基因的功能。蜡梅(Chimonanthus praecox)CpBBX19 在开花初期表达水平最高,其次是开花后期和盛花期,在萌芽期、花蕾期、展花期和花后枯萎阶段表达水平最低[29];铁皮石斛(Dendrobium officinale)DoBBX07 在茎叶中具有最高的转录本丰度,但其同源基因DoBBX18 却在叶中表达最低,在根中最高,这些基因可能直接或间接参与器官的发育建成[30]。部分基因的高表达说明AcBBXs 可能在猕猴桃成熟果、叶及花中扮演重要角色。作为呼吸跃变型果实,分析结果可以解释猕猴桃部分AcBBX 基因在果实贮藏期间响应激素、温度变化以及在果实呼吸作用过程中的潜在作用,但各成员的具体功能需要通过进一步的分子生物学研究进行验证。
4 结论
本研究从中华猕猴桃全基因组中鉴定出48 个BBX 基因,AcBBXs 均为亲水性不稳定蛋白,同源性高,具有3 个串联基因簇和29 个片段重复基因,组间基因结构差异大。AcBBX42 在叶中、AcBBX11在花中表达量较高,AcBBX34 在果实处理后高度响应外源激素调控,AcBBX21 高度响应低温胁迫。
文章所有附表数据请到本刊官网下载(http://biotech.aiijournal.com/CN/1002-5464/home.shtml)。
