解淀粉芽孢杆菌SQ-2 对水稻的促生作用
2024-03-12李雪李容欧孔美懿黄磊
李雪 李容欧 孔美懿 黄磊
(天津理工大学化学化工学院,天津 300384)
磷作为植物生长的必要元素之一,对植物细胞分裂与分生组织发育均具有重要的作用[1-2]。虽然土壤中磷元素的有机和无机形态丰富,但它主要以不溶性的形态存在。而且由于固定化作用和降水,可溶性磷往往不能从土壤中正常分解出来。在酸性土壤中,磷被铝和铁的游离氧化物和氢氧化物固定,而在碱性土壤中则被钙固定。这会使得土壤中可溶性磷含量低下,影响作物发育[3]。目前我国氮肥施用量较高,流失率却高达40%左右,易导致土壤受到硝酸盐的污染,并累积大量的盐分,进而造成作物减产[4]。而钾是植物重要的营养元素,在植物的生长和代谢中起关键作用。钾离子(K+)可以帮助植物实现生理调节,例如调节水分状态、膨压、光合产物的运输或移动、细胞代谢、对生物和非生物胁迫的耐受性等[5]。因此,提高土壤中氮、磷与钾元素的利用率是亟待解决的问题。
植物根际土壤是土壤微生物种类较为丰富的一块区域,在其中具有促生抗病作用的细菌被称为植物促生根际细菌(plant growth-promoting rhizobacteria,PGPR)。促生菌通过合成吲哚乙酸(indole-3-acetic acid,IAA)、分泌铁载体、溶磷固氮、抑制有害真菌生长等方式,起到促进植物生长、提高土壤肥力的作用[6]。植物根际促生细菌种类繁多,主要包括芽孢杆菌属(Bacillus spp.)、假单胞菌属(Pseudomonas spp.)、肠杆菌属(Enterobacter spp.)、克雷伯氏菌属(Klebsiella spp.)、固氮菌属(Azotobacter spp.)等[7]。贾峥嵘等[8]研究表明枯草芽孢杆菌(B.subtilis)、胶冻样芽孢杆菌(jelly-like Bacillus)、解淀粉芽孢杆菌(B.amyloliquefaciens)和甲基营养型芽孢杆菌(methylotrophic Bacillus)可以增加甘薯淀粉积累量,提高甘薯产量及品质。周童晖等[9]研究结果显示,枯草芽孢杆菌(B.subtilis PJS-18)具有高效解磷能力,添加低浓度菌悬液对小麦(Triticum aestivum L.)具有较强的促生作用。细菌接种可能会重塑土壤群落,因为当外源性因素改变土壤中的矿质养分与pH 后,会导致微生物群落结构的变化[10]。接种溶磷菌Pantoea aglumans V8R67 能降低土壤pH,并且改变土壤细菌群落结构,群落中提升的厚壁菌门(Bacillota)能够分解土壤不溶性磷源,提高土壤有效磷含量[11]。
促生菌剂的使用能促进作物生长发育,但有关解淀粉芽孢杆菌在水培、土培水稻(Oryza sativa L.)中应用浓度方面的研究报道相对较少。之前实验室从豆瓣酱中分离筛选得到了一株解淀粉芽孢杆菌SQ-2,试验将对其溶磷固氮解钾的功能进行研究。并以水稻为研究对象,拟利用水培、盆栽试验研究该菌株在不同浓度下对水稻的促生作用,探究土壤中各类酶、营养元素与菌株浓度之间的关系,为提高菌肥利用效率及未来微生物肥料研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试细菌 实验室前期筛选得到的一株解淀粉芽孢杆菌SQ-2,放置甘油管中于-80℃冷冻保存[12]。
1.1.2 培养基 培养基配方均为液体培养基,固体培养基需在此基础上添加20 g/L 琼脂粉。pH 均为7.0-7.2(氢氧化钠溶液调节),121℃灭菌30 min。其中蔗糖、葡萄糖为分装单独灭菌后加入培养基。金属离子溶液使用滤器过滤灭菌后加入培养基。
解钾培养基:蔗糖5 g,葡萄糖5 g,硫酸铵0.5 g,酵母0.5 g,七水合硫酸镁0.3 g,磷酸氢二钠2 g,硫酸亚铁0.02 g,硫酸锰0.03 g,钾长石4 g,蒸馏水1 000 mL。
无机磷Pikovskaya 培养基:磷酸三钙5 g,蔗糖10 g,硫酸铵0.5 g,氯化钠0.2 g,七水合硫酸镁0.1 g,氯化钾0.2 g,酵母0.5 g,七水合硫酸锰0.03 g,七水合硫酸亚铁0.03 g,蒸馏水1 000 mL。
盆栽实验土壤采自天津理工大学明理农场,土壤基本理化性质为pH 7.83,总磷446 mg/kg,总氮521 mg/kg,总钾1.03%,速效磷18.39 mg/kg,速效氮 16.33 mg/kg,速效钾62.52 mg/kg。
1.2 方法
1.2.1 菌株固氮能力检测 利用北京迪信泰公司细菌固氮酶ELISA 试剂盒进行检测,采用双抗体一步夹心酶联免疫吸附实验。最后实验结果颜色的深浅与样品中固氮酶的浓度呈现正相关。利用酶标仪在450 nm 条件下测定吸光度,计算出固氮酶浓度。
1.2.2 菌株溶磷能力测试
(1)定性测试。用接种针挑取菌株SQ-2 单菌至无机磷固体培养基中央,共接种3 个平皿。在25℃恒温箱中培养6-9 d,观察是否有溶磷现象产生。
(2)定量测定。先挑取单菌在LB 培养基中培养3 d,离心后,将菌体用无菌水制备成OD 值为1的菌悬液,以2%的接种率接入上述无机磷液体培养基中。于25℃,120 r/min 的摇床内培养,培养1 d 后,吸取培养液离心取上清,使用无磷滤纸过滤,采用钼蓝比色法测定其溶磷量[13],并使用pH 计测定无机磷液体培养基pH 值,每组进行3 次重复。
1.2.3 接种菌株后钾长石的表面形态分析 将菌株以2%的接种率接种到解钾液体培养基中,并在25℃,120 r/min 的摇床内培养。8 d 后收集样品,通过滤纸过滤回收发酵液中的钾长石粉末,并在60℃烘箱内完全干燥。使用扫描电子显微镜观察钾长石接种菌株前后的表面形态。
1.2.4 菌株对水培与土培水稻的促生实验 使用质量体积分数为1%的次氯酸钠溶液对合格水稻种子进行消毒,时长5 min,然后用无菌水洗涤5 遍。之后使用体积分数为75%的酒精对其进行消毒5 min,再用无菌水洗涤5 遍,并对最后一遍洗涤后的无菌水进行涂板实验,来检验水稻是否已完全灭菌。将菌株SQ-2 发酵液10 000 r/min 离心10 min,使用无菌水反复清洗离心两次,制成102、104、106、108和3×108CFU/mL 的菌悬液进行浸种。水稻浸种温度为27℃,时长72 h,光照度3 000 lx,光暗比为16 h/8 h。
选用口径8 cm,底径6.5 cm,高11 cm 的塑料花盆,每盆添加400 g 土壤、放置15 颗相应浸种浓度的露白水稻种子。分别在第1 天与第10 天取102、104、106、108和3×108CFU/mL 菌悬液 各25 mL 接种至花盆中,并且每组处理浇水溶性肥料50 mL(购于河南省双惠农业科技发展有限公司),同时设置对照组,置于 25℃ 温室中培养。在20 d 后,每个花盆3 个点取样,土样混合均匀后风干,过筛(100 目)后测定相应指标[14]。取102、104、106、108和3×108CFU/mL 菌悬液各25 mL,每个浓度组分浸泡20 粒消毒过未浸种水稻种子,同时设置对照组。培养14 d 后测定根茎干重、鲜重以及茎粗、茎高,以上重复3 次作为平行试验。
水稻根茎干重的测定方法:将水稻根茎在烘箱105℃下杀青1-2 h 后,再在60℃烘干至恒重,用电子天平称量得到。根茎鲜重用电子天平来测定。水稻高度、根长用卷尺测量,茎粗用游标卡尺测量。
其中土壤脲酶采用苯酚-次氯酸钠比色法测定;蛋白酶采用茚三酮检测法测定;蔗糖酶采用3,5-二硝基水杨酸比色法测定[15]。实验土壤总钾、总氮、总磷和速效氮委托江苏中园科技有限公司检测。土壤速效磷、速效钾、铵态氮、硝态氮以及土壤酸性磷酸酶,均使用合肥莱尔生物试剂盒进行检测。土壤pH 采用pH 计电位法检测[16]。
1.2.5 根际土壤收集 对接种3×108CFU/mL 菌悬液的土壤及对照组进行细菌丰度分析,共计两组,每组3 个平行试验。每组15 株水稻,在其生长20 d后,将水稻连土整根挖起,去除大块土壤,并采用抖根法收集根际附近土壤[17]。收集3 g 根际土壤放置于5 mL 冻存管,用液氮冷冻10 min,放置于-80℃冰箱保存备用。
1.2.6 DNA 提取、PCR 扩增以及 Illumina Miseq 测序 将土壤样品放置于干冰内,送样至上海美吉生物医药公司检测,委托美吉生物进行文库构建及高通量测序。
1.2.7 数据分析 利用独立样本t 检验方法,对接种菌株3×108CFU/mL 组和对照组土壤的α 多样性进行分析。不同处理间的各项指标差异性采用单因素方差分析中的 Duncan 法进行分析,接种解淀粉芽孢杆菌SQ-2 后土壤营养成分、土壤酶活性与pH 的相关性分析采用Pearson 相关分析方法,使用Excel 2016 与SPSS 25.0 对数据进行分析,用Origin 2021和Adobe Photoshop 2021 制图。
2 结果
2.1 解淀粉芽孢杆菌SQ-2的解磷能力
将菌株SQ-2 在无机磷液体培养基中振荡培养,从第1 天开始,检测上清液中可溶性磷含量,结果(图1-B)表明,菌株SQ-2 在无机磷培养基中上清液磷含量最高值出现在第6 天,约为229.63 mg/L,与此同时pH 值呈现先快速降低再缓慢回升的趋势。前3 d 的溶磷量没有明显变化,第3 天时约为72.22 mg/L,之后呈现稳步上升的趋势,在第6 天开始趋于稳定。无机磷培养基的初始pH 值为7.36,接种后第1 天迅速降至5.28,后续最低pH 值在4.3-4.5左右,第6 天之后pH 值开始缓慢回升。接种菌株后0-2 d 为对数生长期,第3 天菌体数量达最高值3.26×107CFU/mL,随后菌体数量迅速下降。图1-A为菌株SQ-2 在无机磷固体培养基中培养至第7 天的溶磷情况。
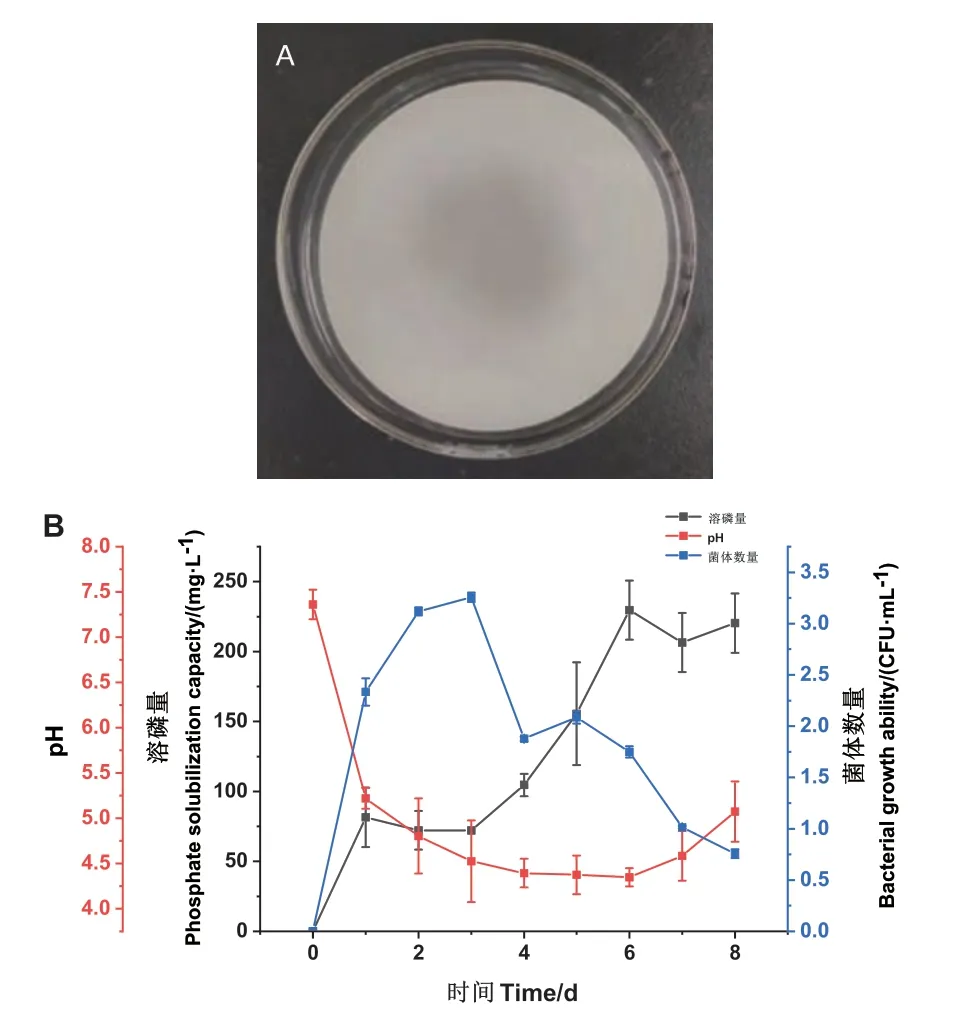
图1 解淀粉芽孢杆菌SQ-2 在无机磷培养基中的溶磷作用Fig.1 Phosphorus dissolution of Bacillus amyloliquefaciens SQ-2 in inorganic phosphorus medium
2.2 解淀粉芽孢杆菌SQ-2 的解钾以及固氮能力
通过SEM 来观察钾长石与菌株SQ-2 相互作用后的形态。对照组中(图2-A,C),钾长石的表面光滑且有棱角;而在接种菌株SQ-2 的组中(图2-B),钾长石表面被腐蚀,能观察到模糊的棱角和粗糙的纹理,还有部分菌体附着在钾长石表面(图2-D)。

图2 接种解淀粉芽孢杆菌SQ-2 后钾长石的扫描电子显微照片Fig.2 Scanning electron micrograph of potassium feldspar after inoculation with B.amyloliquefaciens SQ-2
使用固氮酶试剂盒进行检测,利用酶标仪在450 nm 处检测吸光度值。根据标准品制备的标准曲线计算出菌株固氮酶活性为55.07 U/L。
2.3 水培与土培条件下菌株SQ-2 对水稻的促生能力
在水培条件下,S2 组中水稻根干重、鲜重与茎干重变化最显著,分别增加了69.7%、59.6%以及38.7%。但不同组对于水稻株高、茎粗与茎鲜重的影响并不显著(表1)。
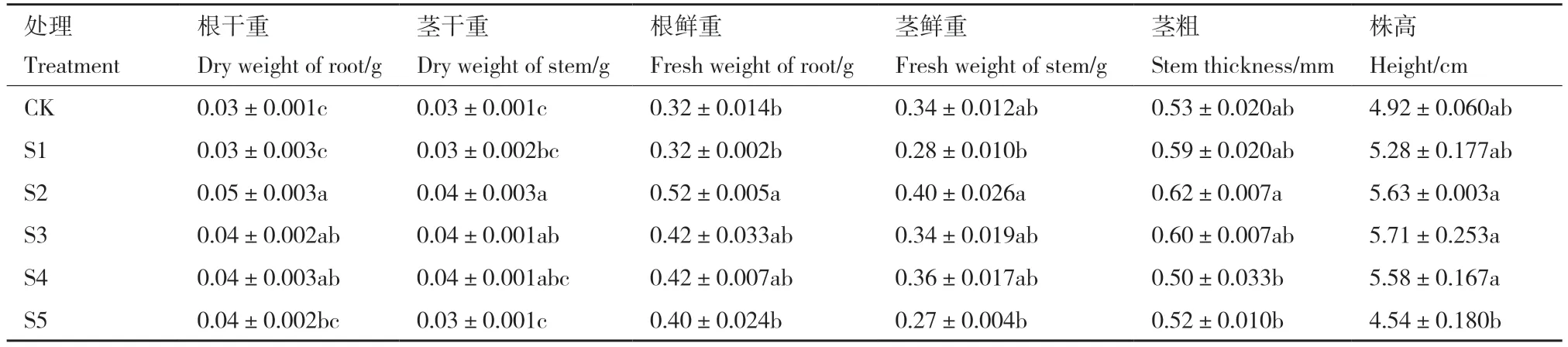
表1 不同浓度的解淀粉芽孢杆菌SQ-2 对水培水稻根茎干鲜重、茎长与茎粗的影响Table 1 Effects of B.amyloliquefaciens SQ-2 at different inoculum concentrations on the dry and fresh weight,stem length,and stem diameter of hydroponic rice
土培条件下,S4 与S5 组中水稻根的干、鲜重增长效果显著,根鲜重分别为1.11 g 与1.16 g,比对照组提高了37%与43.2%;根干重分别为95 mg 与102 mg,较对照提高了35.7%与45%。S5 组中茎的干鲜重提升显著,茎鲜重分别为0.51 g 与0.58 g,较对照提高了16.7%与38%;茎干重分别为36 mg 与45.7 mg,较对照提高了20%与33.3%。茎粗也在S5组提升最显著,较对照提高了30.5%(表2,图3)。
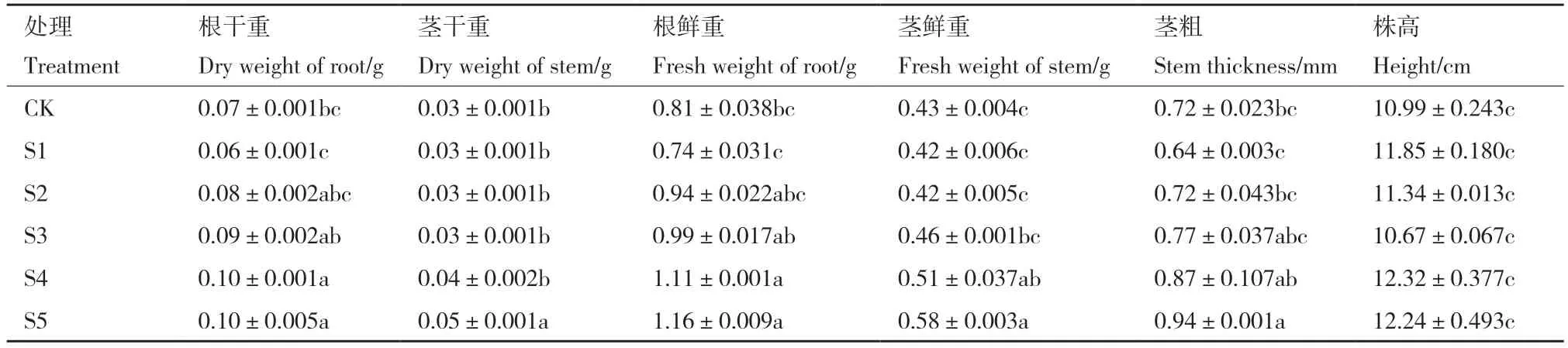
表2 不同浓度的解淀粉芽孢杆菌SQ-2 对土培水稻根茎干鲜重、茎长与茎粗的影响Table 2 Effects of B.amyloliquefaciens SQ-2 at different inoculum concentrations on the dry and fresh weight,stem length,and stem thickness of soil cultured rice

图3 解淀粉芽孢杆菌SQ-2 在不同浓度下对土培水稻生长的影响Fig.3 Effects of B.amyloliquefaciens SQ-2 on soil cultured rice under different bacterial inoculum concentrations
在土培条件下,当菌液浓度在108及3×108CFU/mL 时,对植物的促生效果较好;而在水培条件下,菌液浓度在104CFU/mL 时促生效果较好。
2.4 解淀粉芽孢杆菌SQ-2对土壤中速效氮磷钾、土壤酶活性以及土壤pH的影响
接种菌株SQ-2 20 d 后,土壤中上述4 种酶的活性均得到了提升。其中蔗糖酶、蛋白酶与脲酶的活性只有在S5 组较对照组提升显著,分别提高了89.1%、44.94%、127.2%;酸性磷酸酶活性从S2 组开始,与对照组相比有显著提升,S2-S5 组分别提升了原来的1.28、1.62、1.66 与1.79 倍(图4)。
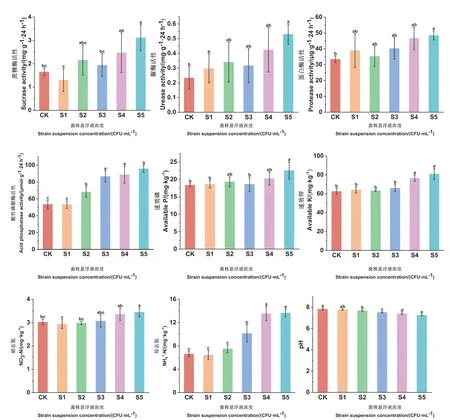
图4 解淀粉芽孢杆菌SQ-2 在不同浓度下对土壤中速效氮磷钾、pH 与酶活性的影响Fig.4 Effects of B.amyloliquefaciens SQ-2 at different concentrations on nitrogen,phosphorus,potassium,pH and enzyme activity in soil
土壤中的速效磷与硝态氮在S5 组与对照相比效果显著,分别增加了22.7%与13.9%。土壤速效钾在S4、S5 组显著高于对照组,增加了22.2%与29.5%。土壤铵态氮从S3 组开始与对照组相比有显著提升,S3-S5 组分别提升了1.53、2.05 与2.06 倍。从S2 组开始,土壤pH 显著降低。对照组pH 为 7.83,而S5 组的pH 降至7.26(图4)。
土壤pH 与所有的指标都呈显著负相关,并且与蛋白酶、脲酶、酸性磷酸酶、速效钾、硝态氮与铵态氮呈极显著负相关(图5)。
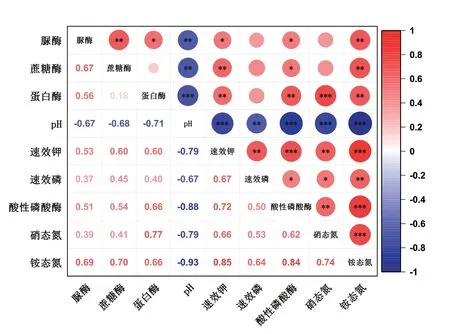
图5 接种解淀粉芽孢杆菌SQ-2 后土壤营养成分、土壤酶活性与pH 的相关性Fig.5 Correlation between soil nutrient composition,soil enzyme activity,and pH after inoculation with B.amyloliquefaciens SQ-2(n=18)
2.5 接种解淀粉芽孢杆菌SQ-2对土壤细菌生态结构的影响
2.5.1 香农指数稀释曲线与群落Venn 图 根据样品中最小序列数进行抽平,S5 组取检测3 次的平均值,其OUT 数量为685,特有的OUT 数为85。CK 对照组同样为检测3 次的均值,其OUT 数量为625,特有的OUT 数为25,可以看出S5 组的细菌OUT 数要高于对照组(图6-B)。
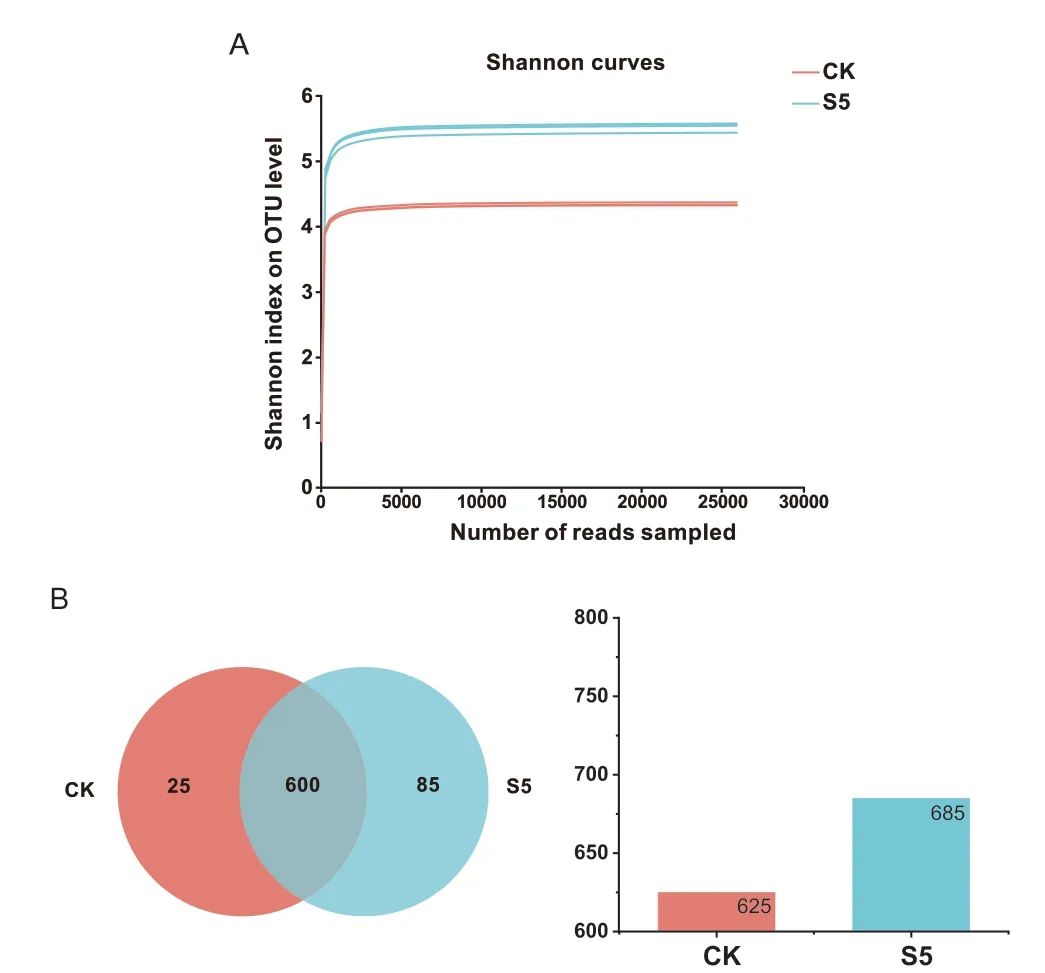
图6 解淀粉芽孢杆菌SQ-2 的香农稀释曲线与Venn 图Fig.6 Shannon dilution curve and Venn plot of B.amyloliquefaciens SQ-2
解淀粉芽孢杆菌SQ-2 的接种使得土壤群落数增多,丰富了土壤环境中的细菌种类。香农指数表示物种的均匀度与数目,S5 组与对照组的香农指数稀释曲线慢慢趋近平缓(图6-A),说明测试可以基本涵盖微生物的数目。
2.5.2 土壤α 多样性 综合水培与土培的实验结果,对接种菌株浓度为S5(3×108CFU/mL)与CK(水)的组分别进行细菌α 多样性统计。
其中Ace、Chao、Sobs、Shannon 指数均存在显著差异,且S5 组要显著高于CK 对照组。而Simpson 指数则是CK 对照组显著高于S5 组。Coverage指数则没有显著变化。说明接种菌株后提高了群落的α 多样性,且群落中微生物数目变多(图7)。
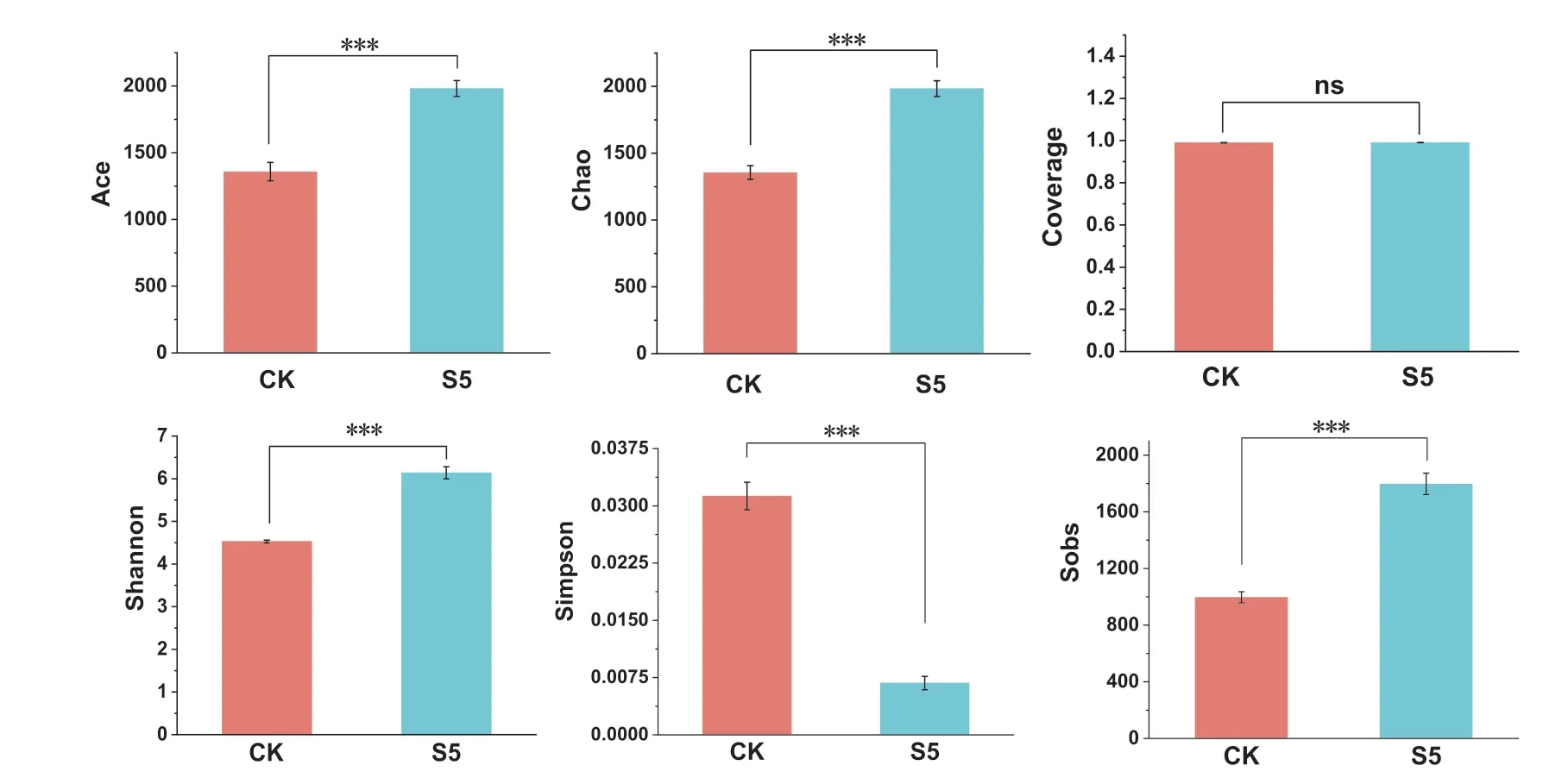
图7 土壤细菌多样性分析Fig.7 Diversity analysis of soil bacteria
2.5.3 接种解淀粉芽孢杆菌SQ-2 对土壤细菌群落组成的影响 S5 组在门分类水平的优势微生物为(相对丰度≥10%):放线菌门(Actinobacteria)、变形菌门(Proteobacteria)与拟杆菌门(Bacteroidota)。变形菌门的相对丰度由对照组的50%降低至29%;拟杆菌门的相对丰度由20.5%降低至1.5%;而放线菌门的相对丰度由13.45%提升至44%(图8-A)。
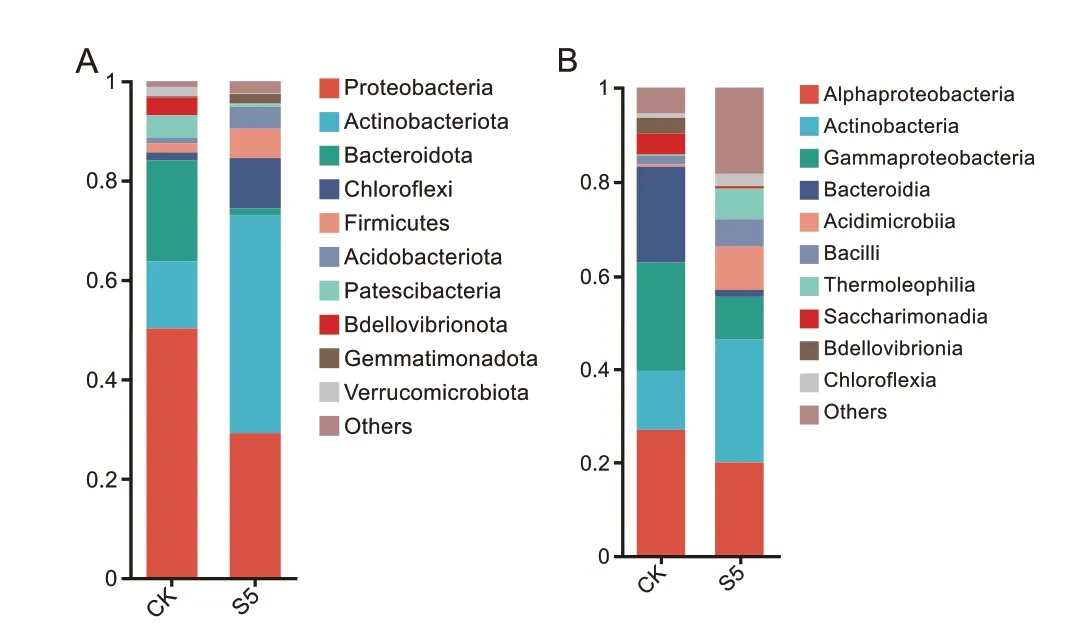
图8 水稻根际土壤细菌群落组成分析Fig.8 Analysis of bacterial community composition in rice rhizosphere soil
S5 组在纲分类水平的优势微生物为(相对丰度≥10%):α-变形菌纲(Alphaproteobacteria)与放线菌纲(Actinobacteria)。α-变形菌纲的相对丰度由对照组的26%降低至19%;放线菌纲的相对丰度由12%提升至26%(图8-B)。
3 讨论
植物根际促生菌(PGPR)可以分泌植物激素、释放挥发性物质、抑制病原菌以及矿化土壤中的养分,为植物生长发育创造条件。由于促生菌生化特性不同,其促生机制存在差异,这常导致同一种菌具备多种促生能力。目前为止,芽孢杆菌属的大部分菌株都是制备优质生物制剂的首选[18]。解淀粉芽孢杆菌SQ-2 是从市售豆瓣酱中分离筛选出的一株具备解钾、溶磷与固氮作用的多功能菌株,为生物菌剂开发提供了重要的资源。
对菌株进行溶磷能力定性检测时,本研究采用了磷酸三钙作为磷源的固体培养基来检测细菌的溶磷能力,然后根据溶磷圈的大小来初步判断其溶磷情况。试验中培养基并没有出现明显的透明圈,而在溶磷的定量实验中,菌株SQ-2 对磷酸三钙的溶解量为229.63 mg/L。朱培淼等[19]实验证明,透明圈直径的大小并不能准确反映菌株的解磷能力。推测菌株产生溶磷圈直径的大小与菌株分泌的酶、小分子酸的类型以及其释放速率有关[20]。因此在实验中,应该以实际摇瓶中检测到的溶磷量为准。而pH 值与对照相比显著下降,推测菌株 SQ-2 能产生有机酸,进而通过酸化、螯合等方式提升培养基中可溶性磷的含量。溶磷菌通过分泌有机酸,一方面降低介质pH 值,直接溶解不溶性无机磷酸盐;同时,有机酸的羧基与阳离子(如铁、铝等)螯合,从铁铝磷酸盐中释放正磷酸盐[21-22]。有报道显示复合接种B.japonicum 5038 和 P.mucilaginosus 3016 能提高大豆(Glycine max)根际有机酸合成基因(pflAD、ackA、ldhA、ppc、gltA)的丰度进而提高溶磷效果[23]。有溶钾功能的促生菌除了产酸帮助钾增溶外,还可能使其分泌高分子有机配体,这些物质与矿物表面的离子形成络合物,从而削弱金属氧键;或是利用自身产生的胞外多糖与有机酸相互吸附,共同附着在矿物表面,实现对含钾矿物的溶解[24]。
生物固氮是植物利用氮素的主要方式[25],在整个生物固氮过程参与的主要酶为固氮酶[26]。菌体中的固氮酶能将空气中的氮气(N2)还原成氨(NH3),从而为植物提供氮源。固氮微生物主要包括自生固氮菌、共生固氮菌和联合固氮菌3 种。自生固氮菌的固氮效率比其他两种低,但它对环境适应能力强,能自主从空气中吸收氮气。例如固氮菌属(Azotobacter)、红螺菌属(Rhodospirillum)、克雷伯氏菌属(Klebsiella)等均属于自生固氮菌[27]。王振龙等[28]将固氮菌Acinetobacter NCRS21与Pseudomonas baetica NCHP9 接种至燕麦(Avena sativa L.)根际,发现这两种菌株对燕麦生长具有显著的促进作用,较对照分别增加了11.05%、7.45%。经过Pearson 相关性分析表明,NCRS21 与NCHP9的固氮酶活性与燕麦的地上干重呈正相关性,说明固氮菌具有一定的研究潜力。经过试验后发现菌株SQ-2 有固氮酶活性,但菌株SQ-2 的固氮能力需要进一步探索。未来可以利用多组学知识,找到更多与有机酸合成或是固氮相关的调控基因来提高对促生机制的认识[22]。
接种解淀粉芽孢杆菌SQ-2 后水稻的生物量得到了提高,且水稻土壤中速效氮磷钾的含量与酶活性高于对照。土壤酶是有机质和养分循环的中间载体,可以用来评估土壤肥沃度与健康情况[29]。土壤中营养元素与酶活性的变化,并非是由于外源性接种细菌的单独作用,因土壤有着极其复杂的微生物环境,外源性细菌也会对群落丰度产生影响,从而改变土壤的整体结构。土壤微生物能维持土壤健康,并可以抵御部分病原体[30-31]。溶磷菌的接种使土壤中各类有机物质溶解,这些物质释放出的营养元素可能会改变部分土壤群落结构,并增加土壤的α 多样性[32]。接种菌株SQ-2 提升了土壤中芽孢杆菌属的比例,推测原因应为该菌株定殖在根部所导致。目前的研究中,土壤pH 值是细菌丰度的重要驱动因素,pH 值对土壤类型和土壤细菌群落的组成有很大的影响[33]。酸杆菌门在较低pH 值的土壤中丰度更高[34],这与本实验研究结果一致,这也间接证明解淀粉芽孢杆菌SQ-2 可以释放酸性物质降低土壤pH。前人研究结果已证实根际微生物与土壤营养指标高度相关,因此研究细菌群落结构与土壤养分之间的关系可为植物促生找到微生物学机制[35]。解淀粉芽孢杆菌SQ-2 可作为微生物复合菌肥的原料,但还需进一步探究菌株在大田试验中的定殖与促生能力。
4 结论
本研究证明了解淀粉芽孢杆菌SQ-2 有溶磷固氮解钾的作用,且菌株对土培水稻的促生效果优于水培。接种菌株后,土壤中的酶活性与速效氮磷钾的含量均得到提高,还能够增加土壤α 多样性,改变土壤中细菌群落结构,提升土壤中益生菌群比例。菌株SQ-2 有较好的水稻促生作用,具有一定的应用潜力。
