水稻热激转录因子HsfA2b 调控非生物胁迫抗性的功能分析
2024-03-12邹修为岳佳妮李志宇戴良英李魏
邹修为 岳佳妮 李志宇 戴良英 李魏
(1.湖南农业大学植物保护学院,长沙 410128;2.湖南省临湘市云湖街道农业综合服务中心,岳阳 414300)
植物在生长过程中,常会遭受各种非生物胁迫(如高温、低温、干旱、水涝、高盐、日灼等)而严重影响植物的生长发育,甚至可导致植物死亡,因此,非生物胁迫是农作物产量和品质的重要制约因素[1]。然而,植物在长期进化过程中形成了一系列应激反应抵抗各种非生物胁迫。其中,热激转录因子(heat shock transcription factors,HSFs)便是植物热应激响应的关键调节因子[2]。
HSFs 在真核生物中具有结构和功能上的保守性。HSFs 包含N 端的DNA 结合域(DNA binding domain,DBD)、寡聚化结构域(oligomerization domain,OD)、核定位信号(nuclear localization signal,NLS)以及C 端核输出信号(nuclear export signal,NES)和C 端转录激活结构域(C-terminal transcriptional activation domain,CTAD)5 个结构域,其中,DBD 是HSFs 中结构和功能最保守的结构域[3]。根据序列相似性和OD 结构的不同,植物HSFs 家族可分为HSFA、HSFB 和HSFC 三类[4-5],A 类HSFs 主要负责热激基因的表达调控,B 类和C 类因缺少短肽AHA(aromatics,hydrophobic and acidic amino acid residues)基元而不具备激活功能[6]。此外,HSFs位于植物胁迫响应链的末端,可以特异性识别并结合胁迫响应相关基因以调控其表达,从而激活体内的防御系统,提高植物对胁迫的抗性[7-9]。
植物HSFs 参与了包括高温、高盐、干旱和氧化等多种逆境胁迫响应[10-12]。如HSFA1 作为番茄耐热过程中必不可少的元件,是高温诱导基因表达的主要调控者,在高温胁迫触发、维持和恢复3 个阶段中起显著调控作用[13]。拟南芥hsfA2 突变体相比野生型对热激更敏感,说明拟南芥HsfA2 能够增强拟南芥耐热性[14]。相似地,过表达TaHsfA6b 的小麦植株耐热性增强[15];在烟草中过表达向日葵HaHSFA9 可增强热休克蛋白(HSPs)的积累,在种子发芽早期耐热性中发挥重要作用[16]。除此之外,低温条件下,拟南芥AtHsfA1d 能提高核糖体蛋白基因的表达,促进下胚轴的伸长[17],而拟南芥AtHsfC1 也参与调控低温胁迫[18]。拟南芥AtHsfA4a可增强植株对盐和氧化胁迫的耐受性,被敲除后植株对盐高度敏感[19]。拟南芥过表达AtHsfA6a 植株在萌发期和苗期对ABA 高度敏感,而耐盐和耐干旱胁迫的能力则显著增强[20]。豌豆中过表达拟南芥AtHsfA1d 可降低热胁迫下产生的活性氧(reactive oxygen species,ROS)含量,并显著增强其抗氧化酶活性,以减少热胁迫带来的损害[21]。
迄今为止,水稻中HSFs 的研究主要以高温胁迫为主。本文前期研究工作将高温胁迫后的水稻进行转录组分析发现,热激转录因子OsHsfA2b 被高温胁迫极显著诱导。而OsHsfA2b 作为A 类HSF,在水稻抗逆性的功能研究上尚未被明确报道,且其作用机制以及表达调控网络也尚不清楚。
本研究构建了OsHsfA2b 过表达和RNAi 转基因水稻,并对其进行了非生物胁迫抗性分析,探究OsHsfA2b 调控水稻对非生物胁迫抗性的途径,为培育水稻抗逆新品种提供了优异基因资源和理论支撑。
1 材料与方法
1.1 材料
试验材料为粳稻品种日本晴(NPB),以NPB为遗传背景的OsHsfA2b 过表达植株(OsHsfA2b-OX,T3代)及OsHsfA2b-RNAi 转基因T3代纯合株系。
1.2 方法
1.2.1 水稻材料种植 将NPB 种子、OsHsfA2b-OX转基因种子和OsHsfA2b-RNAi 转基因种子分别播于1/2 MS(Murashige &Skong)培养基、含0.1%潮霉素的1/2 MS 培养基和含0.2% Basta 的1/2 MS 培养基中,置于28℃、14 h 光照/10 h 黑暗的温室中培养7-10 d,然后移栽到营养土中,作为后续试验材料。
1.2.2 高温、低温处理 将28℃条件下培养至3 叶期的水稻幼苗置于42℃、相对湿度75%、14 h 光照/10 h 黑暗的温室中,分别处理0、1、3、8、12 和24 h后取样,液氮速冻后于-80℃保存备用。低温处理为4℃,处理时间为0、3、6、12 和24 h,其余条件不变。
1.2.3 DAB 染色 将处理后的水稻叶片浸没在含有1 mg/mL DAB(3,3'-二氨基联苯胺)溶液中,室温避光过夜孵育后,再置于脱色液(无水乙醇∶乙酸∶甘油=3∶1∶1)中96℃水浴加热20 min,然后95%酒精浸泡48 h,直到所有叶绿素都被去除,拍照记录染色结果。
1.2.4 模拟干旱处理 在Yoshida 营养液中添加终浓度为20% PEG 6000,模拟干旱处理,将2-3 周龄的水稻幼苗置于其中,分别处理0、1、3、8、12 和24 h 后取样,液氮速冻后于-80℃保存备用。
1.2.5 高盐处理 种子发芽处理:将消毒后的水稻种子播于含150 mmol/L NaCl 的1/2 MS 培养基上,温室中培养5 d,统计不同材料的发芽情况。
苗期处理:将3 周龄的水稻幼苗置于Yoshida营养液(添加终浓度为250 mmol/L 的NaCl)中,分别处理0、1、3、8 和24 h 后取样,液氮速冻后于-80℃保存备用。
1.2.6 RT-qPCR 分析 使用Trizol 试剂盒提取水稻叶片总RNA。利用RNA 反转录试剂盒去除基因组DNA 并反转录合成cDNA,以水稻UBQ 为内参对照,进行qPCR 分析。反应条件为95℃ 10 min;95℃ 10 s,60℃ 35 s,68℃ 15 min,40 个循环;68℃ 6 min。所用引物列于表1。

表1 实时荧光定量PCR 引物Table 1 Primers for RT-qPCR
2 结果
2.1 OsHsfA2b的克隆及其编码蛋白的结构分析
以NPB 水 稻cDNA 为模 板,扩增OsHsfA2b 全长序列,获得OsHsfA2b 的CDS(图1),CDS 长度为1 119 bp,编码372 个氨基酸。
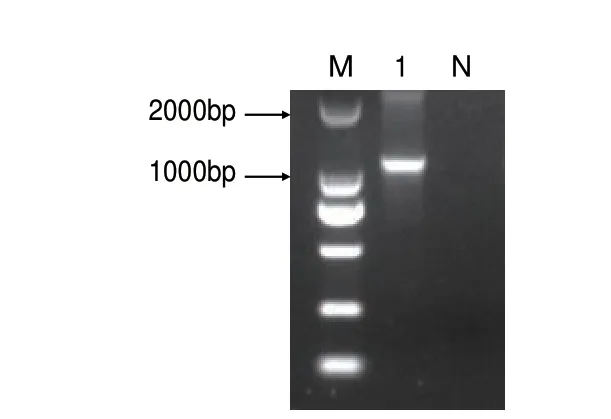
图1 OsHsfA2b 的CDS 扩增电泳图Fig.1 Electropherogram of OsHsfA2b gene CDS amplification
利用NCBI 软件进行OsHsfA2b 蛋白结构域预测(图2),OsHsfA2b 在第49-142 位氨基酸形成了HSFs 中结构和功能高度保守的DNA 结合结构域(DNA binding domain,DBD)。此外,该蛋白还在第173-223 位氨基酸为寡聚化结构域(oligomerization domain,OD),第238-253 位氨基酸为核定位信号(nuclear localization signal,NLS),第328-337 位 氨基酸为C 端核输出信号(C-terminal transcriptional activation domain,CTAD)和第356-363 位氨基酸为C 端转录激活结构域(nuclear export signal,NES)。
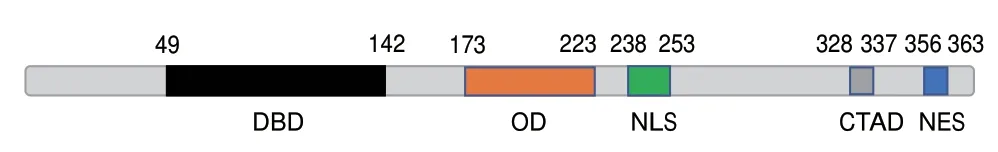
图2 OsHsfA2b 的蛋白结构Fig.2 Protein structure of OsHsfA2b
2.2 OsHsfA2b过表达和RNAi植株的鉴定
运用RT-qPCR 对OsHsfA2b-OX 和RNAi 转基 因水稻植株T3代转基因植株体内的OsHsfA2b 表达量进行检测。结果显示,OsHsfA2b-OX 植株中OsHsfA2b的表达量远高于野生型(图3-A),而OsHsfA2b-RNAi 植株中OsHsfA2b 的表达量却显著比野生型低(图3-B),说明OsHsfA2b-OX 和RNAi 转基因植株为可用于下一步研究的阳性植株。

图3 OsHsfA2b-OX 和OsHsfA2b-RNAi 转基因植株的鉴定Fig.3 Identification of OsHsfA2b-OX and OsHsfA2b-RNAi transgenic plants
2.3 OsHsfA2b正调控水稻对温度胁迫的抗性
为分析OsHsfA2b 在水稻响应温度胁迫反应中的作用,高温处理水稻野生型NPB 植株后检测OsHsfA2b 的表达水平发现,该基因可被高温胁迫诱导,尤其是处理12 h 后达到高峰(图4-A)。处理2 d 后发现,NPB 植株叶片表现严重卷曲,而OsHsfA2b-OX 植株叶片较为平整,相反,OsHsfA2b-RNAi 植株叶片卷曲程度超过NPB(图4-C)。当恢复正常生长条件10 d 后,统计这3 种材料的存活率发现,OsHsfA2b-OX 植株存活率比NPB 显著提高,而OsHsfA2b-RNAi 植株存活率远低于二者(图4-D)。
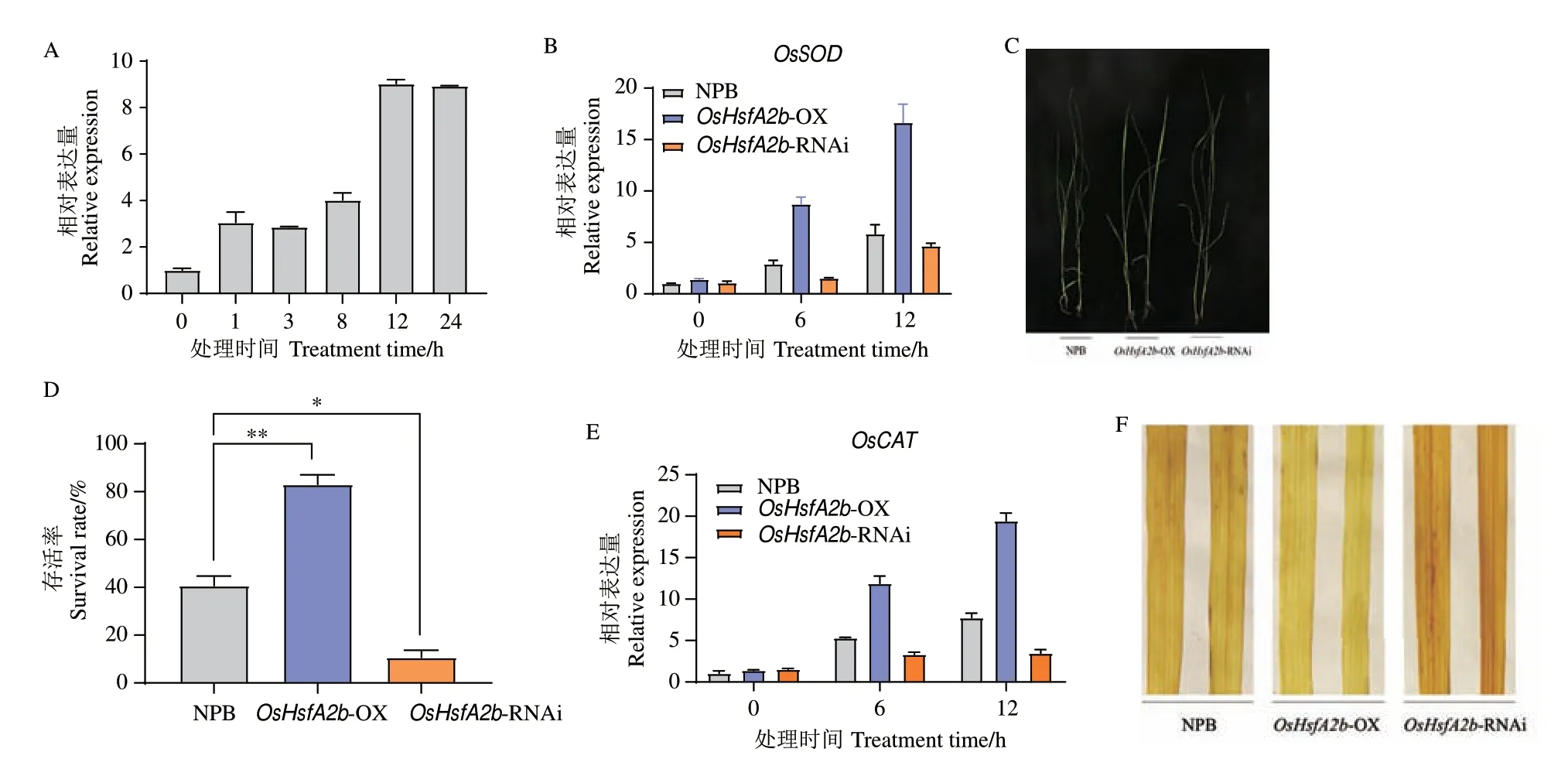
图4 高温胁迫下转基因植株的表型和OsHsfA2b 的表达Fig.4 Phenotypes and OsHsfA2b expressions of transgenic plants under high temperature stress
在受到高温胁迫后,植物体内的ROS 含量会大量增加,使植物经受氧化胁迫而导致损伤,因此,植物会激活体内的过氧化物酶帮助清除ROS 达到动态平衡。为了分析OsHsfA2b 对水稻抗氧化途径是否具有调控作用,使用DAB 染色法检测OsHsfA2b 转基因和野生型水稻在高温胁迫后的ROS 含量和抗氧化途径相关基因的表达水平。结果显示,在高温胁迫下,OsHsfA2b-RNAi 转基因植株比NPB 积累更多的ROS,而OsHsfA2b-OX 转基因植株则比NPB 体内的ROS 积累量更少(图4-F)。抗氧化途径相关基因OsSOD 和OsCAT 的表达量在上述3 种植株内都可被高温胁迫诱导,且高温胁迫使OsHsfA2b-OX 转基因植株中OsSOD 和OsCAT 的表达量比在NPB 中要显著提高,相反,OsHsfA2b-RNAi 植株中这两个基因的表达量在高温胁迫处理后比NPB 表达量要低(图4-B,E)。结果表明,OsHsfA2b 可以通过抗氧化途径正调控水稻对高温胁迫的抗性。
此外,将NPB 置于4℃低温培养箱中,利用RT-qPCR 检测NPB 中不同处理时间点OsHsfA2b 转录水平变化。结果显示,低温条件也能诱导OsHsfA2b的表达量上调(图5-A)。OsHsfA2b-OX 植株在低温处理2 d 后卷曲,受损的叶片明显少于NPB 与OsHsfA2b-RNAi 植株(图5-B)。当恢复到正常生长条件7 d 后,统计这些苗存活率发现,OsHsfA2b-OX植株存活率最高,OsHsfA2b-RNAi 植株存活率最低(图5-C)。同样地,在低温处理后,OsHsfA2b-OX植株中OsSOD 和OsCAT 的表达量显著高于NPB,而OsHsfA2b-RNAi 中这两个基因的表达量总体上比NPB 要低(图5-D-E)。由此可见,OsHsfA2b 可能通过抗氧化通路降低水稻对低温胁迫的敏感性。
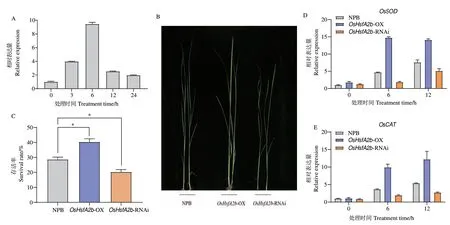
图5 低温胁迫下转基因植株的表型和OsHsfA2b 的表达Fig.5 Phenotypes and OsHsfA2b expressions of transgenic plants under low temperature stress
2.4 OsHsfA2b正调控水稻对干旱胁迫的抗性
为分析OsHsfA2b 在水稻响应干旱胁迫反应中的作用,用含20% PEG6000 的水稻营养液模拟干旱处理野生型水稻NPB 后,利用RT-qPCR 检测OsHsfA2b 的转录水平。结果显示,OsHsfA2b 可被干旱诱导,在3 h 时表达量达到最高峰,后逐渐降低(图6-A)。此外,干旱处理1 d 后发现NPB 幼苗大部分出现叶片卷曲,甚至萎蔫枯黄,OsHsfA2b-OX植株叶片则萎蔫不明显,而OsHsfA2b-RNAi 幼苗叶片则比NPB 卷曲萎蔫更严重,甚至干枯(图6-B)。结束处理恢复正常生长条件10 d 后,统计上述幼苗存活率,OsHsfA2b-OX 幼苗存活率高于80%,NPB幼苗存活率接近40%,而OsHsfA2b-RNAi 幼苗不足15%(图6-C)。以上结果说明,干旱处理能诱导OsHsfA2b 的表达,OsHsfA2b-OX 植株的抗旱性提高,相反,OsHsfA2b-RNAi 植株抗旱性降低。同时,在干旱处理后,OsHsfA2b-OX 植株中OsSOD 和OsCAT 的表达量较NPB 显著增高而OsHsfA2b-RNAi 植株中这两个基因的表达量总体上比NPB 降低(图6-D-E)。进一步说明,OsHsfA2b 可能通过抗氧化途径正调控水稻对干旱胁迫的抗性。
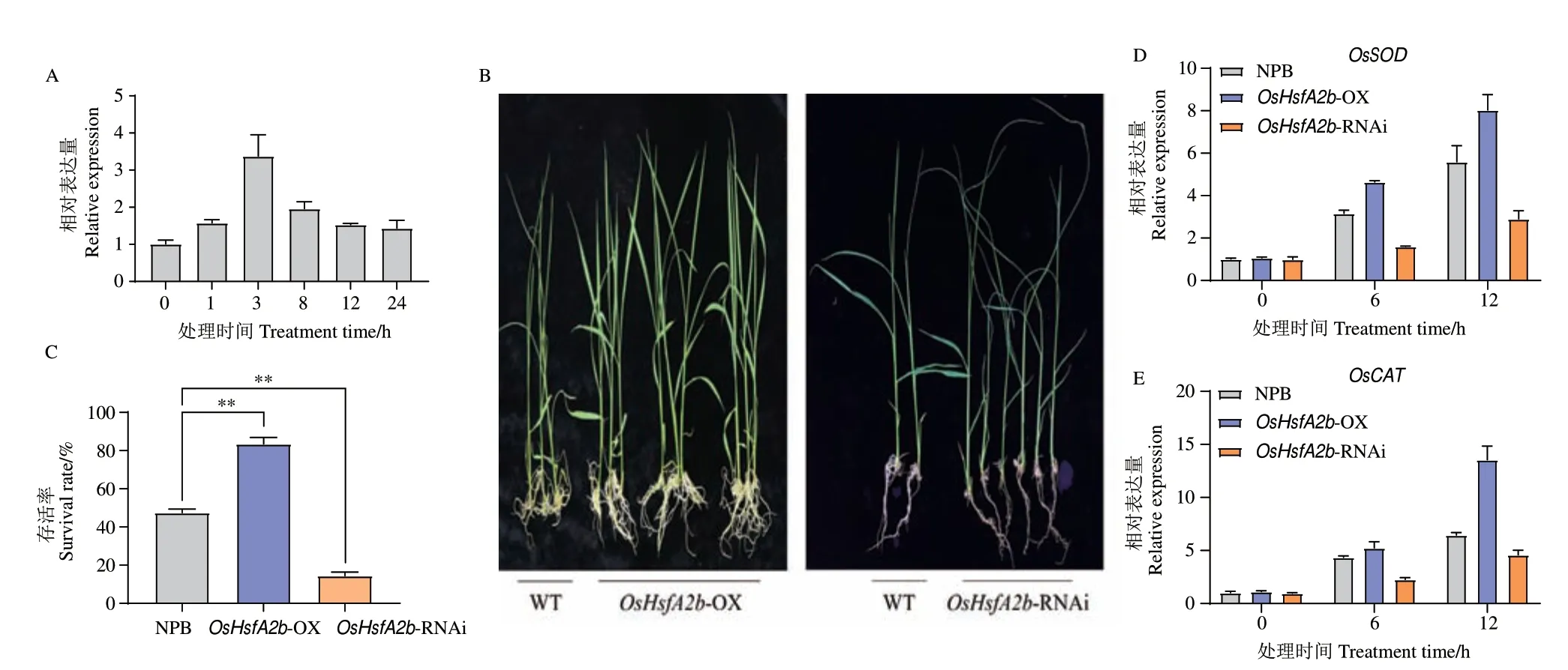
图6 干旱胁迫下转基因植株的表型和OsHsfA2b 的表达Fig.6 Phenotypes and OsHsfA2b expressions of transgenic plants under drought stress
2.5 OsHsfA2b正调控水稻对高盐胁迫的抗性
进一步分析OsHsfA2b 在调控水稻抗高盐胁迫方面的功能,将NPB 幼苗置于含150 mmol/L NaCl 的水稻营养液中处理发现,OsHsfA2b 的表达量在处理后24 h 内逐渐上调(图7-A)。此外,NPB、OsHsfA2b-OX 和OsHsfA2b-RNAi 植株种子在150 mmol/L NaCl高盐条件下萌发5 d 后,OsHsfA2b-RNAi 种芽的生长相比NPB 受到更明显抑制,而OsHsfA2b-OX 种子萌发与生长情况均比NPB 更好(图7-B)。在苗期进行高盐处理2 d 后发现,NPB 植株叶片大部分出现卷曲,OsHsfA2b-OX 植株叶片仅少部分叶片的叶尖稍卷曲,而OsHsfA2b-RNAi 植株叶片相比NPB 卷曲更严重(图7-C)。同时,在高盐处理后,OsHsfA2b-OX 植株中OsSOD 和OsCAT 的表达量显著高于NPB,OsHsfA2b-RNAi 植株中的这两个基因表达量比NPB 总体降低(图7-D-E)。上述结果说明,OsHsfA2b 可能通过抗氧化途径正调控水稻对高盐胁迫的抗性。
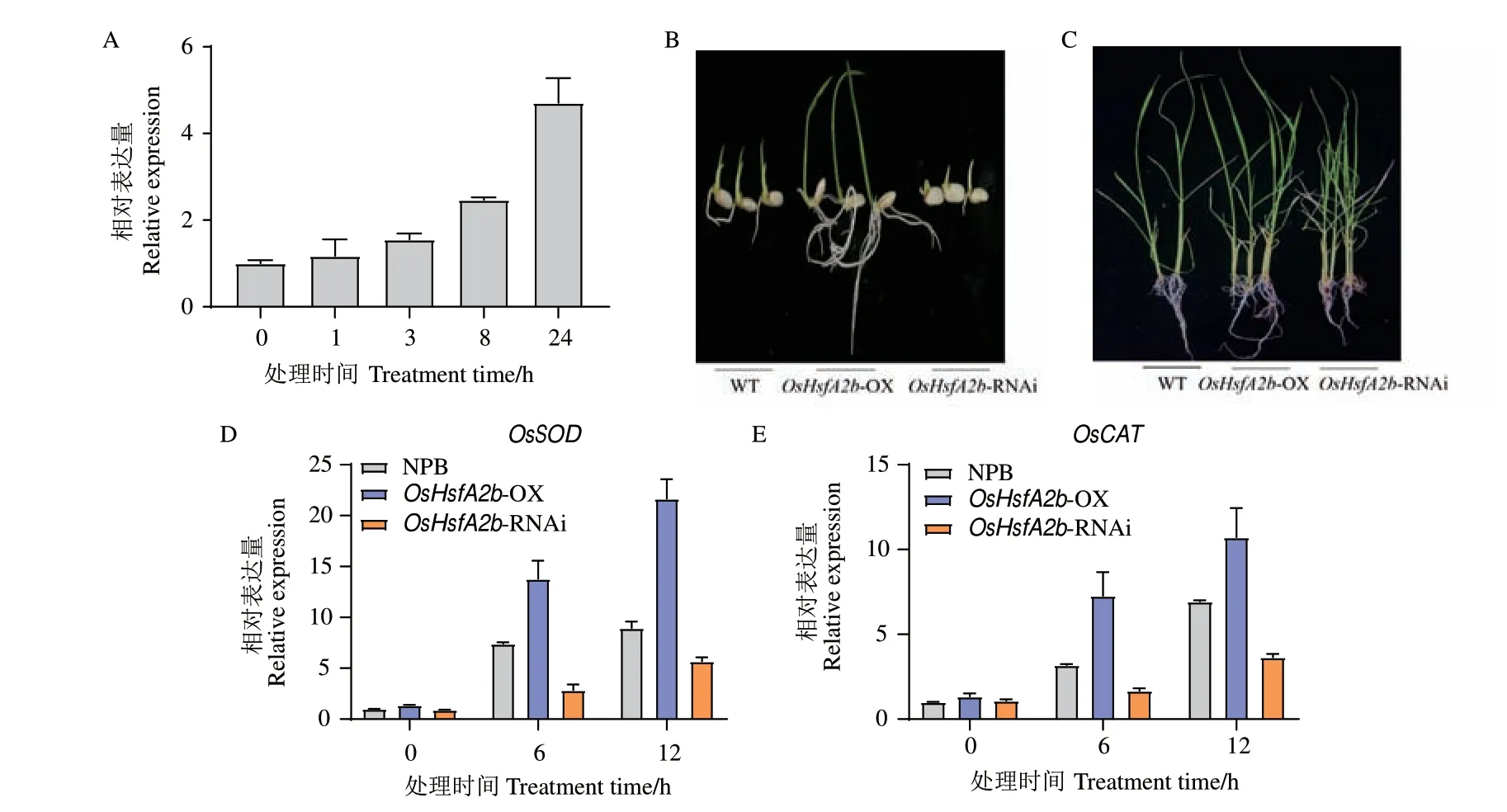
图7 高盐胁迫下转基因植株的表型和OsHsfA2b 的表达Fig.7 Phenotypes and OsHsfA2b expressions of transgenic plants under high salt stress
3 讨论
目前,A 类HSFs 在多种植物应激反应中发挥着重要作用,而其功能研究主要集中在调控植物应答高温胁迫信号。如番茄、拟南芥、水稻HsfA2 是热胁迫下最容易被诱导的热激转录因子,AtHsfA2 超表达植株能够增强其基础耐热性和获得耐热性,而其突变体植株基础耐热性和获得耐热性均有所降低[22]。同样地,HSFs 在植物响应低温胁迫反应中也扮演重要的角色。如,OsHSFC1a/C1b/C2a/C2b 和OsHSFA4d/A7/A9 在经4℃低温处理后表达量显著上调[23]。OsHsfA2b 作为A 类HSF,在水稻抗逆性研究上尚未被明确报道,本研究发现OsHsfA2b 能被高温和低温胁迫诱导表达,且OsHsfA2b 正调控水稻对高温胁迫和低温胁迫的抗性,因此,OsHsfA2b 可作为优良基因资源在水稻育种中用于抵御极端温度胁迫。
有研究表明,A 类HSFs 在植物抗旱中发挥正调控因子的作用,如水稻OsHsfA7 能显著提高植株抗旱性[24]。OsHsfA2b 与OsHsfA7 功能类似,能被干旱胁迫诱导表达,并且OsHsfA2b 也能正调控水稻对干旱胁迫的抗性。同样地,HSFs 也在植物高盐胁迫中发挥调控功能,如拟南芥部分HSFs 基因在高盐胁迫时表达量显著升高,其中,AtHsfA6a 受高盐胁迫后表达量高出对照100 多倍[18]。同样,当在拟南芥中过表达小麦TaHsfA2d 后,用高盐胁迫处理植株发现,TaHsfA2d 过表达植株的种子发芽率明显高于野生型,表明TaHsfA2d 在调控植物盐胁迫响应中发挥重要作用[25]。本研究也发现,OsHsfA2b-OX 植株在高盐环境条件下,比NPB 和OsHsfA2b-RNAi 幼苗的长势更好,根系更发达,而OsHsfA2b-OX 幼苗发达的根系能帮助水稻在逆境胁迫中更加稳定地吸收水分和养分,保证其正常的生理代谢,并更好地感知和传递逆境胁迫信号。
当植物遭受极端温度、干旱和高盐等非生物胁迫时,细胞内ROS 含量会快速增加,而植物体内ROS 过量积累会损伤细胞,甚至导致细胞死亡,严重影响植物生长[26]。在这些逆境胁迫下,活性氧清除基因可被诱导,进而清除过量活性氧以达到动态平衡减轻非生物胁迫诱导的活性氧过量积累产生的有害影响。例如,HSFA2 在非生物胁迫环境中可诱导拟南芥中清除ROS 的APX1 和APX2 的表达进而促进过度积累的ROS 的清除[27]。本研究发现,高温胁迫条件下,OsHsfA2b-OX 转基因植株中的ROS含量明显比野生型低,且在极端温度、干旱和高盐处理后的OsHsfA2b-OX 转基因植株中,抗氧化途径相关基因OsSOD 和OsCAT 的表达量都显著上调,说明OsHsfA2b 通过抗氧化途径来提高水稻对非生物胁迫的耐受性。在不同的逆境胁迫中,植物热激转录因子除自身会有表达水平的变化外,会调控与逆境胁迫响应相关基因的表达,从而帮助植物抵抗逆境胁迫以维持正常的生命活动。目前对OsHsfA2b 调控哪些逆境胁迫相关的靶标基因来帮助植物抵抗逆境胁迫还有待进一步探究。
4 结论
在非生物胁迫条件下,水稻热激转录因子OsHsfA2b 能够被诱导表达,且过量表达OsHsfA2b 能明显增强水稻植株的抗逆性,提高存活率。此外,在逆境胁迫下,OsHsfA2b 能够诱导抗氧化途径相关基因的表达,抑制水稻体内活性氧的积累,从而减弱逆境胁迫诱导的活性氧大量积累对植株的伤害。OsHsfA2b 可通过抗氧化途径正调控水稻对逆境胁迫的抗性。
