SARS-CoV-2 Omicron 变异株多重微滴式数字 PCR 定量方法的建立及应用
2024-03-12郑巧林华徐浩安微薛昌华张婧韩国全
郑巧 林华 徐浩 安微 薛昌华 张婧 韩国全
(1.成都海关技术中心,成都 610000;2.四川农业大学食品学院,雅安 625014;3.深圳海关动植物检验检疫技术中心,深圳 518045)
严重急性呼吸综合征冠状病毒2 号(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引发的新冠疫情对全球公共卫生构成巨大威胁,截至2023 年5 月6 日,全球共计报告了7.6 亿例确诊病例,超过600 万人因此丧失生命。世界卫生组织(World Health Organization,WHO)基于当前疫情流行趋势和人群免疫情况下调新冠疫情全球风险级别,宣告新冠疫情不再构成“国际关注的突发公共卫生事件”,但根据病毒的发展趋势来看,短时间内不能彻底消失,仍然存在毒株变异和感染传播的风险。SARS-CoV-2 是冠状病毒科的一种单链 RNA 包膜病毒,直径约60-140 nm,基因组全长约30 kb[1-2]。其中,非结构蛋白编码区主要包括开放读码框架(open reading frame,ORF)1a 和 ORF1b 基因,结构蛋白主要通过核衣壳蛋白(nucleocapsid protein,N)、包膜蛋白(envelope protein,E)、膜蛋白(membrane protein,M)和刺突蛋白(spike protein,S)维持病毒的转录和复制,促进病毒遗传物质侵入宿主细胞干扰正常生命等活动[3]。SARS-CoV-2 可以跨越物种屏障感染人类和动物(果子狸、单峰骆驼、穿山甲、蝙蝠)等,Chan 等[4-5]对 SARS-CoV-2 的鉴定和特征进行分析,研究表明,SARS-CoV-2 在全基因组水平上与蝙蝠冠状病毒有96%的相同性,被认为是携带新冠病毒的天然宿主。SARS-CoV-2 具有灵活的基因重组和快速适应突变能力,已不断进化演变出新的关注变异株(包括 Alpha、Beta、Gamma、Delta和 Omicron)[6-10],因此在 SARS-CoV-2 的核酸检测中,对病原毒株类型的鉴定具有更高要求。
Omicron 变异株成为全球流行优势毒株[11],据中国疾病预防控制中心发布《全国新型冠状病毒感染疫情情况》显示,2022 年9 月26 日-2023年4 月13 日全国报送的40 122 例本土病例 SARSCoV-2 基因组有效序列均为 Omicron 变异株。该变异株携带大量突变,仅在 S 蛋白末端的受体结合域(receptor binding domain,RBD)上就存在15 个突变位点,RBD 与人体细胞表面的血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)受体发生特异性相互作用,病毒能够逃避免疫保护屏障,使Omicron 变异株更具传播性和感染能力[12-13],Omicron 变异株感染人数多但较早期致病力明显下降,感染症状已逐渐演化为一种常见的呼吸道传染病。目前,市面上 SARS-CoV-2 核酸检测试剂引物和探针靶标大多针对于 ORF1ab 基因、N 基因、E 基因设计,不能满足 Omicron 变异株检测需求。根据SARS-CoV-2 各变异株之间 S 基因的序列差异,开发可以快速高效鉴定 Omicron 突变株的检测方法,在全球范围内对这一新变异株的监测至关重要。
微滴式数字 PCR 技术在荧光定量 PCR 技术(quantitative real-time PCR,qPCR)的基础上将核酸的定量检测由相对定量提高到绝对定量[14],是分子生物学检测领域最为重大创新之一。在 ddPCR中,通过微滴化处理将待检模板和反应混合物稀释分散成2 万多个油包水的细小微滴,每个微滴只含有1 个或0 个待检核酸分子,微反应体系扩增完成后,系统采集并分析单个微滴的荧光信号,结合泊松分布定律计算稀释至单分子水平的核酸分子量[15],无需绘制标准曲线就可推算出目标分子的原始拷贝数,实现复杂背景下对微量核酸样本的绝对定量检测[16]。杨朔鹏[17]建立的三重 ddPCR 方法用于检测生物与环境样本中 SARS-CoV-2,与RT-qPCR相比,该方法用于检测低病毒载量的样本有更高的灵敏度和准确性,有效降低了假阴性检出率。Zhou等[18]开发的一种 RT-ddPCR 检测方法,用于同时检测 SARS-CoV-2 和猪急性腹泻综合征冠状病毒(swine acute diarrhea syndrome coronavirus,SADS-CoV),测试结果显示灵敏度分别比 RT-PCR 高4 倍和10 倍,该测试还表现出良好的特异性、可重复性和再现性等优点。
本研究通过对新冠病毒原型株及其他变异株的基因序列比对分析,设计专门针对于 Omicron 变异株 S 基因的特异性引物探针,采用定量分析检测方法——ddPCR 技术,建立SARS-CoV-2 Omicron 变异株四重微滴式数字 PCR 检测方法,实现多靶标定量检测 SARS-CoV-2 ORF1ab 基因、N 基因、E 基因的同时,还能对 Omicron 变异株进行鉴别的双重功能,以期为微量 RNA 病毒检测以及病毒传播风险监测提供重要技术支撑。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 RNA 核酸提取纯化试剂盒(磁珠法)(Vazyme,中国);蛋白酶 K(Vazyme,中国);2× dPCR Probe Master Mix Pius(Sniper,中国);5×One Step RT-PCR Probe Super Mix(Sniper,中国);Enzyme Mix(Sniper,中国);新型冠状病毒 2019-nCoV 核酸检测试剂盒(荧光 PCR 法)(上海之江,中国);EcoR I 酶(New England Biolabs,美国);TB Green®Premix Ex TaqTMII(TaKaRa Dalian,日本)。
1.1.2 仪器与设备 DQ24 数字 PCR 一体机(Sniper,中国);实时荧光定量 PCR 仪(Thermo Fisher Scientific,美国);诺唯赞全自动核酸提取仪(Vazyme,中国);NanoDrop ONEC 超微量核酸蛋白仪(Thermo Scientific,美国);移液器(Eppendor,德国);漩涡振荡混匀仪(Thermo Fisher Scientific,美国);高速冷冻离心机 XR3(Thermo Fisher Scientific,美国);生物安全柜(Thermo Scientific,美国);超低温冰箱(海尔,中国);高压灭菌锅(致微,中国);全自动凝胶图像分析系统(Ultra-Violet Products,美国)。
1.1.3 样本来源 临床鼻咽拭子核酸样本由口岸疫病疫情监测四川省重点实验室提供,新型冠状病毒变异株标准物质(Beta 株 GBW09318、Gamma 株GBW09317、Delta 株 GBW09316、Omicron 株 NIMRM5235)购买于中国计量科学研究院,猪流行性腹泻病毒、猪传染性胃肠炎病毒、甲型流感病毒、诺如病毒、轮状病毒、腺病毒阳性质粒或疫苗由成都海关技术中心动检实验室提供。
1.1.4 引物设计 在 NCBI 和 GISAID 数据库(https://www.gisaid.org/)中下载新型冠状病毒原型株及变异株基因组参考序列,通过 DNAMAN 软件进行基因序列比对,筛选高度保守的目的片段,利用 primer 6.0和 oligo 7 软件对选取的病毒片段进行引物探针设计,引物探针放入 NCBI 中 Primer-Blast 验证特异性,选择最佳引物探针交予生工生物工程(上海)有限公司合成,序列详细信息见表1。

表1 引物与探针序列Table 1 Primer and probe sequences
1.2 方法
1.2.1 病毒RNA 提取 非灭活型临床鼻咽拭子样品先置于56℃水浴锅内灭活30 min,含胍盐类灭活型样品可直接进行核酸提取,在生物安全柜内将样品管涡旋振荡20 s,静置≥30 s 后,吸取200 μL 样品于裂解板中进行病毒裂解分离,提取详细步骤按照核酸提取纯化试剂盒说明书进行,最终,将100 μL TE 缓冲液洗脱的核酸产物置于-20℃保存。
1.2.2 阳性质粒制备与稀释 委托生工生物工程(上海)有限公司合成1.1.4 所述的4 对引物目的片段序列,目的基因扩增后将片段回收纯化,插入 PUC57载体与目的片段连接构建重组质粒标准品,随后PCR 扩增并验证测序结果。将制备成功的阳性质粒标准品用超微量核酸蛋白仪测定质粒浓度,根据公式质粒拷贝数=(M×6.02×1023×10-9)/(n×660),其中M 为质粒DNA 浓度,n 为重组质粒长度=T 载体长度+目的片段长度,计算得到阳性质粒拷贝数,并将阳性质粒10 倍稀释为101-1011,稀释后的阳性质粒标准品置于-80℃冰箱冻存。
1.2.3 单重ddPCR 的扩增 为验证 SARS-CoV-2 ORF1ab 基因、N 基因、E 基因以及 Omicron 变异株 S基因的引物探针是否能对目的基因进行有效扩增,分别以 ORF1ab 基因、N 基因、E 基因以及 S 基因阳性质粒标准品为检测模板进行单重 ddPCR 扩增,RNase Free ddH2O 为阴性对照,按照试剂盒说明书配置反应体系和设定扩增程序。反应体系为: 5×One Step RT-PCR Probe Super Mix(cy5.5)3.5 μL,Enzyme Mix 1 μL,EcoR I 酶1 μL,引物探针浓度均为10 μmol/L 的上下游引物各1 μL,探针0.5 μL,模板 3 μL,ddH2O 补足22 μL。反应程序为: 25℃ 5 min;50℃ 25 min;95℃酶激活5 min;95℃ 15 s,58℃ 30 s,共计40 个循环。
1.2.4 多重ddPCR 的建立与优化 在单重 ddPCR 的基础上建立多重 ddPCR 方法,对4 种目标基因引物探针的配比浓度和使用量进行选择,引物探针浓度均为20 μmol/L 的上下游引物选取0.1、0.2、0.4、0.6、0.8、1.0、1.2 μL,探针选取0.1、0.2、0.3、0.4、0.5、0.6、0.7 μL,选用稀释为同一浓度的阳性质粒标准品分别作为多重 ddPCR 反应扩增模板,同时设置阴性对照和无模板对照,每次实验控制单一变量,每组实验重复2 次,结合阴阳性微滴间荧光差值和检测拷贝数筛选最佳引物探针组合,确保扩增后的一维散点图阴阳性能明显区分且中间弥散微滴数较少,最终确定多重 ddPCR 反应体系。
1.2.5 多重ddPCR 特异性 为确定 SARS-CoV-2 ORF1ab 基因、N 基因、E 基因以及 Omicron 变异株S 基因引物探针特异性是否良好,将猪流行性腹泻病毒、猪传染性胃肠炎病毒、甲型流感病毒、诺如病毒、腺病毒、轮状病毒、新型冠状病毒变异株(Beta株、Gamma 株、Delta 株)作为扩增模板,同一浓度的新冠质粒标准品作为阳性对照,RNase Free ddH2O为阴性对照,采用1.2.4 节中确定好的反应体系和扩增程序,对建立的四重 ddPCR 方法进行特异性实验验证。
1.2.6 多重ddPCR 灵敏度及稳定性 将制备的4 种阳性质粒标准品混合后,进行连续10 倍梯度稀释,以10-6、10-7、10-8、10-9、10-10、10-11不同梯度稀释样本进行多重 ddPCR 扩增,直至检测到阳性微滴数的最低拷贝数即为该方法的检测下限,并对每个浓度重复3 次实验以确定该方法的稳定性。
1.2.7 临床鼻咽拭子样本的检测 口岸疫病疫情监测四川省重点实验室提供鼻咽拭子样本 20 份,按照核酸提取纯化试剂盒(磁珠法)提取病毒RNA,随后用本研究建立的多重 ddPCR 方法和新型冠状病毒2019-nCoV 核酸检测试剂盒(荧光 PCR 法)对临床鼻咽拭子样本的进行检测,分别得到数字 PCR 定量拷贝数结果和荧光定量 PCR 结果,比较分析阳性检出率。
2 结果
2.1 目的基因扩增与鉴定结果
以阳性质粒为扩增模板,4 对引物进行 PCR 扩增,用2%琼脂糖凝胶对 PCR 产物进行电泳检测,凝胶图像分析系统显示见图1。结果表明,扩增条带清晰明亮,无拖带弥散等情况,所得扩增产物与目的片段大小相符。测序结果在 NCBI 上比对,与SARS-CoV-2 同源性达到98%以上,证实设计引物对目的片段有效扩增。
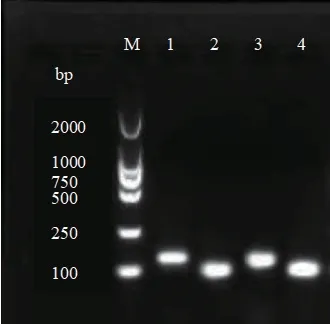
图1 SARS-CoV-2 ORF1ab 基因、N 基因、E 基因、S 基因扩增产物电泳图Fig.1 Electrophoresis map of SARS-CoV-2 ORF1ab,N,E,and S gene amplification products
2.2 单重ddPCR扩增结果
在单重 ddPCR 扩增中,SARS-CoV-2 ORF1ab 基因、N 基因、E 基因以及 Omicron 变异株 S 基因显现良好的扩增效果,各目的基因阴阳性微滴区分明显,阴性对照未出现阳性微滴信号,在58℃退火温度下,4 对引物均能与模板有效结合,适合构建多重 ddPCR 检测体系,扩增信息见图2。

图2 SARS-CoV-2 ORF1ab 基因、N 基因、E 基因、S 基因单重ddPCR 检测一维图Fig.2 One-dimensional map of SARS-CoV-2 ORF1ab gene,N gene,E gene and S gene by single ddPCR
2.3 多重ddPCR的建立与优化
通过优化反应体系和扩增程序,4 组引物探针之间干扰程度较低,扩增的阴阳性微滴能有效分开且中间弥散微滴数较少,可构建四重 ddPCR 方法对新冠病毒进行定量分析。最终确定的多重 ddPCR反应体系为:5×One Step RT-PCR Probe Super Mix(cy5.5)3.5 μL,Enzyme Mix 1 μL,EcoR I 酶 1 μL,20 μmol/L 的ORF1ab 基因上下游引物各0.4 μL,探针0.6 μL,N 基因上下游引物各0.5 μL,探针0.6 μL,E 基因上下游引物各0.5 μL,探针0.7 μL,S 基因上下游引物各0.6 μL,探针0.5 μL,ddH2O 补足22 μL。反应程序为: 25℃ 5 min;50℃ 25 min;95℃酶激活5 min;95℃ 15 s,58℃ 30 s,共计40 个循环。已成功建立的 SARS-CoV-2 ORF1ab 基因、N 基因、E 基因以及 Omicron 变异株 S 基因四重微滴式定量ddPCR 检测方法可用于后续临床样品的检测。
2.4 多重ddPCR特异性验证
通过多重 ddPCR 反应扩增,4 种目标基因的质粒标准品均有效检出阳性微滴数。同时,选择猪流行性腹泻病毒、猪传染性胃肠炎病毒、甲型流感病毒、诺如病毒、腺病毒、轮状病毒、新型冠状病毒变异株(Beta 株、Gamma 株、Delta 株)作为特异性实验验证均未发生非特异性扩增,表明4 组引物探针特异性良好,未与其他感染症状与新冠病毒类似的病原体发生交叉反应,四重 ddPCR 特异性扩增图见图3。
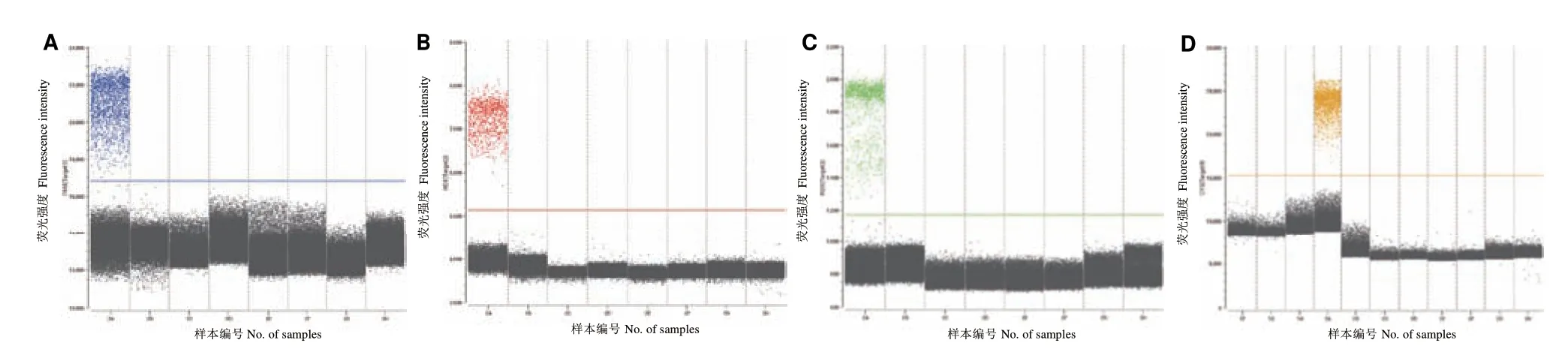
图3 四重ddPCR 特异性检测一维图Fig.3 One-dimensional map of specificity detected by quadruple ddPCR
2.5 多重ddPCR灵敏度与稳定性
将4 种阳性质粒标准品混合后,进行连续10 倍梯度稀释,选取6 个梯度样本并重复3 次实验,以确定反应体系的灵敏度和稳定性。四重 ddPCR 灵敏度与重复性检测结果如表2。由表2 可知,四重微滴式数字 PCR 检测SARS-CoV-2 的绝对定量检测下限分别为ORF1ab 基因0.59 copies/μL,RSD 为20.89%;N 基因0.68 copies/μL,RSD 为25.07%;E基 因1.44 copies/μL,RSD 为12.08%;S 基 因1.03 copies/μL,RSD 为20.20%。四重微滴数字 PCR 灵敏度检测一维图见图4。
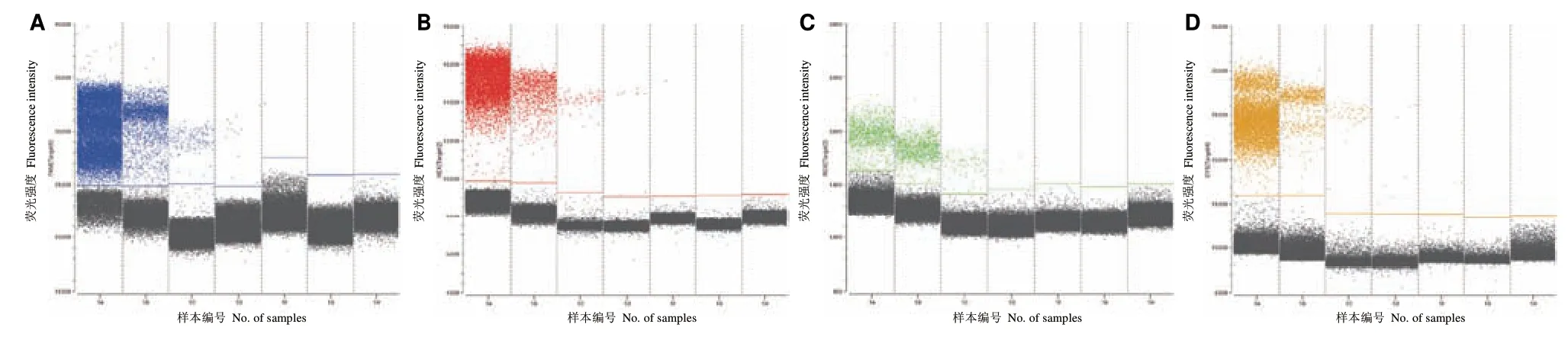
图4 四重 ddPCR 灵敏度检测一维图Fig.4 One-dimensional map of sensitivity detected by quadruple ddPCR
以体系中10-6-10-105 个连续稀释的阳性质粒DNA 模板稀释倍数为横坐标,与之对应 ddPCR 检测拷贝数结果的对数值为纵坐标绘制线性关系拟合曲线。如图5 所示,SARS-CoV-2 ORF1ab 基因 R2为0.999,N 基因 R2为0.999,S 基因 R2为0.988,ORF1ab 基因 R2为0.997,结果呈现良好的线性关系,本实验建立的多重 ddPCR 方法适用于对微量新冠病毒的拷贝数准确定量检测。
2.6 临床鼻咽拭子样本的检测结果
使用核酸提取纯化试剂盒(磁珠法)提取20 份样本的病毒核酸(每份样本200 μL),四重微滴式数字 PCR 方法检测结果见表3,新型冠状病毒 2019-nCoV 核酸检测试剂盒(荧光定量 PCR 法)检测结果见表4,试剂盒结果判定标准只需满足在同一份标本中 SARS-CoV-2 的 ORF1ab 基因为阳性,N 基因及E 基因任一靶标为阳性即为该样本 SARS-CoV-2阳性。检测结果显示,在20 份临床样本中,ddPCR方法检出阳性样本16 个,阳性率达80%(16/20),经荧光定量 PCR 方法进行复检验证结果一致,表明该多重 ddPCR 方法能够在临床中应用。
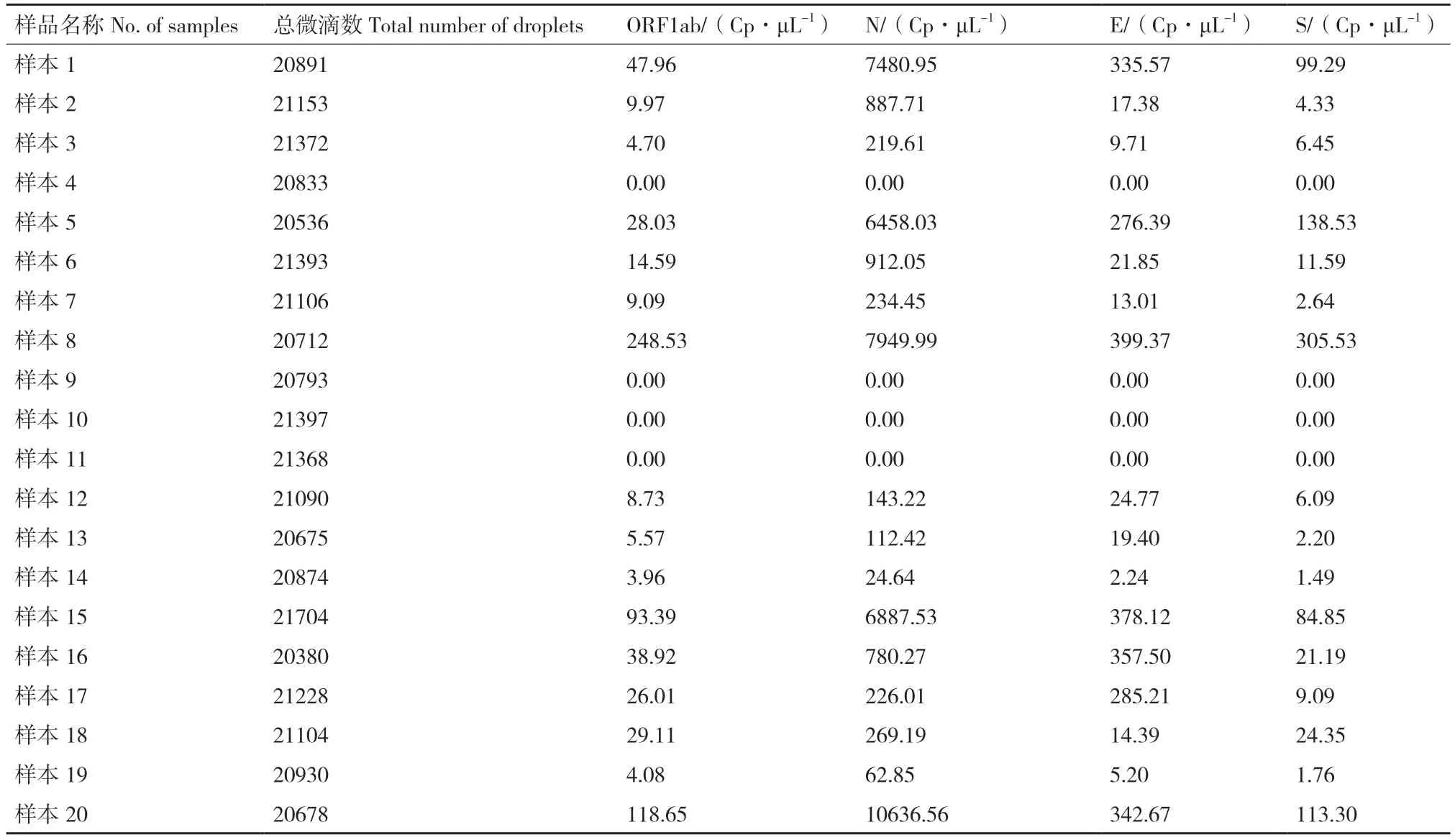
表3 20 份样本多重微滴数字 PCR 拷贝数检测结果Table 3 Copy number detection results for 20 samples by quadruple ddPCR

表4 20 份样本荧光定量 PCR 检测结果Table 4 Results of 20 samples via fluorescence quantitative PCR
3 讨论
自2021 年11 月9 日 Omicron 变异株于南非首次检出后[19],短时间内成为主要优势毒株并在全世界范围内高度传播。Omicron 变异株 S 基因存在大量突变位点,这些突变位点增加了受体结合域和 ACE2的结合亲和力,从而增强了病毒适应性和感染性[20]。此外,某些突变和重组对病毒生物学特性造成影响,有研究表明,Omicron 携带的突变位点有助于逃避多种单克隆抗体的中和作用,对自然和疫苗诱导的免疫效果产生影响,免疫保护作用下降导致突破性感染和再次感染[21],在当前 SARS-CoV-2 还未完全消失的情况下,需密切重点监测和防范 Omicron 变异株。
国内外开展了大量关于 SARS-CoV-2 检测方法的研究,其中实时荧光定量 PCR 被认为是诊断新冠病毒感染的“金标准”。Chu 等[22]针对 SARS-CoV-2 ORF1ab 基因和 N 基因建立了一种一步法逆转录PCR 对感染患者呼吸道样本进行检测。Corman 等[23]建立了 SARS-CoV-2 三重 qPCR 检测方法,其中 E基因显现较高灵敏度测试结果(5.2 copies/reaction),但该方法在临床样本中的阳性检出率仅为28.2%。此外,胶体金免疫层析基于抗原抗体特异性结合和显色原理使检测结果可视化,15 min 内可通过诊断试纸条显色判断阴阳性,但已有研究表明该方法敏感性低于 qPCR 检测结果[24]。SARS-CoV-2 存在潜伏期,患者感染初期常因病毒载量过低出现“假阴性”问题,而本研究建立的多重 ddPCR 方法特异性强、灵敏度高,无需依赖标准曲线便可实现对患者样本病毒拷贝数的精确定量,反应体系在精密注射泵的作用下匀速从微型注射器流出,单个液滴体积稳定控制在0.8 nL,不受反应液成分、温度、气压等因素影响,通过多通道荧光成像检测分析,一次性完成液滴扫描拍照,无信号降解,更具高效、便捷、稳定等特点,第一时间准确诊断,对患者得到及时救治至关重要。
ddPCR 作为新兴的检测技术,仍存在一些固有局限与不足。待测反应体系配置好之后需开盖放入ddPCR 仪器中,微液滴在开放式空间内吸取和转移,非专业实验人员操作不当可能会导致样本挥发和溢出,造成气溶胶污染,为保证数据准确度,实验检测环境应确保较好的负压条件,仪器运行结束后及时处理废弃耗材,保持区域清洁减少污染。ddPCR检测结果区间有效动态范围小,表现出低于 qPCR的饱和极限,过低的上样量将降低 ddPCR 的灵敏度,过高的上样量将导致单液滴内样本拷贝数过多,超过检测上限。Cremonesi 等[25]研究指出 DNA 样本必须在反应混合物中稀释到 <20 000 拷贝值,才可量化参考样本中密集分布的阳性微滴。因此,可先使用标准样品在 qPCR 系统中摸索出合适模板 DNA 浓度,确保 ddPCR 定量结果的准确性。对于本实验建立的多重 ddPCR 方法还可从 SARS-CoV-2 Omicron 变异株新的进化分支细化研究,及时监测并精确定量Omicron 亚变体,以应对未来 SARS-CoV-2 未知变种。
4 结论
本研究根据新冠病毒原型株及变异株基因组参考序列,设计特异性引物探针,通过优化多重ddPCR 反应体系和扩增条件,最终建立了SARSCoV-2 ORF1ab 基因、N 基因、E 基因以及 Omicron变异株 S 基因四重微滴数式数字 PCR 定量检测方法,其中 ORF1ab 基因的绝对定量检测下限为0.59 copies/μL,N 基因的绝对定量检测下限为0.68 copies/μL,E 基因的绝对定量检测下限为1.44 copies/μL,S 基因的绝对定量检测下限为1.03 copies/μL。该检测方法特异性强、灵敏度高,用于临床样本中能够对微量新冠病毒准确快速检出,有利于维护公共卫生安全。
致谢
特别感谢四川国际旅行卫生保健中心(口岸疫病疫情监测四川省重点实验室)对本实验的支持和帮助。
