超声对豌豆蛋白-高酯果胶复合颗粒理化和结构特性的影响
2024-03-12马开元孙晓洋陈复生张丽芬
马开元,孙晓洋,陈复生,张丽芬*
(1 河南工业大学粮油食品学院 郑州450001 2 河南牧业经济学院 食品与生物工程学院 郑州 450046)
豌豆蛋白(Pea protein,PP)作为重要的植物蛋白来源之一,因易获得,营养价值高和低致敏性而被广泛接受。然而,豌豆蛋白的电荷量较低且表面疏水性较强,降低了其溶解性和乳化性,尤其在豌豆蛋白等电点附近蛋白质容易发生聚集,阻碍了其在食品领域中的应用[1]。例如,豌豆蛋白在植物蛋白饮料中应用时乳化稳定性不佳,体系通常出现失稳现象[2]。研究表明,多糖可以诱导自身与蛋白分子间的相互作用,对加工食品的结构和稳定性中起增稠、稳定、胶凝和乳化的作用[3]。蛋白和多糖复合颗粒具有较好的生物可降解性和兼容性,在提高生物活性成分稳定性和利用度方面发挥着重要作用,是生物活性物质良好的输送载体[4]。蛋白-多糖复合颗粒基乳液的稳定性较好,在食品乳液体系中具有广泛的应用前景[5]。高甲氧基果胶(High methoxyl pectin,HMP)是从苹果中提取的一种天然阴离子多糖,是食品体系中最常用的多糖稳定剂之一,HMP 可与蛋白质发生相互作用,增强蛋白的空间结构并减少其絮凝和沉淀[6]。Tian 等[7]研究发现β-伴大豆球蛋白与果胶通过静电作用形成的可溶性复合物的粒径较小,Zeta-电位绝对值较高,使得该复合物具有更高的吸附动力学,可显著提高蛋白的乳化稳定性。Albano 等[8]研究发现,大豆分离蛋白和果胶起乳化剂和稳定剂的作用,果胶的加入不但可提高液滴表面电荷,而且增加了液滴间的静电排斥和空间位阻效应,有效防止液滴絮凝和部分聚集,使蛋白乳液稳定性显著改善。
超声波因具有快速、有效的改性效果且不损失营养物质以及无毒、无害等优点,受到越来越多科研工作者的青睐[9-10]。研究表明,利用超声制备蛋白-多糖复合颗粒,可改善复合物的功能性质,超声波的空化效应可减小复合颗粒的尺寸,使粒径分布更加均一,使粒子形态更规则[11-12]。本研究以PP 和HMP 分别作为蛋白、多糖基质,利用超声制备复合颗粒,通过对PP-HMP 复合颗粒乳化特性、浊度、粒径、多分散性指数(Polydispersity index,PDI)以及结构特征进行分析,揭示超声作用下复合颗粒理化和结构特性的变化规律,为扩大豌豆蛋白在食品加工中的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
市售豌豆蛋白(蛋白含量为81.2%),双塔食品贸易有限公司;高酯果胶(酯化度55%~65%),上海Macklin 公司;金龙鱼大豆油,益海(周口)粮油工业有限公司;无水乙醇、光谱纯级溴化钾(KBr)、氢氧化钠(NaOH),天津市科密欧化学试剂有限公司;盐酸(HCl),洛阳昊华化学试剂有限公司;除标注外,试验所用试剂均为分析纯级。
1.2 仪器与设备
SCIENTZ-IID 型超声波破碎仪、DC-2030 低温恒温槽,宁波新芝生物科技股份有限公司;BT-纳米粒度仪(Zeta 电位分析仪),丹东百特仪器有限公司;722S 可见分光光度计,上海仪电公司;FM200 高速剪切分散乳化机,上海弗鲁克科技发展有限公司;IRAffinity-1S 傅里叶变换红外光谱仪,日本岛津株式会社;Cary Eclipse 荧光光谱仪,安捷伦科技(中国)有限公司;HT7700 透射电子显微镜,日立(中国)有限公司。
1.3 试验方法
1.3.1 PP-HMP 复合体系的制备 称取适量的PP 和HMP,分别使用蒸馏水配置成质量浓度为8 mg/mL 的蛋白和果胶溶液,室温下置于磁力搅拌器匀速搅拌过夜,使颗粒充分溶胀。
将所制备的PP 和HMP 溶液以体积比1∶1 进行混合,搅拌均匀后用0.1 mol/L HCl 和NaOH 溶液调节溶液的pH 值为6.0,然后置于磁力搅拌器上搅拌4 h。
1.3.2 超声制备PP-US、PP-HMP-US 复合颗粒将PP-US、PP-HMP 混合溶液倒入超声杯中水浴,超声探头浸入液面以下1.5 cm 处,工作时间2 s,间隔时间2 s,使用不同超声时间、功率密度和温度处理,超声后的PP、PP-HMP 表示为PP-US、PP-HMP-US。
1.3.3 理化特性分析
1.3.3.1 乳化活性和乳化稳定性 将5 mL 大豆油和10 mL 样品溶液在室温下用高速剪切机以13 000 r/min 的转速剪切2 min。快速在底部吸取50 μL 样品,用质量浓度为0.1 g/100 mL 的十二烷基硫酸钠(SDS)溶液稀释200 倍,混匀后立即测定波长500 nm 处的吸光值(A0)。静置40 min(t)后从底部同一部位吸取样品,用同样的方法测定吸光值(A40)[13]。乳化活性(EAI)和乳化稳定性(ESI)分别按式(1)和(2)计算。
式中,EAI——乳化活性指数,m2/g;ESI——乳化稳定性,min;A0——乳液放置0 min 的吸光度;A40——乳液放置40 min 后的吸光度;t——间隔时间,40 min;c——复合颗粒质量浓度,g/mL;φ——油相体积分数,%;T=2.303。
1.3.3.2 浊度的测定 参考Yi 等[14]的方法,采用分光光度法进行样品的浊度测定。在常温下用分光光度计于波长600 nm 处测定样品的吸光度值,每个样品重复测定3 次。
1.3.3.3 粒径、PDI 以及Zeta 电位的测定 复合颗粒的粒径及其分布、PDI 和Zeta 电位使用纳米粒度仪进行测定。颗粒分散液用蒸馏水稀释到适当的浓度后,取适量样液进行测定。所有测定均在25 ℃下进行,平衡120 s,每个样品重复测定3 次。
1.3.4 结构特性研究
1.3.4.1 二级结构 参考Feng 等[15]的方法,将PP、PP-US、PP-HMP、PP-HMP-US 溶液进行冷冻干燥,取冻干后的样品2 mg 左右,与100 mg 烘干后的溴化钾研磨混匀,然后使用压片机压制成薄片,再用傅里叶红外光谱仪扫描分析,测定时波数范围为4 000~400 cm-1,扫描次数为32 次,分辨率4 cm-1,得到的红外吸收曲线采用Peakfit 软件和Gaussian 拟合,分析蛋白二级结构含量的变化。
1.3.4.2 三级结构 将复合溶液稀释至合适浓度,使用荧光分光光度计进行测定,固定激发波长λex为280 nm,激发和发射狭缝宽度都为5 nm,扫描范围为300~500 nm。
1.3.4.3 微观形态 采用透射电子显微镜(TEM)对新鲜制备复合颗粒的表面形貌进行测定。对复合颗粒进行适当稀释,取一滴样液加到覆有聚乙烯醇缩甲醛脂膜的铜网上,水平放置2~3 min,用滤纸吸去表面多余溶液,再滴加一滴2%磷钨酸溶液对颗粒进行负染2 min,然后将铜网在滤纸上放置2 min 使充分染色并吸取多余的染液,置于红外灯下干燥后用透射电子显微镜观察并拍照。
1.3.5 数据统计分析 每个试验重复3 次,试验结果以3 个测量值的平均值 标准差()表示。采用SPSS Statistics 26.0 软件Duncan 检验法对数值进行差异显著性分析(P<0.05),采用Origin 8.0 软件作图。
2 结果与分析
2.1 超声对PP-HMP-US 复合颗粒乳化性的影响
超声对PP-HMP-US 复合颗粒乳化性的影响如图1 所示。PP 和超声豌豆蛋白(PP-US)的乳化稳定性较差。当HMP 溶液加入PP 后,PP 与HMP结合形成可溶性复合物。HMP 的静电斥力和空间位阻抑制蛋白的聚集,减少絮凝的产生并提高乳化稳定性[18]。与PP-HMP 相比,超声作用于PPHMP 复合颗粒时,产生的空化效应和微射流使分子结构发生改变,促使吸附在油水界面的蛋白分子增多,并且增强了界面膜的刚性,提高PPHMP-US 的乳化活性[19]。

图1 超声对PP-HMP-US 乳化活性和稳定性的影响Fig. 1 Effects of ultrasound on emulsifying activity and stability of PP-HMP-US
随着超声时间的延长,PP-HMP-US 复合颗粒的乳化活性先增大后减小,在10 min 时达到最大;随着超声温度和功率密度的增强,PP-HMPUS 复合颗粒的乳化活性在15 ℃和5.43 W/cm3时达到最大后趋于平稳。复合颗粒的乳化稳定性随着超声时间、功率密度与温度的增加出现降低的趋势。随着超声作用的增强HMP 逐渐被降解,产生的静电斥力和空间位阻效应减弱,影响颗粒运动速度和疏水基团的暴露,导致乳液稳定性降低[16]。
2.2 超声对PP-HMP-US 复合颗粒理化特性的影响
2.2.1 浊度 图2 表示超声对PP-HMP-US 复合颗粒浊度的影响。图2a 中,PP 和PP-US 均有明显的相分离现象,浊度较高,放置一段时间后出现沉淀。当HMP 加入后,由于PP 和HMP 之间通过相互作用发生络合,形成的PP-HMP 复合颗粒表现出较高的稳定性,浊度显著降低,并且没有出现相分离现象。超声作用于PP-HMP 复合颗粒,显著降低了复合颗粒的浊度。由于超声处理后非聚集蛋白质的结构改变,获得了较小复合物颗粒尺寸,有助于增加可用于光散射的表面积,从而降低浊度[20]。

图2 超声对PP-HMP-US 浊度的影响Fig. 2 Effects of ultrasound on turbidity of PP-HMP-US
如图2b 和2c 所示,随着超声时间从5 min 延长至35 min,PP-HMP-US 复合颗粒的浊度从0.423 降至0.343,随着超声功率密度增大至5.43 W/cm3,复合颗粒的浊度逐渐降低达到最小值后趋于平稳。从图2d 可知,与其它温度相比,超声温度25 ℃时,复合颗粒浊度较高。
2.2.2 粒径和PDI 表1 表示了超声处理对PP和PP-HMP 复合颗粒的粒径和PDI 的影响,PP 的平均粒径为(15 702.12±1 465.45)nm,PP 经超声后的粒径显著减小至(4 395.81±214.17)nm,超声处理对PP 的PDI 无显著影响。与PP 相比,PP-HMP复合颗粒具有较小的粒径和较窄的分布,表明HMP 的加入抑制蛋白聚集,并与PP 颗粒形成可溶复合物[15]。超声处理后,PP-HMP-US 复合颗粒粒径和PDI 均降低。超声的空化效应产生的湍流和剪切力破坏颗粒分子间的非共价键,打开了水溶液中颗粒内部紧密堆积的结构,导致蛋白质聚集体解离,复合物的粒径显著减小[21]。

表1 超声对PP-HMP-US 粒径、PDI、Zeta 电位的影响Table 1 Effects of ultrasound on particle size,PDI and Zeta potential of PP-HMP-US
随着超声时间的延长,PP-HMP-US 复合颗粒的粒径和PDI 逐渐减小;在超声温度为5~45 ℃范围内,复合颗粒的粒径及PDI 没有显著变化;超声功率密度从1.36 W/cm3增加至5.43 W/cm3时,复合颗粒的粒径显著减小,分布更加均匀,超声功率进一步增大,复合颗粒的粒径和PDI 均增大,说明过高的功率会导致小颗粒聚集,增加复合颗粒在分散体系中的粒径。因此,超声作用可以使复合颗粒获得较小粒径,且粒径分布更集中,在水相体系中具有较高稳定性。
2.2.3 Zeta 电位 Zeta 电位的大小表明胶体系统中相邻粒子之间的静电吸引或排斥程度,是分散体稳定性的关键指标。表1 显示了超声对PPHMP-US 复合颗粒Zeta 电位的影响。PP 在超声处理前、后的Zeta 电位没有显著差异;当HMP 加入后,带负电的HMP 与PP 发生结合形成的静电复合物带有更多负电荷,从而使PP-HMP 复合颗粒的电位绝对值增大。PP 与HMP 之间的相互作用提高了分散体的稳定性,改善复合颗粒乳化性能[16]。PP-HMP 复合颗粒经超声后电位绝对值升高。超声影响HMP 表面电荷的数量和分布,同时超声的空化效应可以使PP 分子展开并破坏蛋白质聚集体,从而改变PP 表面的净电荷[22],影响PP-HMP-US 的电位绝对值。
超声处理10 min 时PP-HMP-US 复合颗粒电位绝对值较大为(39.54±2.02)mV,表明短时间超声可获得更稳定的分散体系。然而,随着超声时间的继续延长,复合颗粒电位的绝对值逐渐降低。超声温度和功率密度分别为15 ℃和4.07 W/cm3时,PP-HMP 电位绝对值较大分别为(33.13±2.37)mV和(35.32±1.10)mV。
2.3 超声对PP-HMP-US 复合颗粒结构特性的影响
2.3.1 二级结构 图3 为PP-HMP-US 的FTIR图谱。与PP 相比,PP-HMP 复合颗粒的光谱中酰胺Ⅱ带吸收峰出现红移,并在1 020~1 103 cm-1和1 745 cm-1处出现新的吸收峰,这两处新的吸收峰是由半乳糖醛酸(GalA)羧基形成的酯键(-COOR)在此波段的特异吸收[23],1 020~1 103 cm-1处吸收峰是由羧基形成的-COOR(C-O)和-COO-伸缩振动引起,是HMP 中的GalA 在指纹区(1 473~1 000 cm-1)的特征吸收峰[24],与单独PP 相比,PPHMP 复合颗粒在-OH 伸缩振动区(3 200~3 420 cm-1)的吸收带蓝移(3 294 cm-1到3 279 cm-1),在CH 伸缩振动区(2 700~3 000 cm-1)的吸收带出现红移(2 928 cm-1到2 930 cm-1),表明复合颗粒中PP和HMP 之间的相互作用可能与氢键的形成和CH 的拉伸有关。从图谱可以看出,超声后PPHMP-US 复合颗粒的红外光谱强度减弱,酰胺Ⅱ带、酰胺Ⅲ带吸收峰以及-OH 伸缩振动区域发生轻微红移,说明氨基酸环境向更加亲水的环境转移[25]。

图3 超声前、后PP 和PP-HMP 复合颗粒的傅里叶红外光谱图Fig. 3 FTIR spectra of PP and PP-HMP composite particles before and after ultrasound
通过对酰胺I 带进行傅里叶去卷积结合Gaussian 拟合,得到蛋白质二级结构的定量信息(如表2 所示)。与PP 相比,PP-HMP 复合颗粒的β-转角和α-螺旋相对含量增大,β-折叠和无规卷曲相对含量减少,表明HMP 能够抑制PP 的聚集,使PP 的有序结构增加[26]。从表中可以看出,超声处理使PP-HMP-US 复合颗粒中的β-折叠展开形成α-螺旋,说明超声的空化作用会导致二级结构相对含量发生变化,而蛋白质的二级结构折叠形成线状或螺旋螺旋会影响蛋白质的空间构象[27]。超声时间对复合颗粒的α-螺旋和无规卷曲含量影响不显著,随着超声时间的延长,PP-HMP-US复合颗粒的β-折叠含量减小,β-转角含量增大,说明长时间的超声处理会破坏β-折叠片中的氢键,使多肽链反转形成β-转角,进而导致复合颗粒的结构松散,乳化活性和稳定性降低。当超声功率密度增大至5.43 W/cm3时,PP-HMP-US 复合颗粒β-转角逐渐向α-螺旋和β-折叠转变,表明适当的超声功率密度可促进PP 和HMP 分子间的分子间相互作用,进而增强蛋白质的柔性结构,更易于形成界面吸附,提高复合颗粒的乳化活性。随着超声温度的增大,复合颗粒无规则卷曲的相对含量增多,过高的超声温度使复合颗粒形成更多无序的分子结构。2.3.2 三级结构 蛋白质的内源性荧光主要由色氨酸(Trp)和酪氨酸(Tyr)残基提供,是蛋白质三级结构变化的重要指标。图4 显示了超声对PP 及PP-HMP 复合颗粒内源荧光光谱的影响。与PP 的内源荧光最大发射波长λmax(335 nm)相比,PP-US的λmax(333 nm)发生蓝移,而且荧光强度显著降低,这可能是由于超声产生的空化效应导致蛋白质分子暴露的Try 等发色团被猝灭[28]。添加HMP后,PP-HMP 复合颗粒的荧光强度降低且λmax(333 nm)发生蓝移,复合物的形成改变了Trp 残基的微环境,表明PP 和HMP 之间的疏水相互作用参与了复合物的形成,降低了蛋白分子中Try 残基的暴露程度,使其形成了更紧密的三级构象[29]。超声处理后,PP-HMP-US 复合颗粒的荧光强度进一步降低,λmax发生红移,表明超声影响Try 等发色团的极性微环境,超声处理时空化泡的瞬间坍塌会造成局部升温和空化作用,促进PP 和HMP 分子的结合,进一步降低Try 发色基团的暴露程度,导致蛋白的三级结构发生变化[30]。

表2 超声对PP-HMP-US 二级结构相对含量的影响Table 2 Effects of ultrasound on the relative content of secondary structure of PP-HMP-US
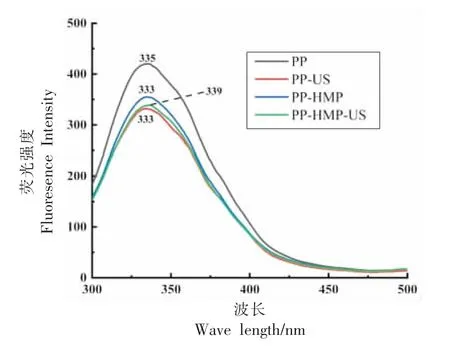
图4 超声前、后PP 与PP-HMP 的荧光光谱Fig. 4 Fluorescence spectra of PP and PP-HMP before and after ultrasound
2.3.3 微观结构 利用TEM 观察复合颗粒时,PP显色较深,而亲水性多糖HMP 会显色较浅。从图5a 和5b 可知,单独PP(黑色部分)呈现出球状结构。PP-HMP 复合颗粒如图5c 所示,黑色部分为PP 内核,浅灰色部分为HMP 外层,而两者之间交联的灰色部分可能是由于糖链段因其较柔软和灵活在样品制备时发生脱水聚集作用[31]。将PP-HMP复合颗粒进一步超声(图5d),超声的空化作用产生了巨大的剪切力和压强,使得粒子间发生猛烈地撞击,不断地撞击使原先伸展在粒子表面的不规则的蛋白结构发生断裂[32],促进HMP 和PP 的结合,HMP 嵌入PP 的球状结构中,形成了规则有序的类似毛线团的结构。

图5 PP、P-US、PP-HMP、PP-HMP-US 的透射电镜图Fig. 5 Transmission electron micrographs of PP,PP-US,PP-HMP,PP-HMP-US
3 结论
本文以豌豆蛋白和高酯果胶作为蛋白和多糖基质,研究超声对PP-HMP-US 复合颗粒理化和结构特性的影响。结果表明:PP 颗粒不稳定,HMP可以抑制蛋白聚集,降低PP 的浊度、粒径和PDI,增大其Zeta-电位绝对值,使PP-HMP 复合颗粒的乳化活性和稳定性显著增强;超声作用于复合颗粒,可以增强分子之间的相互作用,使PP-HMPUS 复合颗粒的浊度、粒径和PDI 显著降低,Zeta-电位绝对值增大,并在超声10 min、5.43 W/cm3、15℃时得到较高乳化活性和稳定性。通过对PPHMP 复合颗粒的结构分析,结果发现HMP 的添加使PP 的有序结构增加,超声使PP-HMP-US 复合颗粒的β-折叠展开形成α-螺旋,同时促进PP和HMP 的结合,使Try 基团的暴露程度降低;而超声时间过长或温度过高均会使分子结构变得松散无序,导致复合颗粒乳化活性和稳定性下降。TEM 结果表明,超声促使HMP 嵌入PP 球状结构中,形成更加规则有序的结构,研究结果为豌豆蛋白在食品加工中的应用提供理论基础。
