蛋白质与多酚的互作机制及其应用
2024-03-12王远利康心蕊王紫琳
王远利,康心蕊,陶 亮,*,张 权,王紫琳,田 洋
(1 云南农业大学食品科学技术学院 昆明650000 2 食药同源资源开发与利用教育部工程研究中心 昆明650000 3 云南省药食同源功能食品工程研究中心 昆明650000 4 云南省精准营养与个性化食品制造重点实验室 昆明 650000)
蛋白质是由20 种不同氨基酸相互连接而成的一种结构高度复杂的多聚体。作为生命活动的物质基础,蛋白质不仅是人体六大营养素之一,也是食品加工中的重要组成成分,广泛存在于奶制品、肉类、蛋类、谷物、豆类和油籽中[1]。多酚是植物产生的一种次生代谢产物,根据其碳架的结构,多酚可分酚酸类、单宁类以及黄酮类化合物[2]。研究表明,多酚具有抗炎、抗氧化、调节肠道菌群的能力,并具有抗癌、抗心血管疾病、抗肥胖、抗衰老、免疫调节等多种药理作用,是人类利用的天然植物化学物质的主要来源之一[3-4]。
在活体植物中,蛋白质和多酚以严格的分子结构和特定的细胞内腔形式存在,避免了相互作用的发生。然而,复杂的食品加工过程会对细胞组织造成损害,导致多酚穿过液泡边界与蛋白质(尤其是与位于细胞壁的蛋白质)结合。同时,由于破坏了细胞膜结构,细胞内的多酚将暴露在来自环境大气的氧气及其它氧化化合物中,进而产生一系列物化反应,使蛋白质、多酚在加工过程中出现新的结构并改变其生物功能[5],发生氧化、吸附、增溶、沉淀等现象,影响食物的感官和营养品质,如多酚与唾液蛋白相互作用导致红酒等饮品涩味的形成,单宁的存在使蛋白质的消化率下降,植物性饮料中添加蛋白质(沉淀单宁)可改善饮料稳定性和口感,与蛋白质形成的复合物可能通过掩盖酚类化合物的抗氧化特性,降低其功能性等[6]。
为了有效控制食品加工、流通过程中蛋白质和多酚的分子结构、功能及营养特性,指导富含蛋白质与多酚产品的开发与利用,突破二者应用场景的局限性,充分了解蛋白质与酚类物质的相互作用,本文综述蛋白质-多酚互作机制及其研究方法,功能特性及其潜在应用,为其在新型健康食品和生物医药等应用场景的高值化应用提供理论依据。
1 蛋白质-多酚互作机制
蛋白质与多酚的相互作用受其组成、含量及反应环境条件的影响,并进一步影响复合物的理化特性。一般来说与蛋白质作用最密切的多酚类化合物是具有分子质量大、结合位点多等特点的单宁酸;对蛋白质而言较松散的结构(精氨酸和脯氨酸含量高)以及较高的疏水性,可使其分子灵活度增大,空间位阻减小,有助于提高其与多酚的亲和力[7]。此外蛋白质、多酚在共存体系中相应的浓度、pH 值、温度、离子强度等也显著影响二者的相互作用及复合物结构,具体如图1 所示。两者间的相互作用力类型主要包括共价和非共价两个类型。有研究报道,随着周围条件的改变,这两种作用可以同时发生或从非共价相互作用转移到共价相互作用[8]。
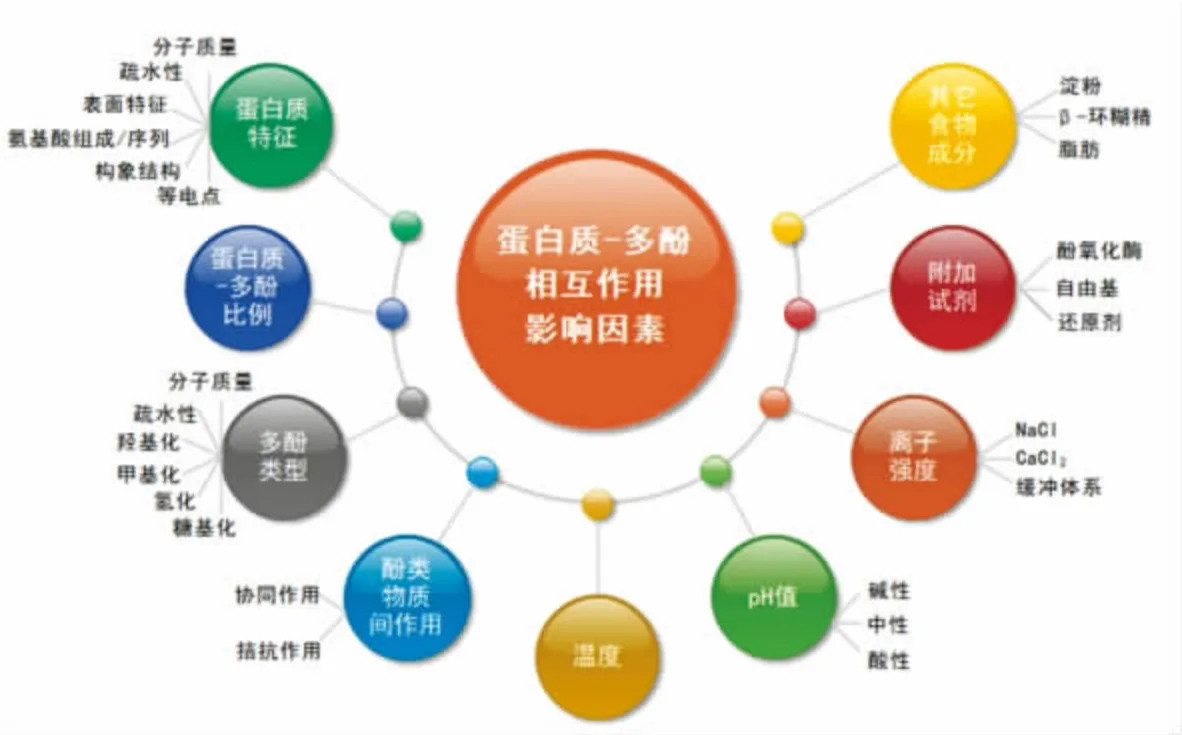
图1 蛋白质-多酚相互作用影响因素[8]Fig. 1 Factors affecting protein-polyphenol interactions[8]
1.1 机理
1.1.1 非共价相互作用 蛋白质-多酚复合物形成所涉及的非共价相互作用主要涉及范德华力、疏水、静电、氢键相互作用(图2),比共价相互作用弱1~2 个数量级。其中,疏水相互作用是主要作用力,发生在蛋白质疏水位点与多酚的非极性芳香环之间,如脯氨酸残基的吡咯环以及亮氨酸、赖氨酸或脯氨酸等氨基酸的非极性侧链[9]。氢键产生在蛋白质羰基的N、O 或S 原子等电负性原子与多酚羟基的氢原子之间[10],同时氢键的存在会促进疏水相互作用的提升[11]。Chanphai 等[12]研究表明,酪蛋白能够通过Phe23、Phe24、Phe28、Phe32、Val31 等氨基酸残基与儿茶素发生氢键及疏水相互作用。此外,蛋白质表面赖氨酸的ε-氨基基团和多酚羟基之间的静电相互作用,可能起到次要作用[5]。

图2 蛋白质-多酚相互作用类型Fig. 2 Types of protein-polyphenol interactions
Charlton 等[13]认为蛋白质与多酚的非共价作用分为3 个阶段。第1 阶段,疏水相互作用为主,多酚芳香环疏水面与蛋白质脯氨酸残基吡咯环上的多个作用位点可逆缔合形成小的可溶性配合物;第2 阶段,氢键为主,配合物交联缔合形成更大的不溶性复合物;第3 阶段,复合物聚集生成沉淀。
蛋白质-多酚间的非共价相互作用虽然具有可逆、低能量和不稳定的特点,但却在自然界中广泛存在,并在食品工业中扮演着重要角色,例如:在啤酒、红酒、茶等富含多酚的饮料中常存在浑浊现象,其最重要的原因之一就是蛋白质与多酚的非共价相互作用使复合物溶解度降低[11,14]。
1.1.2 共价相互作用 蛋白质与多酚间不可逆形式的共价作用主要包括共价键和离子键。多酚的双酚基活性较高,可经由酶促及分子氧氧化反应生成邻醌或半醌,并进一步与多肽的氨基或巯基侧链反应形成共价化合物[14]。蛋白质-多酚的共价结合主要有碱法、自由基接枝法、酶催化法3 种。碱法:在碱性(pH 9.0)及有氧条件下,多酚被氧化成半醌自由基,随后重新排列成醌。这些更具活性的亲电中间体易通过C-N 或C-S 共价键与蛋白质侧链中的亲核残基结合,生成稳定的复合物[15]。自由基接枝法:利用抗坏血酸和过氧化氢作为引发系统的氧化还原对,生成羟自由基,攻击特定蛋白质侧链基团(如氨基和巯基)的氢原子,产生中间产物。然后,这些中间体与酚环上羟基的邻位和对位发生反应,形成蛋白质-多酚复合物(蛋白质-X-多酚)[14]。酶催化法:一般是基于对邻苯二酚氧化酶、酪氨酸酶和过氧化物酶等酚氧化酶的利用[16],酚酶诱导多酚氧化成邻二酚,在氧气存在下,邻苯二酚酶(漆酶)将邻苯二酚转化为邻醌,醌很容易与蛋白质链中的亲核氨基酸残基发生相互作用,生成交联蛋白质或聚合物。对于食品工业而言,形成的共价键产物作用力强且稳定[17]。现根据上述内容绘制图2。
2 蛋白质与多酚相互作用表征方法
当前,结合常数、结合部位、作用力类型、构象变化等,是表征蛋白质-多酚相互作用的主要指标[18],然而由于蛋白质-多酚相互作用的复杂性,单一技术无法提供全面的信息,一般通过多种技术联合进行表征[11],主要包括光谱、热力学、微观结构、分子对接模拟等,并由此探究蛋白质与多酚的结合机制。本文对常见分析方法进行简单总结,如表1所示。
2.1 光谱法
荧光分析(包括荧光猝灭、同步荧光和三维荧光)是一种提供分子微环境信息的有用技术,经常用于蛋白质-多酚相互作用和结合亲和力的研究。蛋白质在240~280 nm 激发时,由于芳香氨基酸的存在,将在340~350 nm 范围内诱导荧光发射,而蛋白质与猝灭分子的结合将引起荧光强度的降低[24]。结合Stern-Volmer、双对数曲线等方程进一步分析猝灭数据将获得猝灭常数、结合亲和力和结合位点等信息[19,25]。基于此,荧光猝灭法已经被广泛用于研究包括葛根素-牛血清蛋白、花青素-溶菌酶在内的多种蛋白质-酚类化合物相互作用的结合常数,同时,基于测定不同温度下[25-26]的荧光猝灭试验表明,在较高温度下亲和力下降是由疏水作用力介导的熵增、焓增过程,亲和力下降则是典型的氢键介导的熵减、焓减过程。同步荧光光谱通过在固定间隔波长下同步扫描激发波长和发射波长,可以得到色氨酸和酪氨酸微环境变化信息[17]。Dai 等[27-28]利用同步荧光光谱法分别对大米谷蛋白-原花青素、没食子酸复合物进行了表征。三维荧光光谱峰a 用于表征酪氨酸和色氨酸残基的微环境,峰b 则表征蛋白质的多肽链骨架[17]。Al-Shabib 等[29]采用三维荧光光谱法对芦丁和β-乳球蛋白结合的分子行为进行了研究。

紫外-可见光谱法是通过吸收带的位移或荧光强度变化,判断蛋白质的结构变化和复合物形成的方法。其中,蛋白质200 nm 处的吸收光谱可反映蛋白质多肽链主链结构信息,280 nm 处反映芳香族氨基酸情况[30]。Wang 等[31]研究发现玉米醇溶蛋白-阿魏酸复合物在CaCl2溶液中,随CaCl2浓度上升,吸收带蓝移,峰值上升,作者认为钙离子的加入诱导了发色团局部环境极性的修饰和蛋白质的构象变化。
圆二色谱(CD)和傅里叶红外光谱(FTIR)可对由酚类化合物的作用引起的蛋白质二、三级结构的变化进行表征。CD 远紫外区(185~245 nm)是肽键的吸收峰范围,反映蛋白质主链的构象。近紫外区(245~320 nm)表征中,蛋白质的圆二色性主要受偶极取向、芳香族氨基酸、半胱氨酸(或SS 二硫键)残基对偏振光的吸收以及环境因素的影响,反映蛋白质三级结构的变化[18-19]。FTIR 光谱特征吸收带主要有Ⅰ、Ⅱ、III 带,酰胺Ⅰ带的长度约为1 700~1 600 cm-1,是肽链中最常见的振动,主要由C=O 伸缩振动(约占80%)以及CN 伸缩和NH 弯曲振动(约占20%)引起。同CD 一样,能给出蛋白质的α-螺旋、β-折叠、β-转角和无规卷曲等多种结构信息,而在生理条件下,1 645~1 640 cm-1左右水弯曲模式的强烈吸收,与随机线圈和α-螺旋带分量重叠,使其应用受到限制。酰胺Ⅱ带(1 600~1 500 cm-1)则由C-N 拉伸和N-H 弯曲引起。然而,该条带受到与氨基酸侧链的其它特征条带重叠的强烈影响,如酪氨酸、天冬酰胺和谷氨酰胺。酰胺III 带((1 310~1 175 cm-1)主要与CN 伸展和NH 弯曲振动(各占30%)、CC 伸展(20%)和CH 弯曲(占10%)有关。虽然酰胺III 带的强度较低,约比酰胺I 低5 倍,但它对蛋白质的二级结构也非常敏感,而且不受吸水率的影响[20,32]。上述两种方法都可以得到蛋白质二级结构元素比例的定量变化,区别在于,圆二色谱适合测定液体样品的α-螺旋结构,而傅里叶变换红外光谱适合检测固体和β-折叠[33]。部分研究同时采用这两种方法分析了甘氨酸[34]、溶菌酶[35]、大豆[36]蛋白与花青素、β-乳球蛋白[37]与绿原酸、阿魏酸、EGCG 形成复合物后二级结构的变化。
2.2 热力学法
等温滴定热量法(ITC)通过检测蛋白质与多酚相互作用过程中引起的热量变化来检测结合平衡,不仅可以得到如反应结合常数、熵变、晗变、比热容以及化学计量数的信息,还能透过热力学数据定性定量表征多酚与蛋白质之间的相互作用及结构变化[19]。Zhan 等[38]通过等温滴定量热法研究单宁酸及酪氨酸钠结合的热力学行为,发现随着单宁酸的加入,酪氨酸钠的热稳定增加,自由能为负值,说明反应自发进行,负的焓值和熵值,证实结合过程是由氢键和静电力介导的焓驱动过程。另一方面,采用差示扫描量热法(DSC)可研究蛋白质-多酚复合物的热诱导行为,通过DSC 测定配体存在时蛋白质的热变性温度和展开焓的变化是表征配体结合效应的最有效方法之一[22]。Shreyada 等[39]采用差示扫描量热法对茶多酚-人血清蛋白复合物进行了研究,结果表明,EGCG 结合后,人血清蛋白质的热变性温度升高,焓值下降,说明EGCG 与蛋白质的结合提高了蛋白质的热稳定性。
2.3 显微法
扫描电子显微镜(SEM)、透射电子显微镜(TEM)和原子力显微镜(AFM)是3 种常用的显微镜方法,可用于分析蛋白质-多酚复合物的微观结构。通过扫描电镜可以得到复合物微观形貌、表面组成分布、发光式样结构缺陷等信息[19]。Zhao 等[40]利用扫描电镜观察了多酚对酪蛋白粒子的影响,结果表明,酪蛋白-单宁酸(CS-T)结构致密,而酪蛋白-没食子酸(CS-G)结构疏松,且与单一多酚相比,混合多酚(CS-T-G)的加入表现出更明显的网状纤维结构,进一步采用原子力显微镜对其进行分析,发现CS-T、CS-G、CS-T-G 的微观结构表面粗糙,分子肿胀,高度明显增加,这可能是由于分子间的疏水相互作用使蛋白质聚集所致。与原子力显微镜类似,透射电子显微镜也可用于分析蛋白质-多酚复合物的纳米级表面形貌,区别在于,原子力显微镜用于固体样品的分析,而透射电镜用于溶液中复合物结构分析[8]。Desquiret-Dumas等[41]通过透射电镜检测了添加白藜芦醇后牛奶蛋白的微观结构,发现复合物呈胶束状聚集体。
2.4 分子对接
分子对接是一种计算机模拟方法。通过分子对接可以得出蛋白质与多酚之间的结合自由能、结合位点、结合构象和相互作用力等,从理论上模拟相互作用的可行性和作用情况,可实现最真实的反应预测[19,42]。Zhong 等[43]利用分子对接模拟茶多酚/HP-β-CD 包合物与靶蛋白受体结合位点的位置和相互作用,结果表明二者的结合以氢键、疏水相互作用和离子键为主,其最佳结合能为-40.84 kJ/mol。如图3 所示,Yu 等[44]通过分子对接研究了儿茶素与牛血清蛋白的相互作用机制,结果表明儿茶素的C-3 位置在与蛋白质的结合中起着重要作用,其主要驱动力为氢键,且酯类儿茶素比非酯类儿茶素具有更高的结合亲和力。
2.5 其它方法
除上述方法外,随着技术和设备的不断发展,基于光谱法的核磁共振波谱、光散射以及质谱、色谱等方法也逐渐应用到此领域的研究。核磁共振波谱法可以获得蛋白质的聚集状态、动力学、稳定性的信息;动态光散射(DLS)可以短时间内得到形成的蛋白质-酚类复合物的动力学参数及粒径分布;X 射线小角散射可以用作研究生物大分子及其配合物包括形状、大小、内部结构和域组织在内的的低分配率结构并提供分子折叠和组装等过程的动力学信息;基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)可用于分析蛋白质-多酚缀合物的分子质量;电喷雾电离质谱(ESI-MS)可用于检测、表征和评价形成的非共价蛋白质-多酚复合物的稳定性;尺寸排阻色谱法(SEC)或凝胶渗透色谱法(GPC)通常用于评估蛋白质分子质量的变化和酚类物质诱导的可溶性聚集体的形成;通过反相高效液相色谱(RP-HPLC)结合紫外检测器,可以测定残留酚的含量以及生成的配合物的疏水/亲水特征;高效亲和层析法(HPAC)可以研究不同多酚结构与蛋白质的结合率;液相色谱-串联质谱(LC-MS/MS)可用于鉴定相关加合物的结合位点和化学结构等;单分子的超快动力学可用于研究蛋白质的折叠和扩散;荧光共振能量转移用于体内蛋白质相互作用构象动力学的监测[5,16,22]。
上述方法可以通过直接识别蛋白质多肽链上的特定结合位点,或间接检测两种反应物性质的变化来分析蛋白质-酚类复合物。根据试验目的,适当地结合这些方法,将有助于明确蛋白质-多酚相互作用。
3 蛋白质-多酚复合物对蛋白质功能特性的影响
蛋白质和多酚相互作用会影响分子中静电荷和分子的表面性质等[45],进而导致蛋白质溶解度、乳化性、热稳定性、凝胶性等功能的变化。
3.1 溶解性和热稳定性
3.1.1 溶解度 溶解度是蛋白质在各类基质中发挥功能特性的先决条件。多酚对蛋白质的溶解具有双重作用,这取决于系统的性质。如Jiang 等[46]研究绿原酸(CA)对乳清分离蛋白(WPI)和酪蛋白(CS)的影响,发现二者发生非共价结合后,溶解性得到了提高,这是因为CA 与蛋白质暴露的疏水性基团的结合降低了表面的疏水性,同时,作为CA 羧基的酚羟基进一步增强了蛋白质表面的亲水性,导致蛋白质溶解性的增加。然而,绿原酸在pH≥8.0 的条件下,将通过非酶氧化形成醌,从而使得溶菌酶溶解度下降[47]。Ma 等[48]研究发现中性条件下丝素蛋白的加入,将使缩合单宁抗溶性增强。因此,蛋白质-多酚复合物的溶解度受蛋白质、多酚类型、pH 值等因素的综合影响。
3.1.2 热稳定性 蛋白质与多酚相结合,引入分子间及分子内的作用力,改善蛋白质三级结构的稳定性,从而提高蛋白质的热稳定性[14]。如Zhang等[49]研究发现,绿豆蛋白与多酚相互作用后,随热处理温度的提高,配合物结构更加稳定,这说明多酚的结合提高了绿豆蛋白的热稳定性。近年来也有部分研究发现,蛋白质-多酚的结合将使热稳性下降,例如乳铁蛋白与多酚结合后,由于α-螺旋结构减少,使得蛋白质发生不可逆聚集并削弱了其热稳定性[50]。对于多酚与蛋白质热稳定性的影响,可能受蛋白种类、结合形式及周围环境等多种因素的共同作用。
3.2 乳化性
蛋白质作为一种典型的食品乳化剂,可以降低界面张力,在均质过程中促进液滴分裂,并在界面处形成稳定膜,从而减缓食品乳液絮凝、聚结、沉淀、脱油等现象的发生。然而由于某些蛋白质水溶性低、疏水性高、分子质量大以及静电斥力低,不利于稳定乳液的形成。近年来,已有大量研究表明亲水性多酚与蛋白质的结合可增加蛋白质的不规则卷曲,调节蛋白质表面亲水-疏水基团的平衡,优化吸附行为,同时抑制它们的自聚集倾向,从而提高乳化活性[51-52]。Zhang 等[49]使用碱法将绿豆蛋白与多酚偶联,由于多酚在蛋白质表面形成多层吸附膜,提高了蛋白质降低油水界面张力的能力,进而提高了蛋白质的乳化稳定性,然而多酚含量进一步增加时,其与球蛋白相互作用形成不溶性聚集体,从界面膜上解离,降低了界面膜的机械强度,进而降低复合乳液的乳化稳定性,在利用多酚提高蛋白乳化特性时需要考虑多酚的添加量。Chen 等[53]研究发现与单独的猪血浆蛋白水解物相比,氧化单宁酸(OTA)或氧化绿原酸(OCA)修饰的猪血浆蛋白水解物(PPPH)具有更高的乳化稳定性指数和更强的抗氧化活性,即PPPH-OTA 和PPPH-OCA 复合物可以作为高效的抗氧化剂和潜在的乳化剂在乳剂食品体系中应用。
3.3 胶凝性质
蛋白质的凝胶化是使食品具有理想质地的主要方法之一。蛋白质与多酚发生交联,将改善蛋白质的凝胶特性。如Staszewski 等[54]发现多酚可以促进蛋白质分子之间的结合,且随着茶多酚浓度的增加,β-乳球蛋白凝胶化程度及黏弹特性提高,凝胶温度降低,凝胶时间缩短,这一发现与Harbourne 等[55]的研究结果类似,在酸性牛奶中添加单宁酸可增加氢键的含量,进而改善蛋白质凝胶的流变学性质。Cao 等[56]研究发现绿原酸的存在虽然可以抑制蛋白质羰基的形成,但不能阻止氧化引起的巯基和胺基的损失,并因此增强了氧化在构建弹性凝胶网络中的积极作用。然而,过高浓度的绿原酸会破坏蛋白质结构,屏蔽活性官能团,从而阻止凝胶基质中有序蛋白网络的形成。这也是为什么富含酚的香料加工肉类往往表现出不同的质地特性的原因。当植物酚提物加入肉制品原料中,进一步被氧化产生醌类物质,与蛋白质中的电子密集基团发生反应,可使凝胶性能发生改变[57]。
3.4 其它性质
除上述性质外,蛋白质-多酚相互作用对蛋白质的发泡性、油水结合性、弹性、可塑性等功能性质的影响,也是科学家们关注的热点问题。Sui等[36]发现,花青素可增强大豆蛋白的起泡性及起泡稳定性。Ma 等[58]证实,绿茶可起到增强植物蛋白完整性、硬度、切割强度,减弱蛋白质黏结性、弹性、持水性、氮溶解指数的作用。蛋白质的这些功能性质与食品质量密切相关,下一步实际应用中应加强蛋白质及多酚生产、储运与应用时的稳态化研究,拓展其应用范围。
4 蛋白质-多酚复合物对其生物活性及食品感官特性的影响
4.1 蛋白质-多酚复合物对生物活性的影响
抗氧化活性是蛋白质多酚复合物的重要性质之一。研究表明,由于自由基链式反应受阻,蛋白质抗氧化活性将显著增强。Jiang 等[46]研究发现酪蛋白和乳清蛋白与绿原酸非共价结合后ABTS 自由基清除能力显著增强,且具有剂量依赖性。同样,EGCG-大豆多肽[38],甘草酚-豌豆多肽[59]也表现出类似的协同抗氧化现象。与之相反,有研究发现,蛋白质可以通过阻断酚类化合物的反应基团从而掩盖酚类化合物的抗氧化能力。Qie 等[60]的研究表明,β-乳球蛋白作用使EGCG 分子中活性羟基部分被占据,导致抗氧化活性下降,且随二者结合强度增强,下降更加明显。也有例外,根据Dai等[27]的研究,与大米蛋白的相互作用增强了原花青素的自由基清除和铁离子还原能力。上述研究的矛盾可能与复合物种类、作用力类型不同,以及用于测定抗氧化能力的方法不同有关。
消化性是蛋白质-多酚复合物的重要生物活性,了解蛋白质-多酚复合物形成对二者消化性的影响具有重要的营养学意义。研究表明,单宁酸可通过抑制蛋白酶对酪蛋白的水解,从而使蛋白质消化率下降[40];绿原酸与蛋白质结合,破坏必须氨基酸结构,抑制胰蛋白酶和胃蛋白酶活性,导致蛋白质消化率下降[61]。此外,豆荚多酚和菜豆蛋白形成难溶复合物,也可抑制蛋白质消化[62]。相反,添加咖啡酚[63]、绿原酸[48]、花青素[64]、儿茶素[65]可使大豆蛋白、酪蛋白以及花生蛋白消化性上升,这可能是由于酚类与蛋白质相互作用过程中,蛋白质结构展开,溶解性上升,与蛋白酶结合位点增多所致。另一方面,蛋白质对多酚的生物利用度也有双重影响。例如在面包制作前加入生咖啡酚可提高酚类化合物的可及性[66],而乳蛋白对水果酚、咖啡酚的生物利用度产生负面影响[67]。目前,二者相互作用对消化率及生物利用度的影响机制尚不明确,有待进一步研究。
除抗氧化性和消化性外,蛋白质-多酚相互作用对蛋白质致敏性、酚类物质的抗菌、抗癌、抗炎、抗肥胖以及抗糖尿病等生物活性也会产生影响。例如:有研究发现酚类化合物可能会通过降低lgE的结合能力、减轻肥大细胞/嗜碱性粒细胞脱粒以及促进过敏原的消化吸收来降低蛋白质食品的致敏性。蛋白质可能掩盖多酚的活性位点,降低多酚的抗菌性[8]。目前蛋白质-多酚相互作用对二者生物活性影响的作用机理尚不明确,还需进一步研究,这将对功能性食品和药品的开发利用产生积极影响。
4.2 蛋白质-多酚复合物对食品感官特性的影响

表2 蛋白质-多酚相互作用对食品感官特性的影响Table 2 Effects of protein-polyphenol interactions on food sensory properties
蛋白质-多酚相互作用会引起食品质构、颜色、口感等感官特性的改变,了解其对产品质量影响,分析其作用机制对高品质产品开发具有重要意义。以下重点归纳了已报道的常见蛋白质-多酚复合物对食品感官特性的影响。
5 蛋白质-多酚复合物的应用潜力
5.1 乳剂
蛋白质-多酚复合物因其优异的乳化性能和抗氧化活性,成为了潜在的食品乳液稳定剂。如Sui 等[36]研究发现,无论花青素与大豆蛋白之间存在何种相互作用,大豆蛋白的乳化能力指数、乳液稳定性指数、ζ 电位绝对值增加与花青素浓度呈正相关,即络合后大豆蛋白乳化性能提高,这一发现为花青素在植物饮料中的应用提供了理论依据。乳化活性的提高归因于改性蛋白表面疏水性的增加,而乳液稳定性的提高是由于复合物包覆液滴之间具有更强的斥力。Li 等[77]发现单宁酸的加入可以增加玉米醇溶蛋白水解物在油水界面上的吸附,并在油颗粒周围形成一个保护结构,由此提高水包油纳米乳液的乳化及氧化稳定性。形成更小的液滴与更强的排斥相互作用是乳液物理稳定性的重要因素,液滴表面的抗氧化多酚可进一步提高其化学稳定性,一些蛋白质-多酚复合物,如乳铁蛋白-绿原酸[78],已被证实可用作抗氧化乳剂,在水包油乳液模型中保留β-胡萝卜素。因此蛋白质-多酚复合物可作为乳化液食品中的抗氧化乳化剂。
5.2 薄膜
基于蛋白质薄膜的生物可降解、可再生和生态友好的特点,在开发替代食品包装材料方面受到了极大的关注[15]。如向日葵蛋白、花生蛋白、南瓜油饼蛋白、榛子粉蛋白和蓖麻豆饼蛋白等食品工业的副产品已被研究作为生物材料包装可能的植物蛋白来源。然而,由于蛋白质固有的亲水性,诱导与水的相互作用,引起肿胀和明显的厚度改变,其耐水蒸气透过性受到限制[79]。为克服这一缺点,通常向成膜液中加入油脂等疏水性物质,而油脂氧化提供了参与美拉德反应的糖基化合物,使得蛋白质膜极易发生氧化[80],多酚作为抗氧化剂被添加到蛋白质薄膜中,已被证明可以降低脂质的氧化变色[81],如添加儿茶素可以延缓鱼类肌肉蛋白膜储藏期间的脂质氧化,并增强抗菌活性[82]。Rodsamran 等[83]发现加入椰子水中提取的多酚物质增加了椰子蛋白质膜的溶解性、改善了薄膜的抗拉强度等机械性能以及抗氧化性能。此外,复合物制备的薄膜呈深棕色,因此可用于食品的防紫外线包装。Girard 等[84]综述了单宁-谷蛋白相互作用在生物聚合物薄膜方面的应用,单宁可以通过氢键和疏水相互作用使面筋交联,进一步增加蛋白质基质的密度来增强面筋的抗氧化作用,同时提高膜的抗拉强度、灵活性以及降低气体渗透性。
5.3 递送系统
生物活性物质对人体健康具有重要促进作用,是制备功能性食品的良好原料,而受其稳定性、长效性、共混性、靶向递送、可控释放及生物利用低等问题的影响,这些活性物质健康益处的发挥及应用场景的开发利用极为受限。蛋白质-多酚复合物因具有良好的功能特性可帮助建立优良的活性物质递送系统[85],其整个消化递送系统如图4所示。如Wei 等[86]采用EGCG 对乳蛋白进行共价修饰,与天然乳蛋白相比,复合物中多酚的存在提高了乳液中β-胡萝卜素的热稳定性、紫外光稳定性以及抗氧化性能,表明蛋白质-多酚复合物乳状液具有封装、保护和提供疏水性的潜在利用价值。Liu 等[87]研究发现姜黄素和白藜芦醇被包裹在由玉米醇溶蛋白-EGCG 偶联物制备的纳米颗粒中时,姜黄素和白藜芦醇的生物可及性均得到了提高,这一发现为设计食品级共轭基给药系统提供了依据。Lau 等[88]认为牛血清白蛋白-单宁酸膜是水溶性和脂溶性食品源生物活性化合物微胶囊化的潜在材料。现有研究基础表明,以pH 值驱动、微流控、界面重构、自组装、静电沉积等技术为手段,以蛋白质-多酚复合物为基础构建乳液、脂质体、纳米粒、凝胶等新兴食品运载体,通过调控食品包埋运载体的环境响应特性和机制效应可有效实现活性物质的靶向递送、可控释放、高效生物转化和吸收利用。

图4 蛋白质-多酚复合物应用潜力Fig. 4 Application potential of protein-polyphenol complexes

图5 蛋白质-多酚递送系统消化示意图[16]Fig. 5 Schematic diagram of protein-polyphenol delivery system digestion[16]
6 总结
目前,人们已对蛋白质-多酚复合物的结构-功能关系进行了较深入的研究。蛋白质-多酚复合物的功能与二者间的相互作用密切相关。这些相互作用是由内部因素(蛋白质特征、多酚类型、浓度等)和外部因素(温度、剪切力)引起的。蛋白质多酚复合物可以改善蛋白质包括乳化、热稳定、溶解以及凝胶在内的一系列功能特性,从而提高了其在乳液、薄膜、递送系统等食品与生物医药领域方面的应用潜力。同时,还需要深入开展不同食品来源的蛋白质和多酚的结合差异、特性改良及作用机制研究,为个性化健康食品、功能食品及生物医药产品的研发提供理论参考及技术支撑。
