白蛋白/碱性磷酸酶与宫颈癌化疗患者预后的相关性
2024-03-12王粉杜凯刘钰
王 粉 杜 凯 刘 钰
化疗是宫颈癌中晚期患者主要治疗手段之一,可通过有效抑杀癌细胞来缩小肿瘤病灶并限制其生长转移,进而改善阴道出血、坠胀感等不适病症,提高生存质量[1]。但有相关调查发现,虽化疗可使大部分宫颈癌患者获得较好临床病理缓解,但仍有部分患者化疗效果不理想,如不能及时识别干预,则会增加宫颈癌恶化转移几率,增加不良预后发生风险[2]。因此,探寻可提前预估宫颈癌患者化疗疗效的临床指标对改善宫颈癌化疗患者预后具有重要意义。近年来有研究发现,大多宫颈癌化疗预后不良患者均伴有不同程度的营养不良、异常炎症反应和免疫力下降[3]。而白蛋白(albumin,ALB)和碱性磷酸酶(alkaline phosphatase,ALP)均为宫颈癌化疗前常规检测指标,前者可参与营养物质运输,是反应人体营养状况的重要指标,后者广泛分布于人体肝脏和骨骼中,对机体炎症情况和免疫调节功能变化具有极高灵敏性[4]。研究的不断深入,发现相比于单独的两指标,ALB/ALP能更综合地反映患者体内营养情况和炎症免疫状态,且已证实在乳腺癌的预后评估中取得甚佳效果[5]。基于此,收集接受化疗治疗的宫颈癌患者临床资料,探讨ALB/ALP与其预后的关系。具示如下。
1 资料与方法
1.1 一般资料
回顾性分析,收集医院2021年4月至2023年4月收治的宫颈癌化疗患者临床资料。 纳入标准:①符合《中国常见妇科恶性肿瘤诊治指南(2019版)》[6]中对宫颈癌诊断标准,且经宫颈活检和影像学检查证实;②临床分期ⅡB~ⅣA期[6];③均接受顺铂联合紫杉醇化疗,化疗周期为4周期;④临床病历资料与随访资料完整。排除标准:①合并其他恶性肿瘤;②化疗前接受其他抗肿瘤治疗;③合并严重肝肾心脑功能障碍;④化疗期间出现严重过敏反应,导致化疗终止。依据上述标准,共筛选出120例宫颈癌患者,年龄45~61岁,平均(54.27±3.16)岁;临床分期ⅡB期52例,Ⅲ期46例,ⅣA期22例;疾病类型:鳞癌100例,腺鳞癌10例,其他(如小细胞癌、透明细胞癌等)10例;临床症状:阴道出血89例,头晕乏力47例,四肢酸痛62例;合并人乳头状瘤病毒(human papilloma virus,HPV)感染98例。于化疗结束后第30天时根据《实体肿瘤疗效评价标准》[7]评价化疗疗效(完全缓解:病灶消失且维持时间≥4周;部分缓解:目标病灶直径总和减少≥30%且维持时间≥4周;疾病进展:目标病灶直径总和增加20%或检查发现新发病灶;疾病稳定:目标病灶情况介于疾病进展与部分缓解之间)。将完全缓解、部分缓解的101例患者纳入预后良好组,将19例疾病稳定和疾病进展患者纳入预后不良组。本研究经医院医学伦理委员会批准实施。
1.2 方法
1.2.1 基线资料收集 通过查阅电子病历记录、治疗记录单等整理患者基线资料,包括年龄、肿瘤直径、病程、孕产次数、宫颈癌家族遗传史(有、无)、临床分期(ⅡB期、Ⅲ期、ⅣA期)、疾病类型(鳞癌、腺鳞癌、其他)、是否合并HPV感染(是、否)、分化程度(低分化、中分化、高分化)等。
1.2.2 实验室指标收集 通过查阅医院电子病历系统及实验室检查记录单,统计所有患者化疗前1周内所测的ALB、ALP及其他实验室指标。具体方法:真空采集管取患者外周静脉血3 ml,将其置于上海维光电技术有限公司生产的TGL-20MS离心机中以3500 r/min、半径10 cm离心10 min后取血清,通过迪瑞医疗科技股份有限公司生产的型号CS-1200全自动生化分析仪及其配套试剂测定患者血清中ALB、ALP、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)水平,并计算ALB/ALP值;通过酶联免疫吸附法(试剂盒购自天津灏洋生物制品科技有限公司)测定患者血清中鳞状细胞癌抗原(Squamous Cell Carcinoma,SCC),通过电化学发光法(试剂盒购自上海原鑫生物科技有限公司)测定细胞角蛋白19片段(cytokeratin 19 fragment antigen21-1,CYFRA21-1)水平。
1.3 统计学方法

2 结果
2.1 基线资料及实验室指标对比
预后不良组肿瘤直径、ALP水平高于预后良好组、Ⅲ期与ⅣA期患者占比显著高于预后良好组,ALB、ALB/ALP显著低于预后良好组,差异有统计学意义(P<0.05);组间其他资料对比,差异无统计学意义(P>0.05)。详见表1。
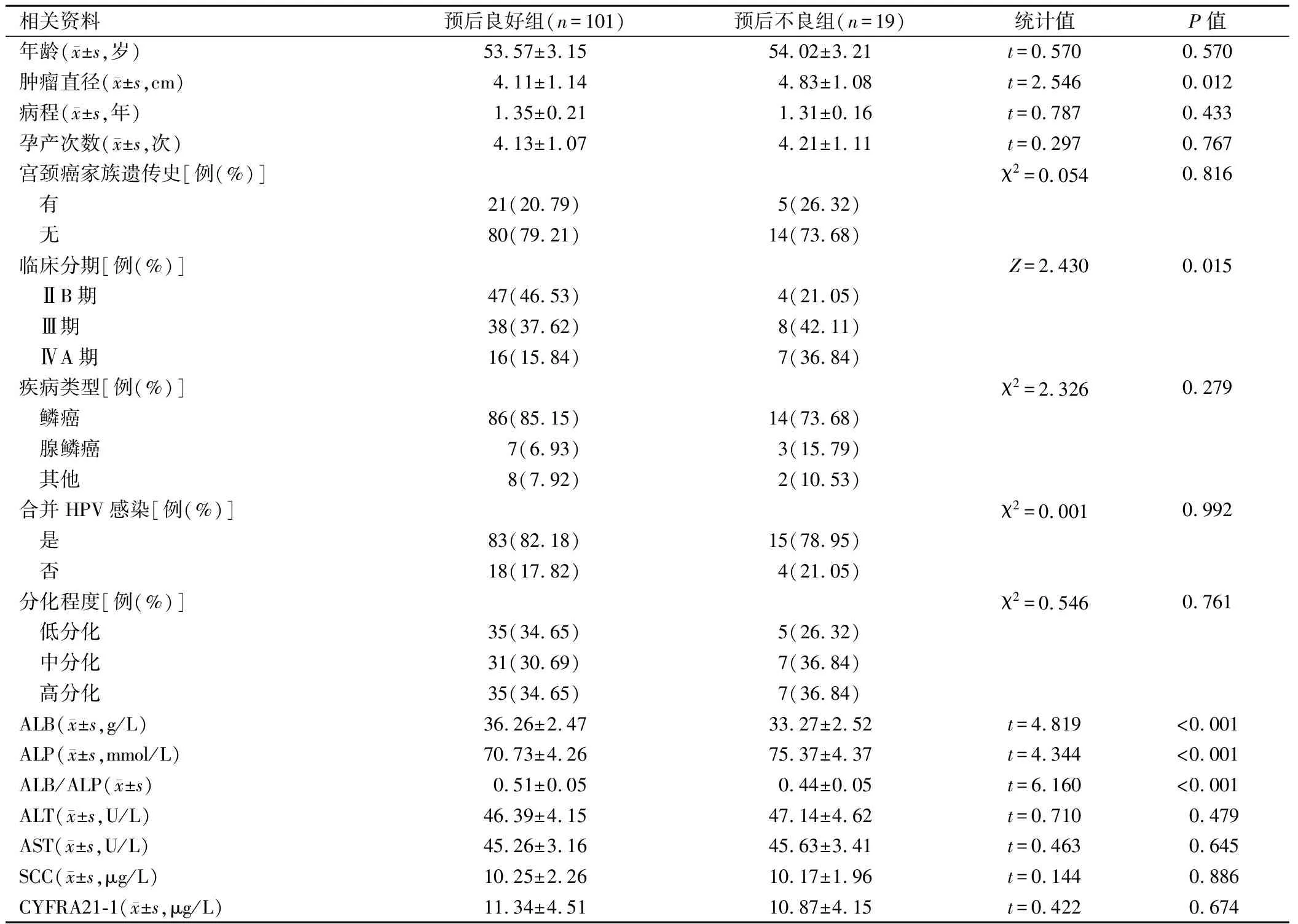
表1 2组基线资料与实验室指标对比
2.2 ALB、ALP、ALB/ALP与宫颈癌化疗患者不良预后的相关性
经点二列相关性分析,ALB、ALP、ALB/ALP与宫颈癌化疗患者不良预后有关(P<0.05)。见表2。

表2 ALB、ALP、ALB/ALP与宫颈癌化疗患者不良预后的相关性
2.3 ALB、ALP、ALB/ALP预测宫颈癌化疗患者不良预后的价值
将宫颈癌化疗患者预后情况作为状态变量(0=预后良好,1=预后不良),将ALB、ALP、ALB/ALP作为检验变量。绘制ROC曲线,结果显示,ALB、ALP、ALB/ALP预测宫颈癌化疗患者不良预后的AUC值分别为0.804、0.215、0.862,ALB/ALP预测价值最高。详见表3、图1。
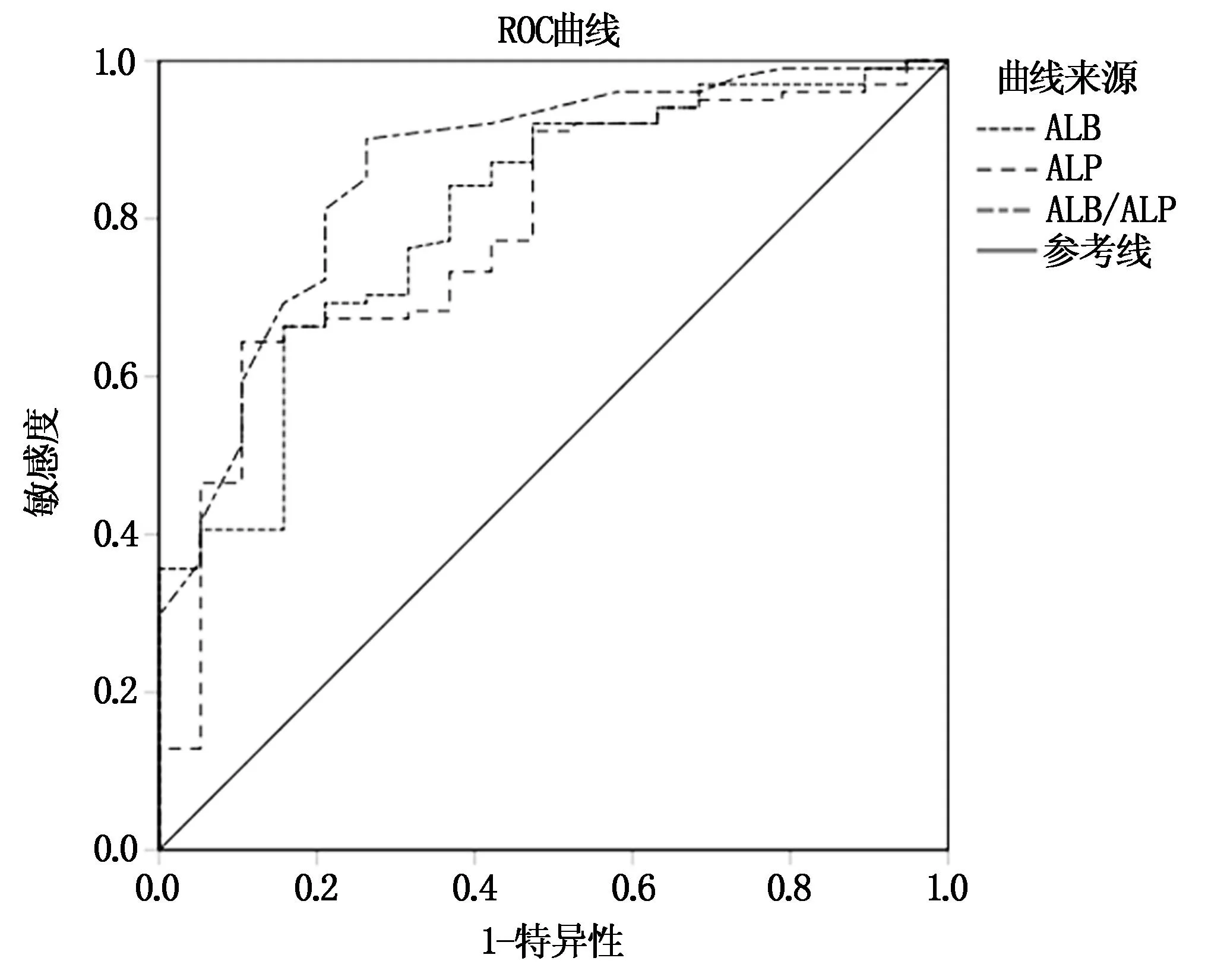
图1 ALB、ALP、ALB/ALP预测宫颈癌化疗患者不良预后的ROC曲线
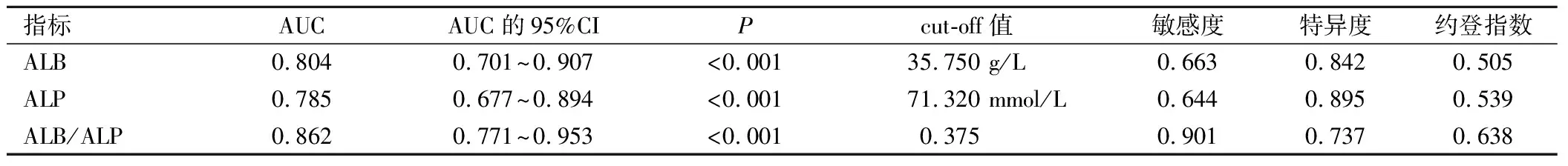
表3 ALB、ALP、ALB/ALP预测宫颈癌化疗患者不良预后的价值
3 讨论
研究证实,肿瘤直径越大、临床分期越高患者,其体内癌细胞数量越多且分裂增殖越快,而这会增加肿瘤病灶对重要血管的压迫,继而造成化疗药物传递障碍,降低化疗效果,增加不良预后发生风险[8-9]。正如本研究结果中,预后不良组肿瘤直径、Ⅲ期与ⅣA期患者占比显著高于预后良好组。值得关注的是,宫颈癌中晚期患者接受顺铂联合紫杉醇化疗后肿瘤病灶可有效缩小,继而实现与疾病良好共存,但仍有部分患者化疗效果不尽人意,造成目标病灶直径增加甚至新发转移,增加不良预后发生风险[10]。恶性肿瘤的进展机制是临床关注的重点,对此有研究发现异常炎症反应和营养水平下降是恶性肿瘤进展和化疗疗效下降的重要机制[11-12]。但关于其在宫颈癌预后中的研究有限,故本研究从该机制相关的ALB和ALP入手,期待可为宫颈癌化疗患者不良预后的预防提供新方向。
通过对本研究结果的分析,预后不良组ALP显著高于预后良好组,ALB显著低于预后良好组,证实炎症反应和营养状态确与宫颈癌化疗患者不良预后有关。因为有相关研究发现,恶性肿瘤患者体内持续异常炎症状态会通过抑制细胞毒性淋巴细胞增殖来加速癌细胞的增殖和迁移,导致肿瘤病灶进展和迁移;而低营养水平则会增加患者对营养的消耗,加重化疗期间不良反应,继而使患者对化疗耐受力变差,化疗效果下降,最终增加不良预后发生风险[13-14]。虽ALB和ALP可较好反馈宫颈癌化疗患者体内炎症反应情况和营养水平,但因恶性肿瘤不良预后是炎症、营养等多种因素共同作用所致,故单独两指标在宫颈癌化疗患者预后预测中效果欠佳。ALB/ALT是ALB和ALT的结合,故推测相比于单独两指标,其在机体炎性反应和营养状况的综合评估上具有更高的敏感性与特异性。为此本研究后续通过ROC曲线探讨了ALB、ALT、ALB/ALT预测宫颈癌化疗患者预后的价值,结果也进一步证实了上述推论。研究发现当ALB/ALT水平下降多预示患者机体营养与炎症失衡,此时患者体内炎症反应强烈而营养水平也处于进行性下降中,而这状况不仅会降低患者体内的特异性免疫反应促使癌细胞免疫逃逸,还可使患者体内抑癌基因失活,导致化疗后患者体内部分休眠癌细胞被驱动激活并逐渐形成肿瘤病灶,进而使化疗效果下降,增大不良预后发生风险[15-16]。此外,ALB/ALT水平降低多提示患者癌细胞增殖和侵袭能力较强,此类患者化疗后残留癌细胞DNA复制极快,而这会增加化疗后癌病灶再生和转移几率,增加不良预后发生可能[17-18]。因此可于化疗前通过ALB/ALP水平来提前预估宫颈癌化疗患者疗效,继而采取针对性干预措施降低不良预后发生风险。
综上所述,ALB/ALP与宫颈癌化疗患者不良预后间呈负相关,其值越低,不良预后发生可能性越高。
