肺癌患者放疗前后血清ProGRP、SCC和铁蛋白水平变化及其临床意义
2024-03-12苌哲宗王耀飞孟盈君任原珍
苌哲宗 王耀飞 孟盈君 任原珍
肺癌的发病率及病死率均居于恶性肿瘤首位[1]。非小细胞肺癌(NSCLC)具有发病隐匿、早期无典型症状等特点,是肺癌常见的类型,约占肺癌的80%,多数患者确诊时病情已进展至中晚期[2-3]。放疗是治疗NSCLC的重要手段,探寻有效的评估指标对指导治疗及预测预后具有重要的临床价值。血清学指标具有检查费用低、创伤小、取样便捷等特点而广泛应用于临床[4]。胃泌素释放肽前体(ProGRP)与恶性肿瘤增殖、浸润及转移存在密切联系,是诊断肺癌的常用标志物[5]。鳞状细胞癌抗原(SCC)主要分布于鳞状上皮细胞胞质中,可参与癌细胞浸润及侵袭[6]。有报道显示,铁蛋白(SF)与恶性肿瘤的发生发展有关,是临床诊断恶性肿瘤的标志物[7]。本研究分析NSCLC患者放疗前后血清ProGRP、SCC及SF水平,旨在为临床诊疗提供新的参考,现报告如下。
1 材料与方法
1.1 一般资料
选取我院2019年9月至2022年8月122例NSCLC患者作为研究组。纳入标准:①满足《中华医学会肺癌临床诊疗指南》[8]中NSCLC诊断标准,经病理学检查确诊;②患者签署知情同意书;③近期未接受免疫治疗、化疗及靶向治疗;④首次接受放疗;⑤符合放疗指征;⑥临床资料完整;⑦临床分期为Ⅲ期。排除标准:①其他类型恶性肿瘤者;②精神疾病、凝血及认知功能严重损伤者;③存在放疗禁忌证,对放疗不耐受者;④肾、心等脏器严重损伤者;⑤自身免疫性疾病、急慢性感染性疾病;⑥慢性阻塞性肺疾病及支气管哮喘等其他肺部疾病者。另选取同期70例健康体检者作为对照组。研究组:男性71例,女性51例;年龄40~75岁,平均(55.43±8.14)岁;体质量指数19.3~27.1 kg/m2,平均(23.06±2.19)kg/m2;病理类型:鳞癌67例,腺癌55例;右肺70例,左肺52例;TNM分期:Ⅲa期69例,Ⅲb期53例。对照组:男性39例,女性31例;年龄42~71岁,平均(55.06±7.31)岁;体质量指数19.3~27.0 kg/m2,平均(22.23±1.92)kg/m2。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 治疗方法 NSCLC患者均接受胸部CT扫描,并将扫描结果上传至topslan治疗计划系统,放疗采用医用直线加速器。将肿瘤体积向外延伸0.3~0.7 cm范围视为临床靶体积,将瘤体随呼吸运动发生变化的范围视为计划靶体积。放疗选择6MV X射线照射,2~3 Gy/次,1次/d,每周5 d,治疗4周。
1.2.2 血清ProGRP、SCC及SF水平检测 NSCLC患者于放疗前后清晨、健康体检者于体检当日清晨采集5 ml空腹静脉血,离心处理(转速3500 min、时间10 min、半径10 cm)后取血清存于-20 ℃环境待测,采用电化学发光法检测胃泌素释放肽前体(ProGRP)、鳞状细胞癌抗原(SCC)及铁蛋白(SF),电化学发光仪cobas e601和试剂盒购自于德国罗氏公司。
1.3 放疗敏感性评估
放疗结束后2周,参考实体瘤疗效评价标准[9]进行评估:完全缓解:靶病灶完全消失;部分缓解:靶病灶直径之和减少>30%;疾病进展:靶病灶直径之和增加>20%或存在新病灶;疾病稳定:靶病灶变化范围介于疾病进展及部分缓解之间。将部分缓解及完全缓解视为放疗敏感,疾病稳定及疾病进展视为放疗不敏感。122例NSCLC患者,完成放疗后,4例完全缓解,39例部分缓解,60例疾病稳定,19例疾病进展。所有患者根据放疗敏感性分为敏感组(n=43)及不敏感组(n=79)。
1.4 统计学方法

2 结果
2.1 两组血清ProGRP、SCC及SF水平比较
研究组血清ProGRP、SCC及SF水平均高于对照组(P<0.05),见表1。

表1 两组血清ProGRP、SCC及SF水平比较
2.2 血清ProGRP、SCC及SF水平对NSCLC的诊断价值
由图1可知,血清ProGRP、SCC及SF水平联合检测诊断NSCLC的AUC为0.926,高于三者单独检测诊断的0.784、0.822、0.805(P<0.05),见表2、图1。
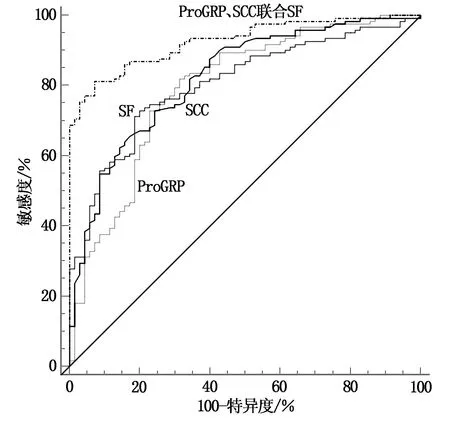
图1 血清ProGRP、SCC及SF水平诊断NSCLC的ROC曲线
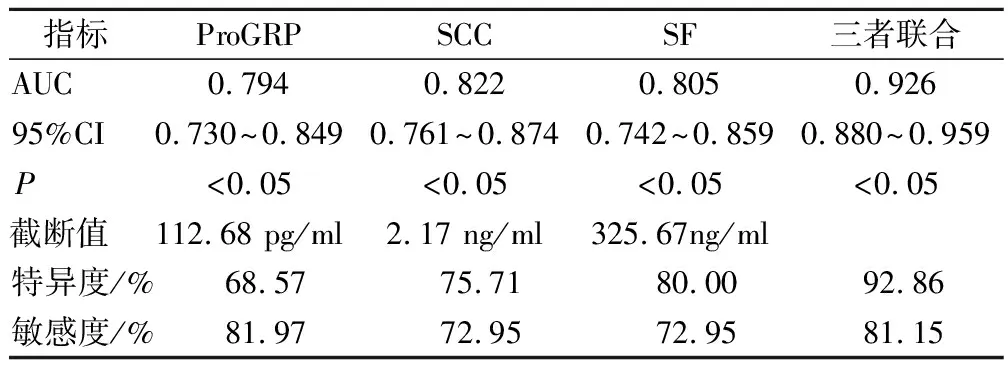
表2 血清ProGRP、SCC及SF水平对NSCLC的诊断价值
2.3 NSCLC患者放疗前后血清ProGRP、SCC及SF水平比较
NSCLC患者放疗后血清ProGRP、SCC及SF水平均低于放疗前(P<0.05),见表3。

表3 两组血清ProGRP、SCC及SF水平比较
2.4 不同放疗敏感性NSCLC患者放疗前后血清ProGRP、SCC及SF水平比较
不敏感组放疗前后血清ProGRP、SCC及SF水平比较,差异无统计学意义(P>0.05)。敏感度组放疗后血清ProGRP、SCC及SF水平低于放疗前及不敏感组(P<0.05),见表4。

表4 不同放疗敏感性NSCLC患者放疗前后血清ProGRP、SCC及SF水平比较
3 讨论
NSCLC多发生于中老年群体,但近年来该病发病出现年轻化趋势[10]。NSCLC早期缺乏典型临床表现,确诊时患者多处于中晚期,已错失最佳治疗时机,5年生存情况不理想[11]。放疗是治疗中晚期NSCLC的重要方式,能缩小病灶体积、降低远处转移及复发风险,但仍存在部分患者放疗后疗效未达到预期。探寻有效的指标评估患者对放疗的敏感性,可为后续治疗方案调整、避免放疗副作用提供依据。
ProGRP分布于肺组织神经内分泌细胞的胃肠激素,可以刺激G细胞释放胃泌素、影响细胞功能。既往研究发现,肺癌细胞可合成及释放ProGRP,并经旁分泌作用对恶性肿瘤细胞进行刺激,从而加快细胞增殖,影响肿瘤细胞侵袭及转移[12]。临床研究认为,ProGRP可以调控细胞周期,加快肿瘤细胞由G1期转向S期,从而促进癌细胞增殖[13]。有报道显示,ProGRP在肺癌患者血清呈高表达,其水平远高于健康群体。SCC能促进肿瘤细胞DNA复制及分化,与患者临床分期、分化程度及淋巴结转移存在联系[14]。有报道认为,SCC水平在组织发生恶性病变时会明显升高[15]。SF与机体稳态有关,可影响机体能量代谢、氧运输等途径,其水平过低会引发缺铁性贫血,但水平过高会增加恶性肿瘤发生风险。有报道显示,SF水平升高会导致肺癌、乳腺癌及胰腺癌等发生风险明显增加[16]。临床研究发现,肺癌患者血清SF水平高于健康群体,且与患者分化程度、肿瘤直径及临床分期有关[17]。
本研究结果显示,研究组血清ProGRP、SCC及SF水平均高于对照组,提示NSCLC患者血清ProGRP、SCC及SF水平升高。分析原因为:NSCLC患者部分癌细胞在异常凋亡过程中细胞膜结构蛋白会发生分解,使癌细胞内ProGRP大量释放,引起血清ProGRP水平升高[18]。此外,在癌细胞过度增殖会引起癌细胞DNA持续性扩增,造成癌细胞膜表面糖蛋白含量增加,导致血清SCC水平升高[19]。恶性肿瘤细胞会损伤患者组织,引起机体铁代谢异常,造成铁排出量降低,使机体铁储备明显增多,存储于细胞内的SF释放入血,导致血清SF水平升高。进一步的ROC曲线分析显示,血清ProGRP、SCC及SF水平诊断NSCLC的AUC分别为0.779、0.731、0.761,提示三者对NSCLC具有一定的诊断价值。三者联合诊断AUC高达0.878,表明三者联合能明显提高诊断价值。本研究还发现,NSCLC患者放疗后血清ProGRP、SCC及SF水平均高于放疗前,分析原因为ProGRP、SCC及SF均与NSCLC发生发展有关,患者在放疗后病情得到控制,使得血清ProGRP、SCC及SF水平降低。对比不同放疗敏感性患者血清ProGRP、SCC及SF水平发现,敏感度组放疗后血清ProGRP、SCC及SF水平低于不敏感组,提示ProGRP、SCC及SF水平可作为评估放疗敏感性的指标。
综上所述,ProGRP、SCC及SF在NSCLC患者血清中呈高表达,三者联合对NSCLC具有较高的诊断价值,监测三者水平变化有利于评估NSCLC患者放疗敏感性。
