miR-339-5p通过靶向调节p53表达影响脑胶质瘤细胞的转移活性分析
2024-03-12高绚照常文广
柳 毅 高绚照 常文广
恶性胶质瘤是人类中枢神经系统中最常见的原发性肿瘤[1]。尽管在手术技术、化疗和放疗方面取得了许多进展,但恶性胶质瘤患者的预后仍然顽固地不佳。胶质瘤的进展取决于肿瘤血管的生长[2]。胶质瘤细胞分泌血管内皮生长因子和其他促血管生成因子,促进血管内皮细胞的生长。此外,胶质血管内皮细胞还分泌多种促进肿瘤生长的因子,这些分泌的因子的相互作用可以促进胶质瘤生长[3]。miRNA通过与目标基因的3'-非翻译区(3'-UTR)结合,在转录后水平上调节目标基因的表达。miRNAs调节许多癌症关键的信号通路,进而发挥致癌或肿瘤抑制功能[4]。例如,miR-339-5p的过度表达可以抑制结直肠癌和乳腺癌细胞增殖、侵袭并诱导其凋亡,并且这一过程与miR-339-5p调控p53相关[5]。最近研究发现,相比癌旁组织,miR-339-5p在脑胶质瘤组织中表达下降[6],然而,miR-339-5p对胶质瘤细胞的作用及相关机制尚未报道,因此本研究通过研究miR-339-5p与脑胶质瘤细胞之间的关系,以期为脑胶质瘤的治疗提供新思路。
1 材料与方法
1.1 主要材料和仪器
人神经胶质瘤U87细胞(上海弘顺生物科技公司);Lipofectamine 2000(美国赛默飞公司);AnnexinV-FITC试剂盒(上海碧云天生物科技公司);Transwell chamber(美国sigma公司);TRIzol Reagent(美国Invitrogen公司);TaqMan逆转录试剂盒(日本Takara公司);SYBR Premix ExTaqTMReal-Time PCR Kit(美国Thermo Fisher公司);p53, GAPDH单克隆抗体(英国abeam公司);miR-339-5p mimics, si-p53(武汉汉恒生物)。
倒置显微镜(美国Thermo公司);酶标仪(美国BIOTEK公司);Western bloting实验设备(德国PROTEC公司);流式细胞仪(美国BD公司);实时荧光定量PCR仪(美国BIO-RAD公司)。
1.2 细胞培养和分组
胶质瘤U87细胞在RPMI-1640培养基(含10%胎牛血清)中,在37 ℃和5% CO2的培养箱中培养。将细胞分为4组:空白组、miR-339-5p mimic组、si-p53组、miR-339-5p mimic+si-p53组。按照说明书的要求,用Lipofectamine 2000分配并转染到相应的实验组。转染完成后48 h开展后续实验。
1.3 MTT实验检测细胞增殖能力
转染完成48 h后将细胞转移至96孔板中,每孔大约5×103个细胞,加入20 μL MTT液(5.0 mg/ml),37 ℃培养4 h,用100 ml二甲基亚砜溶解紫色晶体,通过Mitras2LB943多功能酶标仪在0、12、24、36、48 h分别检测各组细胞的吸光度(490 nm)。
1.4 蛋白免疫印迹法检测蛋白质的表达变化
使用RIPA裂解缓冲液从细胞系中提取总蛋白样品,使用BCA蛋白测定试剂盒测定蛋白浓度。等量的蛋白样品在10%的SDS-PAGE上分离并转移到PVDF膜上。膜在室温下用5%的脱脂牛奶浸泡2小时。然后将膜与相应的第一抗体在4 ℃下孵育过夜。用TBST洗涤后,将膜与山羊抗兔IgG-辣根过氧化物酶二抗在室温下孵育2小时,用增强化学发光检测系统捕捉印迹信号。
1.5 实时荧光定量PCR分析miR-339-5p和p53基因表达水平
使用TRIzol试剂从细胞系中提取总RNA,使用反转录试剂盒在37 ℃下60 min或98 ℃下10 min合成cDNA,使用SYBR Premix ExTaqTM实时PCR试剂盒在Applied Biosystems 7500序列检测器上使用以下引物序列进行实时定量PCR。热循环条件如下:95 ℃预变性3 min,95 ℃40个循环30 s,60 ℃退火延伸1 min。所有反应均为一式三份。以U6为内参并使用2-ΔΔCq方法计算。引物序列见表1。
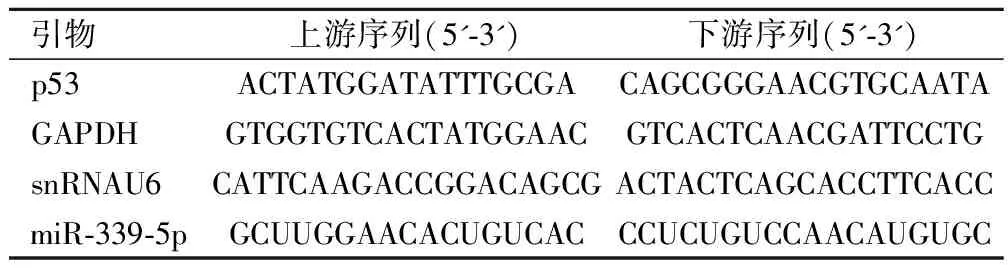
表1 所用引物序列
1.6 流式细胞术分析U87细胞凋亡率
转染72 h后,收获细胞,用冰冷的PBS清洗两次,并在4 ℃下用70%的乙醇固定1 h。将细胞与50 μl RNase1在室温下孵化10 min以降解RNA。在4 ℃下以3500 rpm离心5 min,然后加入5 μl Annexin V-FITC,5 μl碘化丙啶,在室温下暗中双染30 min。使用FACScan流式细胞仪评估细胞凋亡状态。
1.7 Transwell实验分析U87细胞侵袭能力
在无血清RPMI-1640培养基下,将有转染完成后的U87细胞接种在Matrigel涂层的小室的上室。将含有15%血清的RPMI-1640培养基加入下室。24小时后,在显微镜下观察到侵入下室的细胞,随后用结晶紫染色,使用Image J软件统计U87细胞侵袭情况。
1.8 荧光素酶报告基因实验验证miR-339-5p与p53的靶向关系
miR-339-5p与p53的结合位点是通过工具site targetscan获得的。将p53的3'-UTR片段插入荧光素酶终止密码子下游的pGL3载体中构建p53-WT。并使用快速定向诱变试剂产生突变体p53-MT。用萤火虫荧光素酶的报告载体和海肾荧光素酶载体pRLTK共转染细胞,并加入0.5 μg的miR-339-5p mimic或miR NC。使用双荧光素酶检测法连续测量萤火虫和海肾荧光素酶的活性。
1.9 统计分析
应用IBM SPSS 26.0软件进行统计分析。计量数据以均值±标准误差表示。多组间的差异采用单因素方差分析进行比较,两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组胶质瘤U87细胞中miR-339-5p和p53表达情况
各组细胞转染后,通过qPCR和蛋白免疫印迹检测miR-339-5p和p53的表达情况。实验结果发现,miR-339-5p和p53的表达组间比较,差异具有统计学意义(P<0.05)。miR-339-5p mimic组和miR-339-5p mimic+si-p53组miR-339-5p表达水平高于空白组和si-p53组(P<0.05)。si-p53组p53 mRNA和蛋白水平均低于其他3组(P<0.05),miR-339-5p mimic组p53 mRNA和蛋白水平均高于其他3组(P<0.05)。见表2。
表2 各组细胞miR-339-5p和p53表达情况
2.2 胶质瘤U87细胞中p53是miR-339-5p的直接靶点
通过TargetScan发现Has-miR-339-5p与p53基因的3'-UTR存在互补结合位点,见图1。双荧光素酶报告基因实验发现,与阴性对照miR NC组相比,miR-339-5p mimic和p53-WT共转染的细胞荧光素酶活性明显增加。另外,蛋白印迹法进一步验证了miR-339-5p mimic可以促进p53的表达,见表3。

图1 p53潜在上游miR-339-5p结合位点预测结果
表3 双荧光素酶报告基因实验结果
2.3 各组胶质瘤U87细胞的增殖活性比较
MTT实验结果显示,各组胶质瘤细胞增殖率组间比较,差异具有统计学意义(P<0.05)。miR-339-5p mimic组细胞增殖率低于空白组、si-p53组和miR-339-5p mimic+si-p53组。与miR-339-5p mimic组相比,miR-339-5p mimic+si-p53组细胞增殖率升高(P<0.05),见图2和表4。
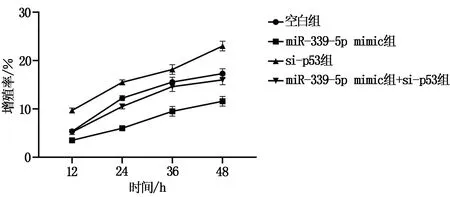
图2 各组细胞在不同时间增殖率比较
表4 各组细胞的增殖活性比较
2.4 各组胶质瘤U87细胞的侵袭能力比较
Transwell实验显示,各组胶质瘤细胞侵袭细胞数量组间比较,差异具有统计学意义(P<0.05)。miR-339-5p mimic组细胞侵袭细胞数量低于空白组、si-p53组和miR-339-5p mimic+si-p53组。与miR-339-5p mimic组相比,miR-339-5p mimic+si-p53组细胞侵袭数量升高(P<0.05),见表5。
表5 各组胶质瘤U87细胞的侵袭数量比较
2.5 各组胶质瘤U87细胞凋亡率比较
流式细胞术检测发现,各组胶质瘤细胞凋亡率组间比较,差异具有统计学意义(P<0.05)。miR-339-5p mimic组细胞凋亡率高于空白组、si-p53组和miR-339-5p mimic+si-p53组。与miR-339-5p mimic组相比,miR-339-5p mimic+si-p53组细胞凋亡率下降(P<0.05),见图3和表6。
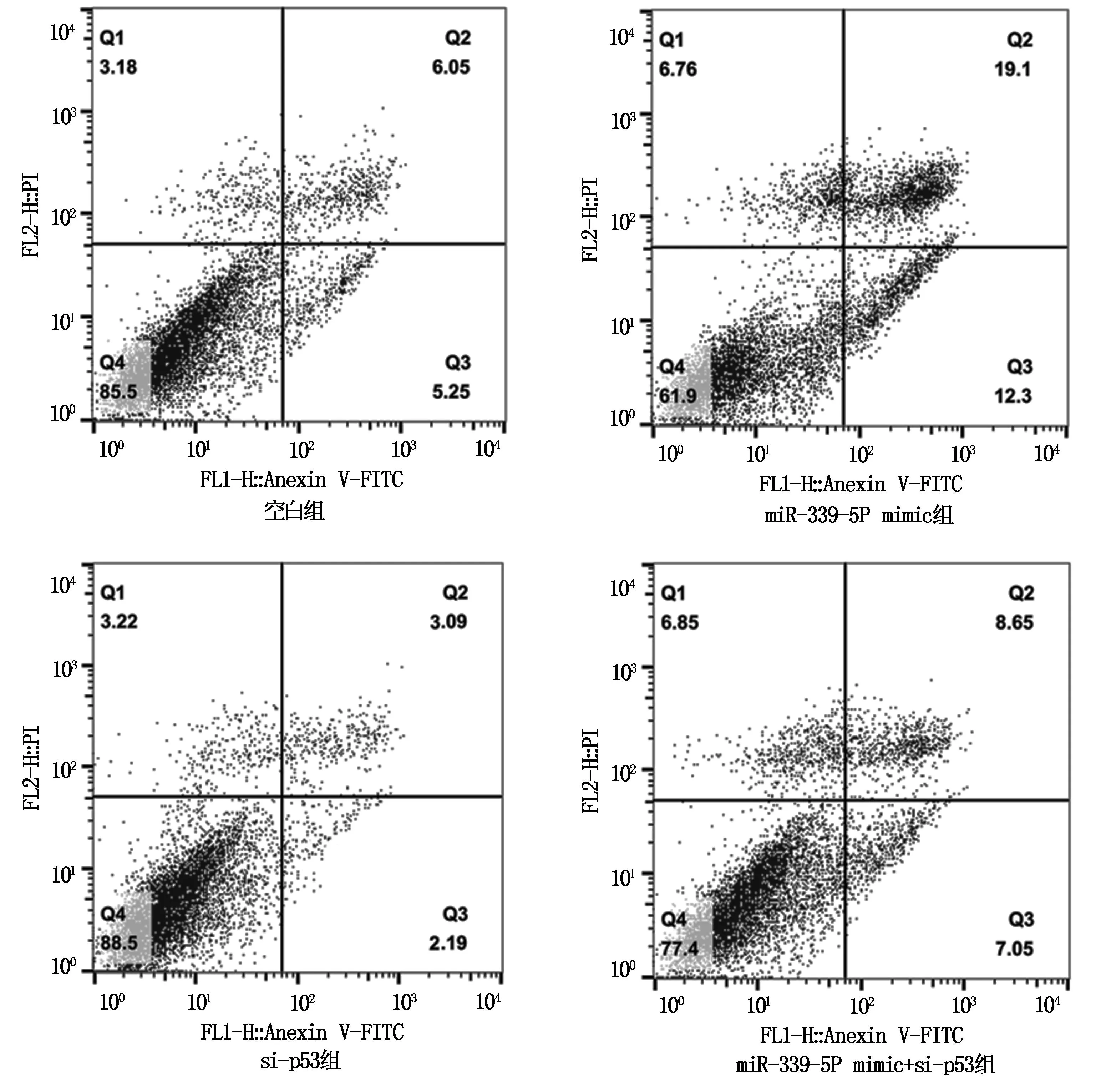
图3 各组胶质瘤U87细胞的凋亡率比较
表6 各组胶质瘤U87细胞的凋亡率比较
3 讨论
miRNA可以调节癌症的发生、发展和转移,成为相关肿瘤的标志物和治疗靶点,从而为肿瘤的诊断和治疗提供可能[7]。相关研究分析了癌症和健康样本在不同阶段的miRNA表达谱,发现miRNA可以区分癌症和健康样本。miRNA广泛存在于胶质瘤中,但每个miRNA的表达水平在胶质瘤中是不同的[8]。相关研究采用实时荧光定量PCR反应鉴定不同程度的恶性肿瘤中10种miRNA的表达水平,发现胶质瘤的恶性程度越高,miR-13和miR-7的表达水平越低,而miR-21、miR-17、miR-9、miR-26a、miR-23a和miR-20a则随之升高[9]。研究证明,miRNA的差异表达可能是胶质瘤的重要分子生物标志物,在基因表达调控方面具有潜在的研究价值。
最近研究发现,相比癌旁组织,miR-339-5p在脑胶质瘤组织中表达下降,既往研究报道miR-339-5P的表达与淋巴转移有关,并可能抑制乳腺癌细胞和非小细胞肺癌细胞的增殖和转移潜力,这一结果提示miR-339-5p可能参与大脑和中枢神经系统的胶质细胞癌变[10]。本文证明了miR-339-5p在人胶质瘤U87细胞的增殖、凋亡和侵袭能力中的作用。本研究结果发现,接受miR-339-5p mimic转染的人胶质瘤U87细胞的增殖率和侵袭数量都显著降低,而凋亡率明显升高。以上结果显示,过度表达的miR-339-5p可以抑制人胶质瘤U87细胞的增殖和侵袭能力,并促进细胞的程序性死亡。相关研究发现,miR-339-5p抑制非小细胞肿瘤细胞的迁移和侵袭能力,与癌症淋巴转移期和淋巴转移密切相关[11]。还有研究表明,抑制miR-339-5p的表达会提高两种卵巢癌细胞的迁移和侵袭能力,而上调的miR-339-5p会减弱这两种卵巢癌细胞迁移和侵袭能力,这些报道均与本研究结论一致。除此之外,p53肿瘤抑制蛋白是一种转录因子,作为许多应激感应途径的中心枢纽,对细胞对基因毒性应激的反应和抑制肿瘤的发生至关重要[12]。如果p53功能失调,一些DNA损伤得不到修复,这可能导致基因组不稳定,这是癌症的一个标志。此外,有p53缺陷的细胞能够逃避凋亡途径,并在这些细胞压力的选择下无限期地增殖[13]。因此,p53在预防致癌方面起着关键作用。研究表明,在超过50%的人类癌症中,p53发生了突变[14]。在本研究中,抑制p53表达后,人胶质瘤U87细胞的增殖和侵袭能力增高,并且凋亡率降低。这一结果说明p53能够抑制胶质瘤U87细胞活性。一些调控p53或影响p53激活的miRNA已被认为是癌症中重要的预后生物标志物和/或代表癌症治疗导向的研究对象[15]。因此,更透彻地了解调节这一关键途径的miRNA是很重要的。本研究中,和空白组相比,转染miR-339-5p mimic后,p53的蛋白和mRNA表达升高。另外,双荧光素酶报告基因结果显示,miR-339-5p能够靶向调节p53的活性。此外,抑制p53后,miR-339-5p对U87细胞的抑制作用明显减弱,这些结果表明,miR-339-5p能够通过靶向提高p53表达抑制脑胶质瘤细胞的转移活性。
综上所述,研究发现,miR-339-5p能够抑制脑胶质瘤U87细胞的增殖和侵袭,并促进胶质瘤U87细胞凋亡,同时这一过程与靶向激活p53相关。
