纳米长余辉发光材料在生物医学检测、生物成像与肿瘤治疗中的研究进展
2024-03-11王俊张兵波
王俊, 张兵波
(1. 陆军军医大学, 西南医院 检验科, 重庆 400038;2. 同济大学附属同济医院 放射科, 上海市催化医学前沿科学研究基地,同济大学医学院生物医学工程与纳米科学研究院, 上海 200065)
1 引言
随着成像技术的快速发展,各种各样的成像技术,如光学成像(Optical imaging)、计算机断层扫描(Computed tomography,CT)、超声成像(Ultrasound imaging,US)、磁共振成像(Magnetic resonance imaging,MRI)、光声成像(Photoacoustic imaging)、单光子发射计算机断层扫描(Single photo emission computed tomography,SPECT)和正电子发射断层扫描(Positron emission tomography,PET),广泛应用于生物成像,为疾病的发病机制、进展和治疗提供了重要的信息[1]。在这些成像工具中,基于荧光的光学成像由于其灵敏度高、简单快速、成本低、高时空分辨率和无辐射危害,在生物医学领域备受关注[2]。目前,荧光成像在生物医学领域中的应用主要体现在以下几个方面:肿瘤标志物检测[3]、细胞成像示踪[4]、肿瘤体内荧光诊断[5]、成像介导下肿瘤治疗和手术导航[6]。常用的荧光纳米材料有荧光染料[7-8]、半导体聚合物[9]、量子点[10-11]、贵金属纳米簇[12-13]和上转换纳米颗粒[14]等。然而,这些荧光探针存在着光稳定性差、易光漂白、背景信号干扰、发光寿命短和需原位激发等缺点,在某种程度上限制了其进一步的生物医学应用。因此,开发长荧光寿命、无需原位激发的纳米材料在生物医学领域备受研究人员的关注。
长余辉发光材料是一种能储存外界光(紫外光、可见光、X射线等)发射的能量、在激发光停止后仍能持续发光的一种材料,其余辉能持续几分钟、几小时甚至数天[15-18]。这种持续发光的现象最早能追溯到中国的宋朝[19]。由于长余辉发光材料独特的光学性质,其广泛应用于安全标识、信息存储、体温传感等[20-23]。随着纳米长余辉发光材料的出现,由于长余辉寿命、无需原位激发、无组织背景信号干扰和高信噪比,其广泛应用于生物医学检测、生物成像和肿瘤治疗。本文综述了近年来纳米长余辉发光材料在生物医学检测、生物成像和肿瘤治疗方面的应用进展,并进一步探讨了其在生物医学应用中所面临的挑战,对其未来的发展趋势也进行了展望。
2 纳米长余辉发光材料在生物医学检测、生物成像和肿瘤治疗中的应用
纳米长余辉发光材料由于其具有长余辉寿命、无需原位激发,无背景信号的干扰等优点,已广泛应用于多种领域,包括生物传感检测、生物成像、药物递送和肿瘤治疗等。在本章,我们将从生物医学检测、生物成像和肿瘤治疗这三个方面介绍纳米长余辉发光材料在生物医学领域的研究进展。
2.1 生物医学检测
荧光分析因其响应速度快、灵敏度高、成本低和操作简单等优点,是现代分析科学中最常见的方法之一,广泛应用于生物传感领域[24]。在过去几十年,研究人员设计了各种各样的光学纳米材料来满足快速、实时和原位检测的需要。然而,基于有机或无机纳米颗粒的光学分析经常受到自发荧光、散射光的干扰和光漂白的影响。因此,探索和开发更高效和更高灵敏度的光学探针受到了研究人员的广泛关注。纳米长余辉发光材料由于具有长的余辉寿命和无需原位激发,能有效消除自发荧光和散射光的干扰,显著地提高检测的灵敏度和信噪比,使其成为新一代用于无自发荧光检测和传感的光学材料,在生物分析应用方面具有巨大潜力。根据检测物类型的不同,我们总结了纳米长余辉发光材料在生物医学检测中的应用进展(表1)。

表1 纳米长余辉发光材料用于生物标志物检测汇总Tab.1 Summary of the PLNPs for biomarker detection
在复杂的生物环境中有选择性和灵敏地检测生物标志物对于有效的临床诊断至关重要。与基于荧光染料或量子点等传统荧光传感器相比,纳米长余辉发光材料可以在体内外进行非入侵性传感,并通过消除自发荧光干扰来提高检测的灵敏度和信噪比。2011年,Wu等[25]开发了一种基于纳米长余辉发光材料的α-甲胎蛋白(Alpha fetoprotein,AFP)的荧光共振能量转移(Fluorescence resonance energy transfer,FRET)抑制测定法。这种高灵敏度和特异性的纳米长余辉发光材料可以检测血清样品中的AFP并可以对肿瘤细胞生长过程中分泌的AFP进行实时成像。Wang等[27]报道了一种溶菌酶适配体修饰的Zn2GeO4∶Mn长余辉纳米棒(能量供体)用于血清中溶菌酶的检测(图1(a))。染料(BHQ)修饰的DNA(能量受体)通过DNA杂交猝灭长余辉纳米棒的余辉。当检测体系中有溶菌酶存在时,FRET体系被破坏,溶菌酶适配体的构象折叠成独特的三维结构从长余辉纳米棒表面脱离,长余辉纳米棒的余辉得以恢复,实现了在无自发荧光干扰的情况下检测患者血清样本的溶菌酶。其定量结果与临床上ELISA一致,表明该探针在临床样本的分析中具有重要的应用价值。利用类似的原理,研究人员利用时间分辨FRET用于miRNA-21[27]、caspase-3、L-半光氨酸和胰岛素[49]等的检测。

图1 (a)ZGO∶Mn长余辉发光纳米棒用于溶菌酶检测示意图;左侧和右侧小鼠分别用0.1 mL的PBS7.4缓冲溶液和0.1 mL GSH溶液处理,然后再用0.1 mL(1 mg/mL)MnO2-PLNPs(注射10 min前预先用365 nm紫外光照射)处理,考察有激发光(b)和没有激发光(c)条件下两只小鼠的体内成像Fig. 1 (a)Schematic illustration of the ZGO∶Mn persistent luminescent nanorod for lysozyme detection. The mice were treated with PBS7.4 buffer(left mice) and 0.1 mL GSH solution(right mice), respectively. Then, 0.1 mL(1 mg/mL) of MnO2-PLNPs(pre-irradiated with 365 nm ultraviolet light 10 minutes before injection) were injected into the same area into two mice to investigate in vivo imaging with laser irradiation(b) or without laser irradiation(c)
除了体外检测,纳米长余辉材料还可以对体内某些生物活性物质进行成像。例如,Tang等[37]合成了一种MnO2-PLNPs用于体内谷胱甘肽(GSH)的成像。体内实验结果表明,在420 nm激发光激发下,信号被组织的背景噪声所掩蔽(图1(b))。在没有激发光的条件下,左侧小鼠出现弱的信号,加了探针的小鼠出现强的余辉信号(图1(c)),表明该纳米探针能够在体内对GSH成像,并能有效消除原位激发下组织的自发荧光和散射光的干扰,从而提高对检测物的灵敏度和信噪比。纳米长余辉发光材料除了应用于肿瘤生物标志物和生物活性物质的检测,还可以用于病原微生物的检测。例如,Yuan等[44]将Python图像算法集成到基于纳米长余辉发光材料光子晶体的生物芯片中,构建了一个基于机器视觉的诊断系统用于检测尿液样本中的细菌(图2)。抗体修饰的Zn2GeO4∶Mn纳米长余辉发光材料(ZGO∶Mn PLNPs)通过抗体-抗原识别特异性结合并捕获目标细菌,经过磁分离和再重悬后,在光子晶体的生物芯片上,ZGO∶Mn PLNPs发射出增强的余辉信号。信号被捕获后,通过机器视觉算法将其转换为数字信号,在1 h内可以检测出细菌最低的浓度为103CFU/mL,无需昂贵的设备和专业的操作即可实现尿液中细菌的定量检测。
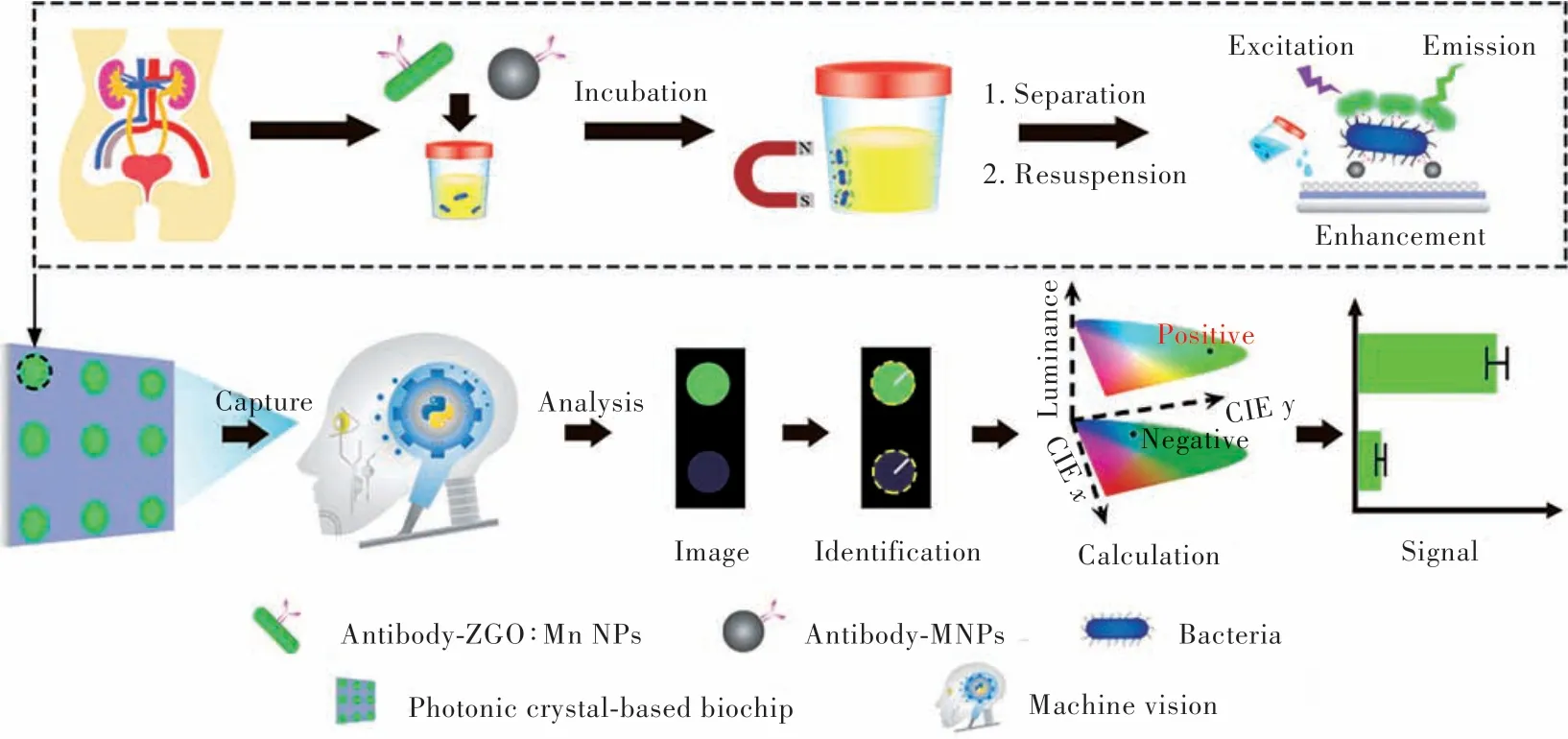
图2 基于机器视觉的诊断系统用于检测尿液样本中细菌示意图Fig.2 Schematic illustration of a machine vision-based diagnostic system for detecting bacteria in urine samples
尽管纳米长余辉发光材料在生物医学检测中得到了广泛的应用,但仍然存在一些问题,比如目前纳米长余辉发光材料大多都是应用于单一生物标志物的检测。因此,需开发多波长发射的纳米长余辉发光材料实现对多种生物标志物的检测。
2.2 生物成像
荧光成像是监测体内生物活动最常用的手段之一。然而,传统的荧光探针在用于体内成像时需原位激发,会产生背景荧光信号的干扰,从而影响成像的灵敏度和准确性。作为一种无需原位激发的纳米材料,纳米长余辉发光材料由于其具有长余辉寿命,能够有效地避免组织背景荧光信号的干扰,从而提高成像的灵敏度。本小节将从纳米长余辉发光材料的激发波长和余辉发射波长介绍其在生物成像中的应用进展。
2007年,Scherman等[50]利用溶胶-凝胶法合成了一种近红外发射Ca0.2Zn0.9Mg0.9Si2O6∶Eu2+,Dy3+,Mn2+纳米长余辉发光材料,首次在小鼠体内实现了“免激发”余辉成像,其余辉能在体内持续1 h以上。随后,不同类型的纳米长余辉发光材料被合成并应用于体内成像。然而,对于体内长期成像来说,这些纳米长余辉发光材料还存在着在应用于体内成像前需用紫外光来激发这一瓶颈,这在某种程度上影响了体内成像的效果。2014年,Richard等[51]合成了新一代的ZnGa2O4∶Cr纳米长余辉发光材料,其在体内能被白色LED灯反复激发,有效地解决了这一瓶颈。随后,基于镓酸锌铬的纳米长余辉发光材料被广泛合成并应用于体内成像。Yuan等[52]通过水热法合成了一种粒径和余辉性能可调的Zn1+xGa2-2xGexO4∶Cr(ZGGO∶Cr,0≤x≤0.5)纳米长余辉发光材料应用于肿瘤靶向成像。体内成像结果表明,与传统利用荧光染料和量子点用于肿瘤成像相比,ZGGO∶Cr纳米颗粒能有效地消除背景信号干扰且能显著提高纳米颗粒在肿瘤部位的富集,实现了对乳腺癌无背景荧光信号干扰的靶向成像(图3)。

图3 ZGGO∶Cr纳米长余辉发光材料(左)、荧光染料(中)和Ag2Se QDs(右)用于体内肿瘤成像的比较Fig.3 The comparison of ZGGO∶Cr PLNPs(left), fluorescent dye(middle), and Ag2Se QDs(right) for tumor imaging in vivo
尽管上述研究工作有效解决了纳米长余辉发光材料在体内成像需预先激发的瓶颈,但可见光用于生物成像还存在组织穿透深度不足的瓶颈。基于此,Han等[53]将纳米长余辉发光材料与上转换纳米颗粒进行有机结合,在980 nm的近红外光激发下,上转换纳米颗粒发射出来的光激发纳米长余辉发光材料用于体内成像。Yang等[54]合成了一种X射线激发的SrAl2O4∶Eu2+纳米长余辉发光材料用于体内成像且能被X射线反复激发,有利于体内长期成像。Chen等[55]合成了一种立方尖晶结构的ZnGa2O4∶Cr3+纳米长余辉发光材料用于肝脏肿瘤成像。在紫外光和X射线激发下,颗粒表现出优异的余辉性能。尾静脉注射到小鼠体内后,对原位肝脏肿瘤具有很好的被动靶向性,低剂量的X射线激发产生的余辉可以对肝脏深部肿瘤进行成像。Liu等[56]开发了一种低剂量X射线激发的LaGaO3∶Sb,Cr纳米长余辉发光材料用于深层组织反复成像。简单通过共掺杂与粒径不匹配的Sb3+离子来优化主体中氧空位浓度,从而提高纳米颗粒的余辉性能,其余辉性能达到500 h。体内生物成像结果表明,极低剂量X射线(0.37 Gy)在体内就可以激发纳米颗粒实现可反复激发的体内生物成像,这一策略将为开发低剂量X射线激发的纳米长余辉发光材料提供有用的指导。
为了解决利用紫外线、可见光或X射线作为激发光源激发纳米长余辉发光材料所面临着组织穿透深度有限或辐射对正常组织造成损伤等挑战, Sun等[57]将纳米长余辉发光材料ZGC与肿瘤成像放射性药物18F-氟代脱氧葡萄糖(18F-FDG)相结合,放射性核素通过切伦科夫共振能量转移和电离辐射有效地激发纳米长余辉发光材料进行成像。由于18F-FDG具有高的肿瘤特异性,可以选择性地激发肿瘤部位ZGC纳米颗粒进行成像。这种策略不仅可以提高成像的灵敏度、对比度和衰减时间,而且可以减少患者在放射性核素的暴露时间。尽管上述研究有效地解决了纳米长余辉发光材料激发波长的难题,但目前所报道的纳米长余辉发光材料的余辉发射波长大多集中在近红外一区,成像深度有限。针对纳米长余辉发光材料余辉发射波长的问题,Zhang等[58]通过水热法合成了余辉发射在800 nm的ZnSn2O4∶Cr,Eu超小纳米长余辉发光材料,其在体内能被808 nm的近红外光再次激发。Zhang等[59]利用高温溶剂热分解法首次合成了一种X射线激发的近红外二区发射纳米长余辉发光材料,其余辉发射波长可通过在NaGdF4纳米粒子中加入不同镧系元素掺杂剂进行调节,一并解决了纳米长余辉发光材料的激发波长和余辉发射波长这两个难题。通过尾静脉注射到小鼠体内后,纳米长余辉发光材料在血管成像、肿瘤成像、成像介导下的输尿管术中识别和活体脏器多重成像中表现出更高的信噪比和分辨率(图4)。
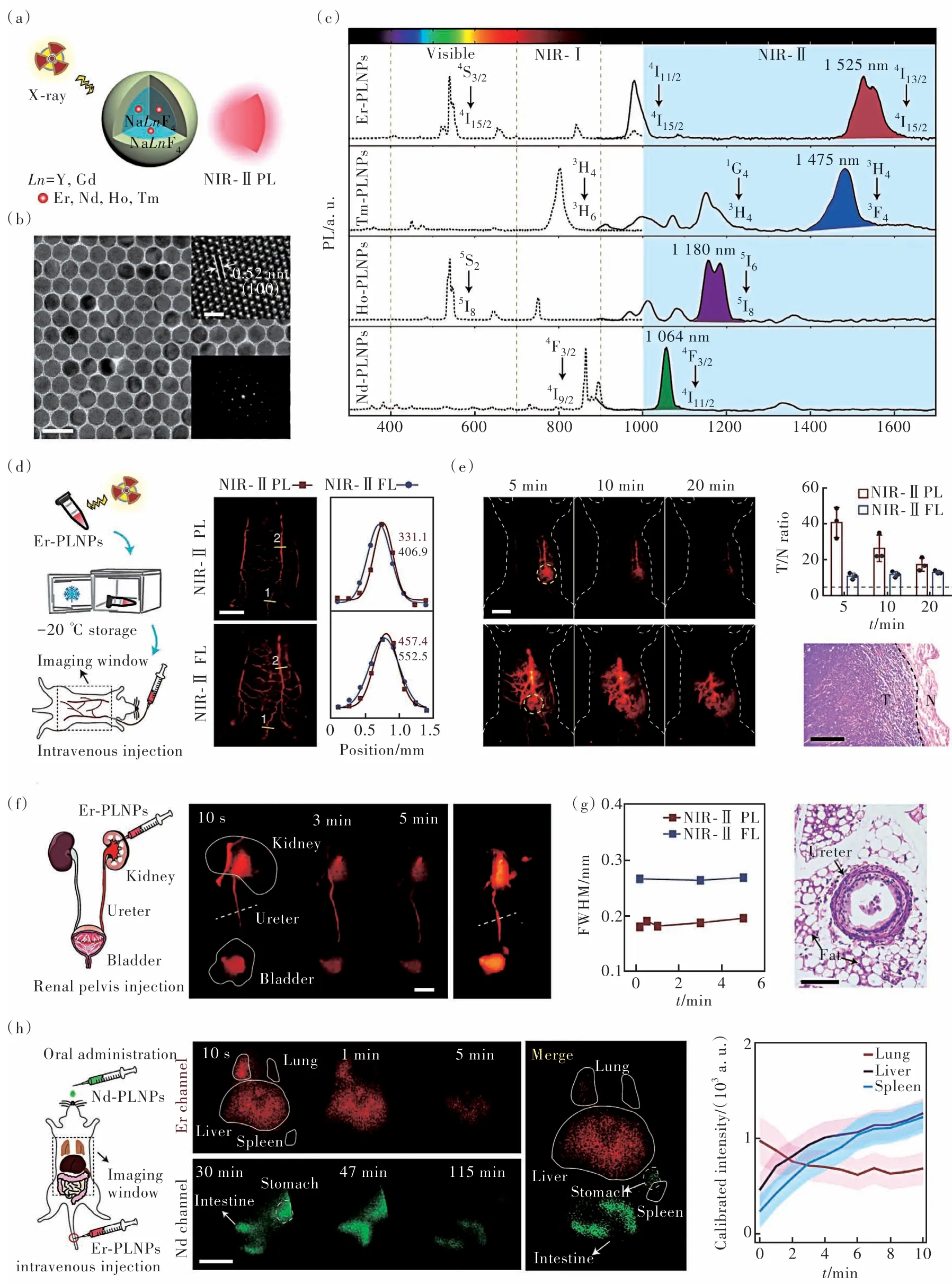
图4 (a)X射线激发的近红外二区发射纳米长余辉发光材料示意图;近红外二区发射纳米长余辉发光材料的透射电镜图(b)和余辉发射光谱(c);近红外二区发射纳米长余辉发光材料用于血管成像(d)和肿瘤成像(e);余辉成像介导下的输尿管术中识别((f)~(g))和小鼠主要器官的多重成像(h)Fig.4 (a)Schematic illustration of the X-ray activated near infrared Ⅱ(NIR-Ⅱ) emission persistent luminescent nanoparticles(PLNPs). TEM image(b) and the afterglow emission spectra(c) of the NIR-Ⅱ emission PLNPs. The vascular(d) and tumor(e) afterglow imaging from mice injected with the NIR-Ⅱ emission PLNPs. (f)-(g)Afterglow imaging-guided ureteral identification. (h)Multiplexed NIR-Ⅱ afterglow imaging of the main organs of the mice
每种成像技术都有其特点、优势和局限性。因此,多模态成像可以弥补不同成像方法之间的劣势,从而为疾病诊断提供更准确、完整和可靠的图像信息[60-61]。因此,研究人员将纳米长余辉发光材料与其他成像模式结合,进行体内双模态或多模态成像。2014年,Yan等[62]将Gd-DTPA修饰在Zn2.94Ga1.96Ge2O10∶Cr3+,Pr3+纳米颗粒表面,在体内实现了余辉和磁共振双模态成像。Richard等[63]通过掺杂方式将钆离子与纳米长余辉发光材料结合,系统考察了不同钆的掺杂量对纳米颗粒余辉和弛豫性能的影响。通过尾静脉注射到小鼠体内后,实现了对肝脏的余辉/磁共振成像。Li等[64]利用可降解介孔硅为模板合成了一种可肾清除、单分散、粒径可调、形貌规则的纳米长余辉发光材料用于体内余辉和磁共振成像(图5)。尾静脉注射到小鼠体内后,超小的纳米长余辉颗粒能通过肾代谢出体内,该策略有效地解决了在生物医学应用中纳米长余辉发光材料的“尺寸”和“体内代谢”这两个关键问题,为无机纳米长余辉发光材料的合成提供了一种新方法和新思路。Lu等[65]将TaOx修饰在纳米长余辉发光材料表面用于肿瘤的余辉/CT成像。除了双模态成像,Liu等[66]还开发了一种基于GdAlO3∶Mn4+,Ge4+@Au纳米颗粒的多模态成像探针,用于体内余辉/CT/MR成像。
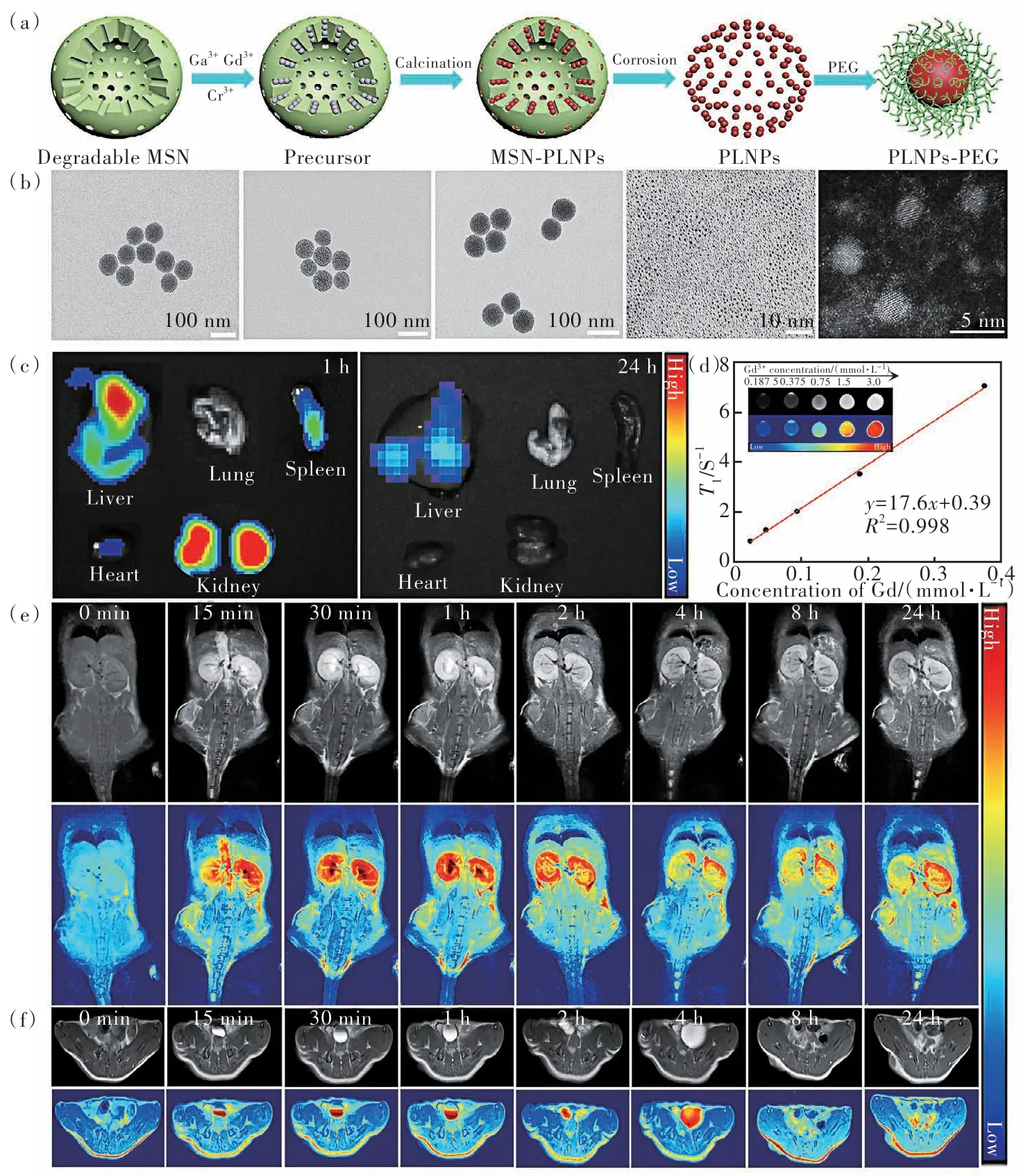
图5 (a)超小纳米长余辉发光材料合成示意图;(b)每一步反应后纳米颗粒的透射电镜图:可降解介孔硅、吸附前体后介孔硅、高温煅烧后介孔硅-纳米长余辉发光材料复合物、超小纳米长余辉发光材料和聚乙二醇修饰超小纳米长余辉发光材料;(c)不同时间点小鼠主要器官的体外余辉成像;(d)超小纳米长余辉发光材料的纵向弛豫率和T1加权成像;(e)~(f)超小纳米长余辉发光材料体内磁共振成像Fig.5 (a)Schematic illustration of the synthesis of the ultrasmall PLNPs. (b)TEM images of the nanoparticles after each step:the degradable mesoporous silica nanoparticles(MSN),MSN labeled by the precursor of the PLNPs, MSN-PLNPs complex after high temperature calcination,the ultrasmall PLNPs, the ultrasmall PLNPs modified by polyethylene glycol(PEG). (c)The afterglow imaging of the main organs of the mice at different time points in vitro. (d)The longitudinal relaxation rate(r1) and T1-weighted imaging of the ultrasmall PLNPs. (e)-(f)The magnetic resonance imaging at different time intervals after intravenous injection of the ultrasmall PLNPs
目前,纳米长余辉发光材料应用体内生物成像大多集中在近红外Ⅰ区,近红外Ⅱ/Ⅲ发射的纳米长余辉发光材料的研究较少,需开发近红外Ⅱ/Ⅲ发射的纳米长余辉发光材料应用体内成像,提高成像的组织穿透深度和灵敏度。
2.3 成像介导下肿瘤治疗
肿瘤是威胁人类健康的主要疾病之一,早期诊断和治疗对提高患者生存率具有重要意义[67]。近年来,纳米技术广泛应用于肿瘤诊疗领域。鉴于纳米长余辉发光材料独特的光学性质,其与其他功能性物质(化疗药物、光热转换剂、光敏剂或免疫药物)的结合,将为肿瘤的早期诊断和治疗提供一种新方法和新思路[68-69]。本小节将从化疗、光热治疗、光动力治疗和免疫治疗四个方面介绍纳米长余辉发光材料在肿瘤治疗中的应用(表2)。

表2 纳米长余辉发光材料用于肿瘤治疗的四种方法优缺点比较Tab.2 The comparison of the PLNPs for tumor therapy
2.3.1 化疗
化疗是目前临床上最常用治疗癌症的方法之一,但存在着靶向性差、副作用大和耐药等缺点,对正常组织损伤较大。因此,许多基于纳米颗粒的药物递送系统被开发用于肿瘤的成像与化疗,实现了对治疗的实时监测。介孔硅(MSN)由于其具有良好的生物相容性和低毒性,是一种经典且广泛应用的药物递送载体。基于此,Zhang等[70-71]利用介孔硅的孔道负载纳米长余辉发光材料的前体离子,然后再在高温条件下煅烧,形成MSNPLNPs复合物。未被占据的介孔硅的孔道用于负载抗癌药物阿霉素用于余辉成像介导下肿瘤化疗。Zhao等[72]合成了一种组织蛋白酶B/谷胱甘肽双重响应MSN-PLNPs药物递送系统用于肿瘤的余辉成像和化疗。Feng等[73]开发了一种草莓状结构的介孔Zn1.07Ga2.34Si0.98O6.56∶Cr0.01(Si-ZGO)纳米药物载体用于肿瘤增强的余辉成像和化疗。尽管利用介孔硅为模板所合成的纳米长余辉发光材料复合物能进行药物递送,但纳米长余辉发光材料的前体离子会事先占据介孔硅的孔道,这在某种程度上影响药物的负载量或其他功能性物质的负载,进而影响肿瘤治疗的效果。为了解决纳米长余辉发光材料载药量的问题,Wang等[74]利用碳球为模板合成了一种中空、粒径可调和近红外发射的纳米长余辉发光材料用于肿瘤化疗和光动力治疗(图6),其中空的结构具有高的药物负载量。体内试验结果表明,与单独的阿霉素相比,负载了阿霉素的中空纳米长余辉发光材料能实现余辉成像介导下肿瘤化疗且显著抑制肿瘤的生长。除了利用介孔硅和碳球为模板外,Zhao等[75]利用金属有机框架(Metal organic frameworks, MOFs)包裹纳米长余辉发光材料合成PLNPs@MOFs核壳结构,利用MOFs的多孔结构负载抗癌药物阿霉素用于余辉成像介导下的肿瘤化疗,成功地实现了肿瘤部位特异性药物释放和余辉成像。Chen等[76]构建了脂质体包裹纳米长余辉发光材料(Lipo-PLNPs)作为一种新型余辉成像介导下的药物载体用于肿瘤化疗。形成的Lipo-PLNPs复合物具有优异的余辉性能和高的药物负载效率,在体内能够实现对药物载体的长期示踪,并对肿瘤具有显著的治疗效果。
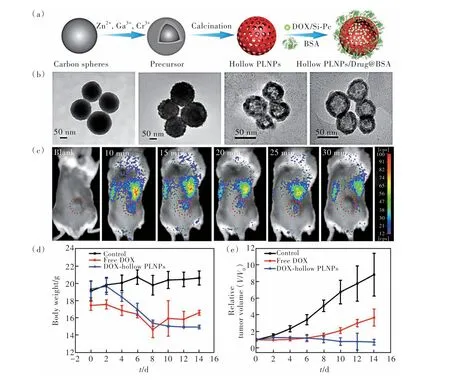
图6 (a)中空纳米长余辉发光材料的合成和功能化示意图;(b)每一步修饰纳米颗粒的透射电镜图:碳球、碳球吸附纳米长余辉发光材料前体离子、中空纳米长余辉发光材料、牛血清白蛋白(BSA)修饰中空纳米长余辉发光材料;(c)尾静脉注射中空纳米长余辉发光材料到4T1荷瘤小鼠后在肿瘤部位不同时间点的余辉成像图;不同处理后小鼠身体重量(d)和肿瘤体积的变化曲线(e)Fig.6 (a)Schematic illustration of the synthesis and functionalization of the hollow PLNPs. (b)TEM images of the nanoparticles after each step: carbon spheres, carbon spheres labeled by the precursor of the PLNPs, hollow PLNPs, the hollow PLNPs modified by bovine serum albumin(BSA). (c)The afterglow imaging of the tumor at different time points after intravenous injection of the hollow PLNPs. The body weight(d) and tumor growth curves(e) after different treatments

图7 (a)超声充电的纳米长余辉发光材料合成示意图及其用于肿瘤治疗的机理;不同处理后肿瘤体积(b)和生存率(c)变化曲线Fig. 7 (a)Schematic illustration of the synthesis and mechanism for tumor therapy of the ultrasound-chargeable PLNPs. The tumor growth curves(b) and survival rate(c) after different treatments
2.3.2 光热治疗
光热治疗作为治疗肿瘤的一种新型方式,其原理是光热转换剂将吸收的光能转换成热能从而杀死肿瘤细胞,具有非入侵性、副反应小和靶向性等优点[77-78]。Chang等[79]开发了一种可在体内反复激发的ICG@mZGC纳米颗粒,并成功地将光热转换剂吲哚靛青绿(Indocyanine green,ICG)负载到mZGC纳米颗粒中,用于余辉成像介导下的肿瘤光热治疗。体内实验结果表明,ICG@mZGC纳米颗粒能降低背景信号干扰,提高肿瘤部位成像的信噪比。在808 nm近红外光照射下,产生的光热效果能显著抑制肿瘤的生长。为了不影响ICG的负载量,该课题组利用类似的原理在合成介孔硅的过程中将纳米长余辉发光材料的前体离子掺杂在介孔硅的结构里形成mSiO2@PLNPs复合物,然后再负载ICG,实现余辉成像介导下的肿瘤光热治疗[80]。Wang等[81]利用介孔硅包裹纳米长余辉发光材料Zn1.25Ga1.5Ge0.25O4∶Cr3+,Yb3+,Er3+(ZGGO),然后将光热荧光染料IR825和化疗药物伊立替康依次负载到介孔硅的孔道里,最后用肿瘤细胞膜-巨噬细胞膜包裹,所形成的纳米复合物尺寸均一。体外实验结果表明纳米复合物表现出优异的免疫逃逸能力和肿瘤靶向能力,有利于纳米颗粒在体内的循环时间和肿瘤部位的靶向聚集。体内抗肿瘤实验结果表明,该纳米复合物可以对结直肠癌进行精准成像和联合化疗/光热治疗。为了解决肿瘤细胞可及性和间歇性光激发的难题,Li等[82]开发了一种利用纳米长余辉发光材料的余辉激发光热治疗,并同时实现热泳推动运动和余辉触发的一氧化氮(NO)释放的肿瘤诊疗一体化平台(图7)。与常用的660 nm和808 nm的间歇性近红外照射相比,超声激活的纳米颗粒的持续运动可以增强细胞摄取、持久的光热治疗以及增加细胞内一氧化氮(NO)水平,在不使用任何化疗药物的情况下杀死肿瘤细胞。此外,超声激活的持续运动促进纳米颗粒在肿瘤部位富集和分布,并表现出比近红外光照射更高的肿瘤生长抑制、更长的动物存活时间和更高的瘤内NO水平。该策略所构建的纳米马达为深层肿瘤的光学治疗提供了一个有效的策略。
2.3.3 光动力治疗
光动力治疗是一种新型的肿瘤治疗方法,其原理是光敏剂在特定波长的激光照射下产生活性氧从而杀死肿瘤细胞[83-85]。目前,传统的光动力治疗需要光源持续激发光敏剂,光源的长时间照射可能会对正常组织造成损伤,而且激发光源的组织穿透深度有限,不利于对深层肿瘤的治疗。纳米长余辉发光材料具有外界光源所不具有的优势,如不需要激发光源的持续激发、余辉寿命长、无组织穿透深度的限制和在体内能被反复“充电”,从而实现深层组织的PDT。例如,Yang等[86]开发了一种掺杂W(Ⅵ)的ZnGa2O4∶Cr PLNPs,与传统的ZnGa2O4∶Cr PLNPs相比,它具有更强的持续发光强度和更长的持续发光时间。体外和体内实验均证明,低剂量(0.18 Gy)X射线照射足以激活PDT纳米平台,并对肿瘤生长产生显著的抑制作用。因此,这种X射线激发的纳米长余辉发光材料介导的PDT纳米平台因其高效、低辐射剂量和深组织穿透深度在肿瘤诊疗一体化中具有巨大应用潜力。Liu等[87]构建了ZGGO∶Cr,Bi@mSiO2-ZnPc纳米平台,用于原位成像引导的PDT。在635 nm激光照射10 min后,体外小鼠肝癌细胞存活率为18%,体内肿瘤抑制率为80%。Fan等[88]构建了一种可注射的ZGC植入物,其余辉强度和时间远大于单独的ZGC纳米颗粒。更重要的是,通过在体外和体内与水接触后的快速液固相变,ZGC植入物被牢牢地固定在肿瘤组织内,在体内具有极高的余辉稳定性,可实现重复“充电”(LED激发)过程,在LED灯照射下能有效地抑制肿瘤的生长。Liu等[89]开发了一种温度响应的“蜡封”诊疗平台用于余辉成像介导下光热激发的肿瘤PDT(图8)。用油酸和十六醇将纳米长余辉发光材料ZnGa1.996O4∶Cr0.004和光敏剂IR780进行“蜡封”,可以增强颗粒的余辉性能和避免过早开始PDT,减少对正常组织的伤害。纳米颗粒在体内光热激活后,产生的余辉持续激发光敏剂产生活性氧,从而杀死肿瘤细胞,抑制肿瘤生长。这一研究不仅为基于纳米长余辉发光材料的用于肿瘤持续性PDT提供了一种通用策略,还为建立光热触发给药系统应用于生物医学领域提供了有效的依据。
2.3.4 免疫治疗
临床上治疗肿瘤的主要方法是:化疗、放疗和手术切除。从理论上讲,如果肿瘤组织被完全切除,癌症是可以治愈的,但许多癌症在被发现之前就已经转移。放疗可杀死大部分肿瘤细胞,但有些肿瘤细胞仍保持微转移,难以彻底根除。化疗在杀死肿瘤细胞的同时会对正常细胞造成损害。肿瘤免疫治疗是通过特异性激活机体的自身免疫系统来杀伤肿瘤细胞,被认为是治疗肿瘤最有潜力的方法之一,具有安全性、特异性、持久性和适应症广等特点[90-92]。基于此,Wang等[93]开发了一种持续性抗肿瘤纳米免疫刺激剂ZGS-Si-Pc@HA,在695 nm激光照射下可持续产生活性氧诱导免疫原性细胞死亡,引起持久的肿瘤特异性免疫反应(图9)。体内实验结果表明,ZGS-Si-Pc@HA有效地缓解了免疫耐受,促进了细胞毒性T淋巴细胞肿瘤浸润。此外,当与免疫检查点抑制剂(anti-PD-L1)联合治疗后,能够有效地抑制双侧肿瘤的生长并引发免疫记忆效应。Li等[94]开发了一种利用中性粒细胞递送纳米敏化剂用于超声增强的胶质母细胞瘤化疗和免疫治疗。纳米敏化剂由用于余辉成像的纳米长余辉发光材料ZnGa2O4∶Cr3+(ZGO)为核和中空二氧化钛(TiO2)壳(声敏剂)组成。多孔ZGO@TiO2负载免疫检查点抑制剂抗PD-1抗体来缓解胶质母细胞瘤的免疫抑制。负载紫杉醇(Paclitaxel,PTX)的脂质体作为材料的最外层,以实现对胶质母细胞瘤的化学抑制。尾静脉注射后,在超声波的作用下,产生的活性氧导致脂质体外层被破坏,释放的PTX和抗PD-1抗体杀死肿瘤细胞并诱导局部炎症,进而诱导更多的纳米颗粒迁移至肿瘤部位增强对胶质母细胞瘤的治疗。体内实验结果表明,小鼠的存活率从0%提高到40%,并为肿瘤复发提供了长期的免疫监测能力,为胶质母细胞瘤和其他癌症的精确治疗提供了一种新的途径。
综上所述,纳米长余辉发光材料与其他功能性物质的结合为肿瘤的治疗提供了一种新的思路,但其在肿瘤的治疗方面大多是作为肿瘤成像的一种手段,其对肿瘤的治疗大多需要与其他功能性物质进行有机结合,况且自身具有功能性纳米长余辉发光材料的探索很少。因此,合成自身具有肿瘤治疗功能(光热、光动力等)的纳米长余辉发光材料有利于拓展其在肿瘤治疗领域的应用。
3 结论与展望
本文系统地总结了近年来纳米长余辉发光材料在生物医学检测、成像和肿瘤治疗应用方面的最新研究进展。由于其长余辉寿命、无需原位激发、无组织背景信号干扰和高信噪比,在生物医学领域受到了广泛的关注。尽管纳米长余辉发光材料在生物医学领域取得了巨大的进步,但仍需要在以下方面进一步研究:
(1)材料的合成。尽管纳米长余辉发光材料的合成取得了巨大进步,但目前合成纳米长余辉材料的方法只是部分地改善了其性质,仍面临着其他挑战,比如可控合成新的激发和发射带的纳米长余辉发光材料、探索新的发光中心和基质等。
(2)材料的生物安全性。目前纳米长余辉发光材料都掺杂了各种过渡金属离子或稀土离子,可能对正常组织有毒副作用,需进行深入的毒理学研究,例如通过基因组学、蛋白组学和代谢组学的方法进一步考察纳米长余辉发光材料在基因、蛋白质和代谢水平上的毒理学行为。
(3)余辉的发射波长。目前报道的近红外纳米长余辉发光材料大多集中在近红外Ⅰ区域(<900 nm)。在近红外Ⅱ/Ⅲ区域的研究较少,而该区域的组织穿透深度和成像能力更好。因此,需要加强对近红外Ⅱ/Ⅲ区域发光材料的研究。此外,近红外Ⅱ/Ⅲ发射的纳米长余辉发光材料的研究也受限于没有商用的成像仪器,开发相对应的商业化仪器可能会进一步拓展其在生物医学领域的应用。
(4)生物医学应用的局限性。目前,纳米长余辉发光材料大多应用在肿瘤诊断,能否将其拓展到其他疾病的治疗上,如神经调控、细胞信号传导等;其次,在生物医学检测方面,需开发多波长发射的纳米长余辉发光材料实现多种物质的分析或开发余辉发射波长在近红外Ⅱ/Ⅲ区的纳米长余辉发光材料用于生物标志物的检测,从而提高检测的灵敏度。
(5)临床转化。从应用的角度来看,尽管纳米长余辉发光材料在生物医学领域的研究取得了很大进展,但这些材料的研究大多集中在实验室研究上。因此,纳米长余辉发光材料在生物医学领域面临的最大挑战是从实验室研究向临床试验转化。为了从实验室研究转向临床试验,未来还需要更多的努力。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20230300.
