经导管主动脉瓣置换术后新发传导阻滞的危险因素分析及预测
2024-03-11刘家乐陈泽伟易岩峰唐一瑞方臻飞
刘家乐 陈泽伟 易岩峰 唐一瑞 方臻飞
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)作为心脏瓣膜病中的一项重要介入技术已迅速获得认可,适用于主动脉瓣狭窄(aortic stenosis,AS)的高危患者。虽然TAVR的器械在不断更新换代,整体术后并发症发生率也处于下降趋势,但术后新发传导阻滞(new-onset conduction disturbance,NOCD)的发生率仍居高不下,平均永久性起搏器(permanent pacemaker implantation,PPM)植入率为13%[1-2]。最新一项荟萃分析显示,TAVR术后NOCD会增加心血管事件的发生风险及长期死亡率[3]。
尽管国外对TAVR术后NOCD的影响因素已有相关报道,包括患者的性别、主动脉瓣复合体钙化分布、瓣环直径、是否存在右束支传导阻滞等[1,4-5],但由于国内AS患者具有二叶瓣畸形高发和瓣膜钙化较为严重的特点,区别于欧美国家患者的解剖特征。同时,国内市场上使用的经导管心脏瓣膜与国外同类产品在许多方面均存在显著不同。鉴于此,开展专门针对国内患者的NOCD预测因素研究对于指导临床治疗尤为关键[6-8]。因此,本研究旨在通过对TAVR术后患者的临床数据进行深入统计分析,以识别相关的影响因素。对研究发现的影响因素进行多因素回归分析,对连续性变量设定界值,探究TAVR术后NOCD的独立危险因素,将其纳入风险预测模型,并对模型效能进行评价,用于指导临床应用,针对NOCD高风险人群进行TAVR手术策略的调整。
1 对象与方法
1.1 研究对象
本研究纳入2016年1月至2022年3月在中南大学湘雅二医院接受TAV R的患者作为研究对象,并对患者的临床资料进行回顾性分析。纳入标准:(1)主动脉瓣峰值流速≥4 m/s,或瓣口面积<1.0 cm2,或平均跨瓣压差≥40 mmHg(1 mmHg=0.133 kPa),或存在重度主动脉瓣反流;(2)患者接受TAVR;(3)完整的CT血管造影(CT angiography,CTA)图像和心电图数据。排除标准:(1)术前具有PPM植入的指征或已经植入PPM;(2)术前存在左束支传导阻滞(left bundle branch block,LBBB);(3)曾行外科主动脉瓣置换术(surgical aortic valve replacement,SAVR);(4)术中死亡或需要转为外科手术的患者。
200例患者中,2例术前已植入或需植入PPM,10例患有LBBB,1例曾行SAVR,3例在手术中转为外科手术或死亡。根据纳排标准,本研究最终纳入184例患者。以上信息收集均严格保密,且已通过中南大学湘雅二医院伦理委员会审批,患者及家属均签署知情同意书。
1.2 研究方法
1.2.1 超声心动图参数测定 对患者在TAVR术前使用经胸超声心动图,于胸骨旁左心室流出道长轴切面测定以下参数:左心室舒张末期内径、室间隔厚度、左心室射血分数、收缩期峰值流速、最大跨瓣压差、平均跨瓣压差、瓣口面积,同时统计是否存在单纯重度主动脉瓣反流,是否存在中度及以上的主动脉瓣、二尖瓣、三尖瓣反流,以及是否肺动脉压力≥35 mmHg。
1.2.2 CTA图像采集 术前行常规冠状动脉CTA,并用3-mensio软件完成测量并出具分析报告。使用模拟曲线法对患者瓣环的最小直径、最大直径、周长、面积进行测量,根据Sievers的分类标准确定瓣叶的类型[9],其中针对二叶式主动脉瓣,采用针对不同二叶式主动脉瓣类型的新标准化方法确定其瓣叶平面[10],随后测量主动脉角度及室间隔膜部长度。主动脉角度测量方式见图1。
1.2.3 TAVR手术影响因素 (1)测量人工瓣膜置入深度。①选择人工瓣膜完全释放并完成球囊后扩张或瓣中瓣置入后的影像序列进行测量。对于三叶瓣或Type 1型的二叶瓣,选择主动脉根部造影图像序列中的右冠状动脉中心位或左右冠状动脉重叠位;对于Type 0型二叶瓣,选择主动脉根部造影图像序列中双窦展开位的影像。②仔细查看所选图像序列,找到能清楚显示无冠窦底部的某一帧图像。③以无冠窦底部为起点,到无冠窦侧瓣架的入口为终点画线。对于无冠窦底部不清晰的图像,通过对比术前未置入人工瓣膜时的主动脉根部造影图像来准确定位无冠窦底部位置。测量方式见图2。(2)锚定区尺寸比定义为人工瓣膜锚定区与自身瓣环根据周长或面积所计算出的直径(以下简称“周长径”和“面积径”)之比。对于自膨胀式瓣膜,锚定区定义为瓣架底部上5 mm处瓣架周长径,锚定区尺寸比为锚定区与瓣环周长径比值;对于球囊扩张式瓣膜,锚定区尺寸比为人工瓣膜型号与瓣环面积径比值。

图2 人工瓣膜置入深度测量方式Figure 2 Schematic diagram of implantation depth measurement method
1.2.4 结局定义与分组 本研究将TAVR术后NOCD作为结局事件,分为NOCD组和非NOCD组。NOCD定义为TAVR术后新发高度或三度房室传导阻滞或LBBB,并持续至出院前。心脏传导阻滞采用美国心脏病学会/美国心脏协会发布的2019年心动过缓和心脏传导阻滞患者管理指南中的定义[11]。(1)三度房室传导阻滞定义为房室分离或心房颤动伴持续性室性缓慢节律(<50次/分)。(2)高度房室传导阻滞的心电图特征包括:二度2型房室传导阻滞且QRS波≥120 ms;2∶1房室传导阻滞且QRS波≥120 ms;连续2个以上P波未传至心室;短暂性的三度房室传导阻滞;心房颤动伴心脏停搏>3 s或心室率<50次/分。(3)LBBB的心电图特征包括:QRS波≥120 ms,I、V5、V6导联R波宽大无Q波,V1、V2导联宽QS波或rS波,以及T波与QRS主波相反。
1.3 统计学分析
所有数据使用SPSS 24.0软件及R语言版本4.2.1完成统计分析。对于呈正态分布的连续变量,使用均数±标准差表示,并通过Studentt检验进行组间比较。对于非正态分布的连续变量,则使用中位数(四分位数间距)[M(Q1,Q3)]表示,通过Mann-WhitneyU检验或Wilcoxon秩和检验进行组间比较。分类变量则用频次和百分比表示,并通过χ2检验或Fisher精确概率法进行组间比较。统计学显著性的阈值设定为双侧P<0.05。对于有显著统计学意义的连续性变量(P<0.05),以NOCD为终点,绘制受试者工作特征(receiver operating characteristics,ROC)曲线并计算曲线下面积(area under ROC curve,AUC),取约登指数最大时的变量值作为界值,并给出使用该界值预测的敏感度和特异度。将NOCD组和非NOCD组间存在显著统计学差异的影响因素(P<0.05)纳入单因素和多因素分析,根据多因素Logistic回归分析得出的独立危险因素构建对TAVR术后NOCD预测的模型,给出模型的效应指标,包括敏感度、特异度、阳性预测值、阴性预测值。
2 结果
2.1 两组患者基线资料的比较
184例患者平均年龄(72.7±5.4)岁,女80例(43.5%),身体质量指数(22.2±3.5)kg/m2。57例(31.0%)患者TAVR术后出现了NOCD(NOCD组),非NOCD组127例(69.0%)。NOCD组高血压病、慢性阻塞性肺疾病、冠心病患者比例略高于非NOCD组,而晕厥史、纽约心脏病协会(New York Heart Association,NYHA)心功能分级≥Ⅲ级、糖尿病、心肌梗死、高脂血症的患者比例略低于非NOCD组,但两组间差异均无统计学意义(均P>0.05,表1)。
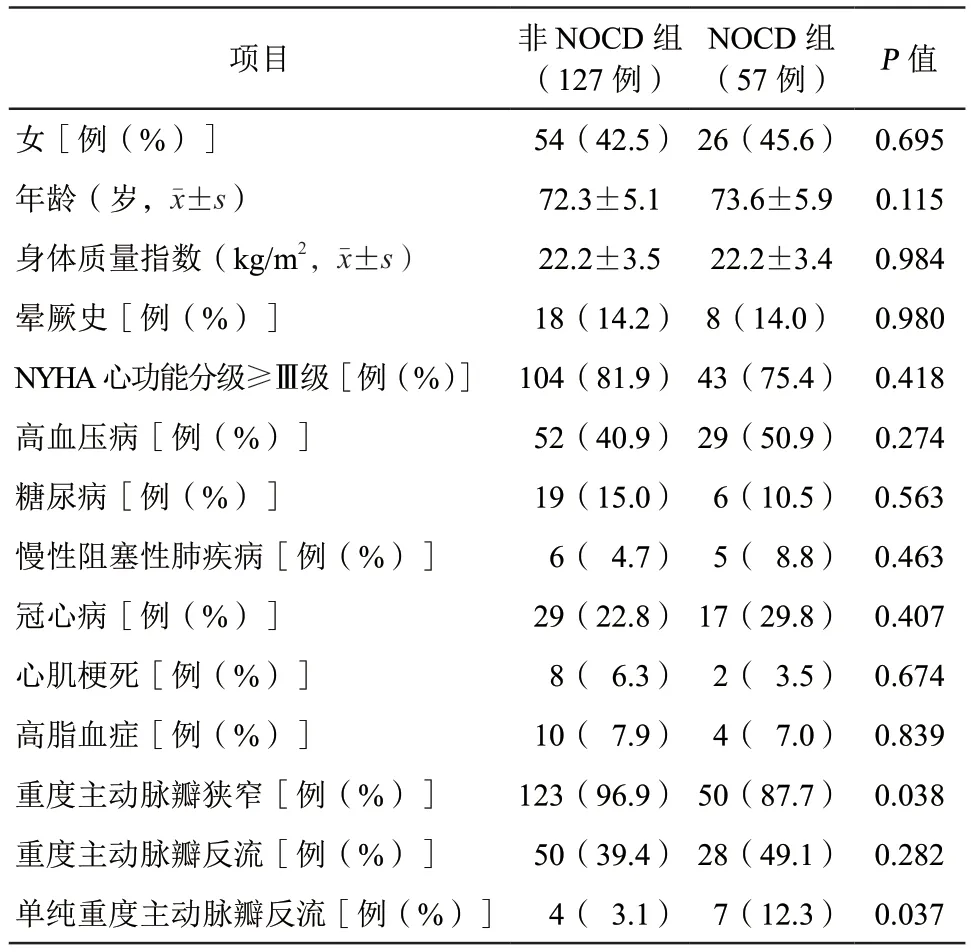
表1 两组基线资料及瓣膜病变类型比较Table 1 Comparison of baseline characteristics and valve disease between two groups
2.2 两组患者超声心动图参数比较
所有患者的左心室舒张末期内径(54±8)mm,左心房内径(42±6)mm,右心室内径(31±4)mm,室间隔或左心室后壁厚度(12±2)mm,升主动脉内径(37±5)mm,左心室射血分数(49±12)%。两组间各心腔大小以及左心室收缩功能比较,差异均无统计学意义(均P>0.05)。
184例患者中,173例诊断为重度AS(94.0%),主动脉瓣峰值流速为(501±86)cm/s,主动脉瓣最大跨瓣压差为(109±69)mmHg,主动脉瓣平均跨瓣压差为(60±22)mmHg,瓣口面积为(0.59±0.21)cm2,以上参数在NOCD组与非NOCD组间比较,差异均无统计学意义(均P>0.05)。NOCD组与非NOCD组重度AS比例比较,差异有统计学意义(87.7%.比96.9%,P=0.038)。NOCD组单纯重度主动脉瓣反流比例明显高于非NOCD组[12.3%比3.1%,P=0.037],差异有统计学意义(表1)。
2.3 两组患者心电图参数比较
NOCD组和非NOCD组术前心电图的平均QRS波宽度、PR间期、心率等均处于正常范围值内。NOCD组术前一度房室传导阻滞低于非NOCD组[7.0%比11.8%,P=0.323],右束支传导阻滞[8.8%比6.3%,P=0.545]、心房颤动[24.6%比14.2%,P=0.086]高于非NOCD组,但差异均无统计学意义(表2)。
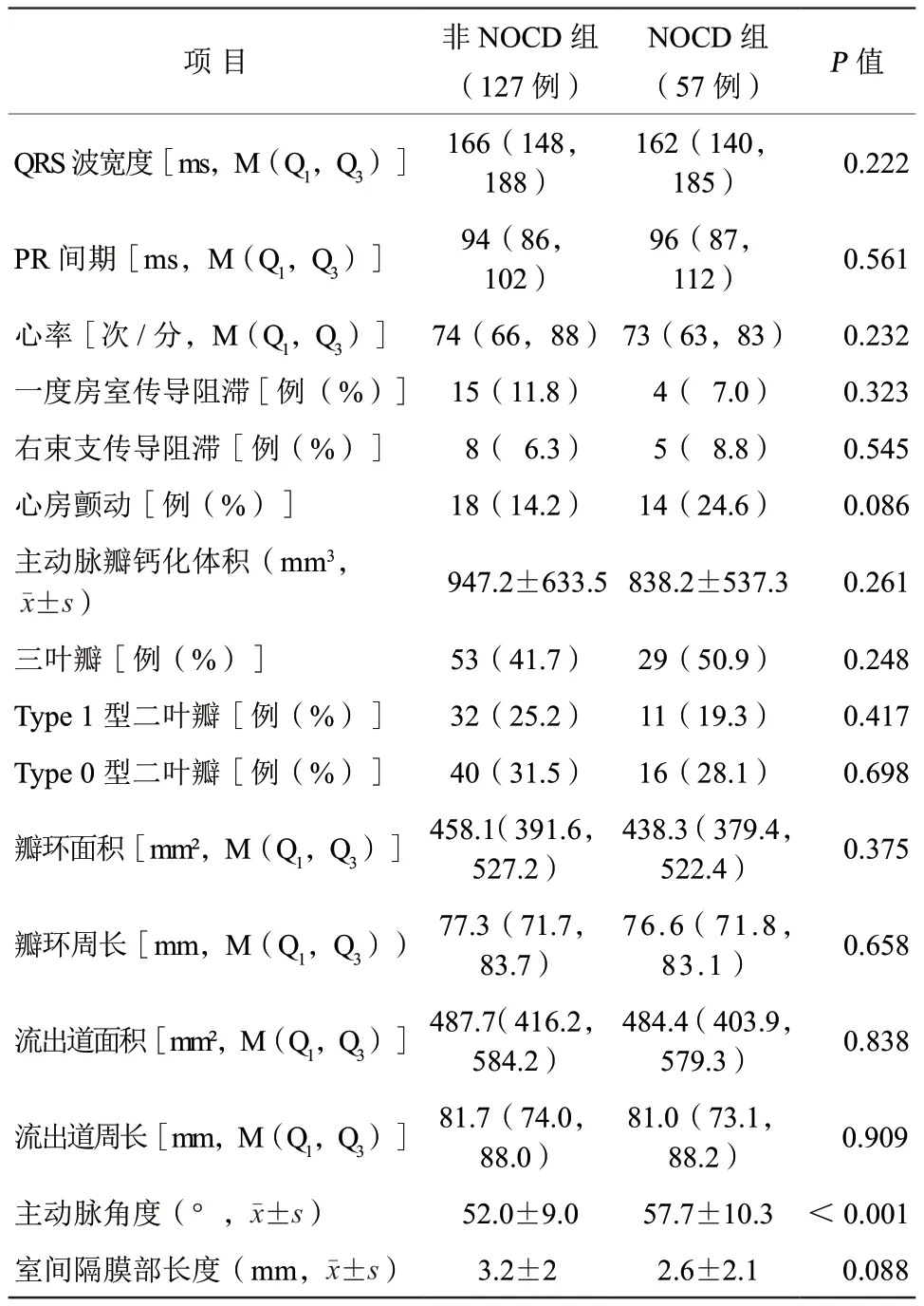
表2 两组心电图及CTA 解剖特征比较Table 2 Comparison of electrocardiogram and CTA anatomical features between two groups
2.4 两组患者CTA解剖特征比较
NOCD组三叶瓣略高于非NOCD组(50.9%比41.7%),Type 1型二叶瓣(19.3%比25.2%)和Type 0型二叶瓣(28.1%比31.5%)均略低于非NOCD组,但两组间主动脉瓣钙化体积、瓣叶分型、瓣环和流出道周长与面积、室间隔膜部长度比较,差异均无统计学意义(均P>0.05)。所有患者平均主动脉角度53.8°,NOCD组主动脉角度明显大于非NOCD组[(57.7±10.3)°比(52.0±9.0)°,P<0.001],差异有统计学意义(表2)。
2.5 两组患者手术因素及人工瓣膜类型比较
170例(92.4%)患者进行了球囊预扩张,88例(47.8%)患者进行了球囊后扩张,NOCD组球囊预扩张(86.0%比95.3%)和后扩张(40.4%比51.2%)较非NOCD组低,但仅预扩张比例两组间比较差异有统计学意义(P=0.028)。NOCD组有22.8%置入了瓣中瓣,略高于非NOCD组(18.9%),但差异无统计学意义。所有患者平均锚定区尺寸比(122±24)%,人工瓣膜平均置入深度(5.5±4.6)mm。NOCD组的锚定区尺寸比更大[(129±28)%比(120±21)%,P=0.018],且人工瓣膜的置入位置明显深于非NOCD组[(7.2±5.1)mm比(4.8±4.2)mm,P=0.001],差异均有统计学意义。两组不同人工瓣膜类型比例差异均无统计学意义(均P>0.05,表3)。

表3 两组手术策略比较Table 3 Comparison of surgical strategies between two groups
2.6 TAVR术后NDCD危险因素的回归分析及预测价值
将NOCD发生作为阳性预测结局,绘制主动脉角度、锚定区尺寸比、人工瓣膜置入深度的ROC曲线,3个因素AUC分别为0.665、0.616、0.642。通过计算约登指数,得到各因素诊断效能最高的界值:主动脉角度为54.5°,锚定区尺寸比为122.9%,人工瓣膜置入深度为5.7 mm。使用3个危险因素构建逻辑回归模型,评估对NOCD的预测价值,结果显示其预测价值高于单独危险因素,AUC 0.709(图3、表4)。单因素分析显示,NOCD组中单纯重度主动脉瓣反流患者的比例较高(OR4.31,95%CI1.21~15.35,P=0.016),锚定区尺寸比更大(OR2.11,95%CI1.11~4.03,P=0.022),更少进行球囊预扩张(OR3.29,95%CI1.09~9.98,P=0.028)。对单因素分析中NOCD组与非NOCD组存在显著差异的因素进行多因素回归分析显示, 主动脉角度>54.5°(OR3.78,95%CI1.86~7.63,P<0.001)和人工瓣膜置入深度>5.7 mm(OR3.39,95%CI1.68~6.85,P<0.001)为TAVR术后的独立危险因素(表5)。

表4 ROC 曲线效能Table 4 ROC curve effi ciency
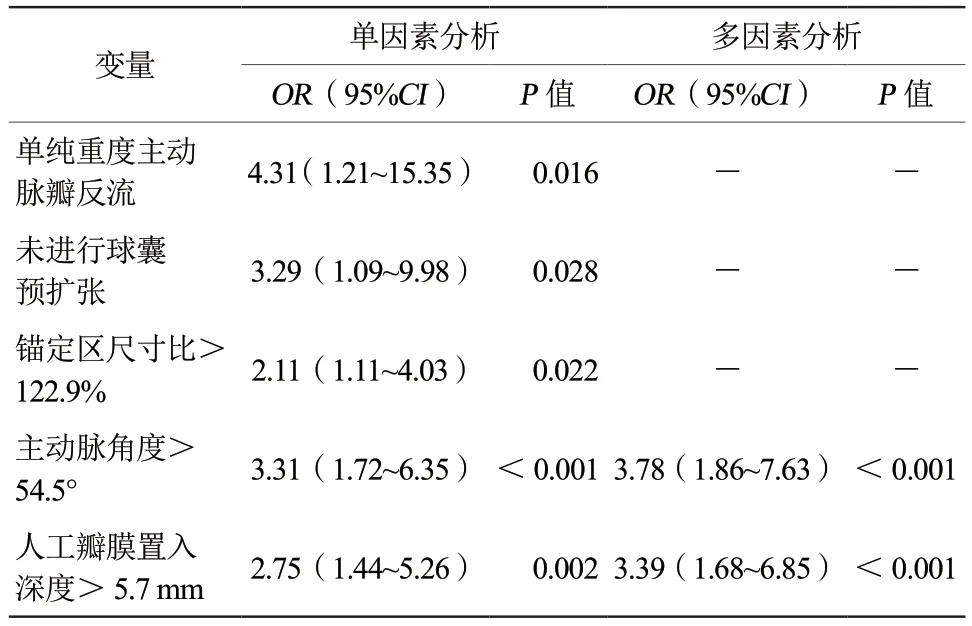
表5 TAVR 术后NOCD 危险因素的单因素和多因素Logistic 回归分析Table 5 Univariate and multivariate logistic regression analysis of risk factors for NOCD after TAVR
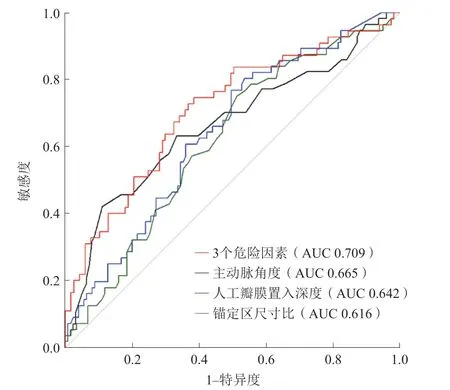
图3 各危险因素预测TAVR 术后NOCD 的ROC 曲线Figure 3 ROC curves of each risk factor predicting NOCD after TAVR
3 讨论
本研究主要发现如下:(1)TAVR术后NOCD发生率为31.0%,单纯重度主动脉瓣反流患者术后NOCD发生率为63.6%(7/11);(2)TAVR术后出现NOCD的患者存在更大的主动脉角度和锚定区尺寸比、更深的人工瓣膜置入位置的特点,并确立了上述因素用于预测NOCD的界值;(3)通过多因素回归分析得出主动脉角度>54.5°、人工瓣膜置入角度>5.7 mm是NOCD的独立危险因素,评估了各危险因素及多个危险因素的预测模型效能。
本研究中单纯重度主动脉瓣反流患者TAVR术后NOCD的发生率63.6%(7/11)相比于AS的患者28.9%(50/173)更高,这可能是由于所置入的人工瓣膜的尺寸更大、位置更深,通常需要更大的锚定区尺寸比来适应单纯重度主动脉瓣反流患者无钙化、限制结构少等特点[12-13]。Abramowitz等[14]研究表明主动脉角度大于48°会降低自膨胀式瓣膜的手术成功率,增加瓣周漏的发生风险。本研究中患者平均主动脉角度53.8°,可能是由于中国二叶瓣患者居多,主动脉横位心较为多见,因此主动脉角度较大[8]。本研究发现NOCD组与非NOCD组比较,主动脉角度差异有统计学意义(P<0.001),提示当主动脉角度超过一定范围时,TAVR术后NOCD的发生风险将增加。本研究结果显示,当主动脉角度达到54.5°时,NOCD的发生概率增加了3.78倍,表明这是NOCD的一个独立风险因素。此外,该预测因素的敏感度为0.632,特异度为0.669。
本研究结果表明球囊扩张式瓣膜的NOCD发生率低于自膨胀式瓣膜,可能是由于自膨胀式瓣膜瓣架较长、锚定区直径较大的特点,其NOCD发生率较高[15-17]。自膨胀式瓣膜的锚定区尺寸比通常位于120%以上,其目的主要是为患者提供更大的主动脉瓣口面积,同时减少瓣周漏的发生,但是主动脉瓣周结构会受到更大的压迫力量,如瓣架置入深度正好位于传导束水平,传导束受到更大的径向压力而发生NOCD[18-20]。Kiani等[18]根据731例置入Sapien 3的患者数据建立了预测TAVR术后PPM植入需求的危险评分,该项评分中锚定区尺寸比大于115.6%是PPM植入的独立预测因素(OR1.9,P=0.041)。然而本研究单因素分析中NOCD组锚定区尺寸比大于122.9%的比例较高(OR2.11,95%CI1.11~4.03,P=0.022),但在多因素回归分析中提示其对NOCD的发生无显著影响。
与SAVR通过缝合置入生物瓣的方式不同,TAVR是经过外周血管将生物瓣输送至心脏,通过金属支架将生物瓣膜锚定于主动脉瓣复合体,因此人工瓣膜底部会接触甚至压迫走行于主动脉瓣下的传导束。随着对TAVR术后NOCD的关注,人工瓣膜置入深度成为了多项研究关注的重点因素,也证实了置入越深,越容易发生NOCD这一观点[21-23]。本研究中人工瓣膜平均置入深度为(5.5±4.6)mm,NOCD组人工瓣膜的置入位置明显深于非NOCD组(P=0.001),也充分证实了这一观点。在本研究中,当置入深度超过5.7 mm时,被认定为NOCD的一个独立危险因素,同时这也是预测NOCD风险的最佳阈值。
通过多因素Log is t ic回归分析得出主动脉角度>54.5°和人工瓣膜置入深度>5.7 mm为TAVR术后的独立危险因素,并且具有一定预测价值。因此在临床实践中对于主动脉角度>54.5°的患者,TAVR术中应尽量高位或零位释放人工瓣膜,由于国产自膨胀式瓣膜瓣架展开后菱形网格通常为6 mm,因此可在自膨胀式瓣膜释放至功能位时对置入深度进行评价,如整个菱形格位于瓣环下方,则可认为会大大增加NOCD的发生率,应重新定位释放。
本研究作为单中心回顾性分析,仍存在一定的不足之处:(1)混杂因素偏多,研究人群使用了不同类型的人工瓣膜,病变类型和瓣叶分型也不一致,虽然得出了主动脉角度、人工瓣膜置入深度为独立预测因素,但是否适用于不同临床情形尚需进一步研究;(2)样本量不足,依然需要前瞻性、多中心的研究来进行验证;(3)本研究所涵盖的患者样本时间跨度较长,受到TAVR介入治疗技术、操作经验及心电图测量误差等因素的影响,研究结果在当前实际应用中可能存在一定程度的偏差。利益冲突 所有作者均声明不存在利益冲突
