校园餐厨垃圾初期降解生物气溶胶释放特征及健康风险研究*
2024-03-09刘彦君汤倩格李振坤王建兵
刘彦君,汤倩格,王 盛,李振坤,王建兵
(中国矿业大学(北京)化学与环境工程学院,北京 100083)
0 引言
随着垃圾分类的推广与实施,大量餐厨垃圾从生活垃圾中被分离出来,截至2020 年底,北京市家庭餐厨垃圾分出量已达4 248 t/d[1]。餐厨垃圾中含有大量的病原微生物,处理过程中不可避免会以生物气溶胶的形式进入空气中[2-4]。大量流行病学研究发现生物气溶胶暴露与人类健康存在显著的关联性[5-8],生物气溶胶可通过皮肤损伤、呼吸道等途径引发人类呼吸道感染、哮喘、SARS 等疾病,还可能导致传染病、过敏性疾病、神经系统疾病甚至是癌症[9]。目前垃圾最终处置过程生物气溶胶释放及其健康风险已得到了关注。Heo等[10]发现卫生填埋场的细菌浓度为848 CFU/m3。Malecka-Adamowicz 等[11]发现卫生填埋场临时堆放区的真菌气溶胶浓度为3 747.5 CFU/m3。垃圾处理处置工人的呼吸缺陷疾病发病率偏高,且易感染相关传染病[12]。华北地区某填埋场作业区及渗滤液处理区检出了莫拉菌(Moraxellaceae)等多种潜在致病菌[13],儿童哮喘的发生与莫拉菌属呈正相关[14]。加拿大魁北克某堆肥场中发现空气细菌浓度高达5.03×105CFU/m3,显著高于周边地区,增加了从业人员患呼吸道过敏性疾病或肠道疾病的风险[15]。Kaarakainen 等[16]证明了堆肥过程有机固废与生物气溶胶中的曲霉菌属(Aspergillus)和青霉菌属(Penicillium)有显著相关性[17]。
已有研究证实,城市环境空气中的致病菌与邻近的城市公共卫生及设施密切相关[18-19]。不同于垃圾填埋场,餐厨垃圾在校园内暂存时间短,处于初期降解阶段,气溶胶的释放与污染特征尚不明晰,其相关研究还很有限,目前卢冰洁等[20]对上海市生活垃圾房气溶胶中可培养细菌及奚豪[21]对杭州市某校园垃圾堆放点细菌和真菌气溶胶的研究已证明餐厨垃圾初期降解释放的生物气溶胶中确实存在一些致病菌。此外,大学校园属于人员集中、交流频繁的复杂场所,学生与工作人员在倾倒与处理餐厨垃圾的过程中存在生物气溶胶暴露风险,研究校园内生物气溶胶中可能存在病原菌将有助于校园垃圾的合理管理和控制。此外,目前有关垃圾处理过程细菌气溶胶的污染特性较多[7,22-23],而真菌相关研究较少。因此,针对校园餐厨垃圾初期降解过程释放的生物气溶胶的浓度粒径、群落结构、气溶胶化水平及对人体健康风险的影响开展研究,可为校园垃圾管理控制提供理论支持。
1 材料与方法
1.1 样品采集
于2023 年3 月24 日、4 月1 日、4 月7 日、7 月9 日、7 月16 日及7 月25 日在北京市某大学开展校园餐厨垃圾生物气溶胶样品采集,该采样点位于校园餐厅后,餐厅产生的餐厨垃圾临时存放于此,并于21:00 清运至垃圾转运站。采样点日常均堆放多个餐厨垃圾桶,堆放时间超过8 h,因此存在生物气溶胶扩散污染的问题。此外,该采样点是学生前往校园餐厅用餐的途经地,用餐高峰期人流量大,餐厨垃圾堆放于此会释放生物气溶胶,可能会对学生健康产生危害。使用中流量总悬浮颗粒物(Total Suspended Particulate,TSP)采样器(TW-2200A,青岛拓威,中国)于每个采样日的9:00 至18:00 将餐厨垃圾桶上方的非培养生物气溶胶采样至玻璃纤维膜上,采样高度1.5 m,采样流量100 L/min。每个采样日同时采集远离餐厨垃圾桶的环境空气TSP 样品作为对照。采样结束后将采样膜放入无菌铝箔,经高通量测序分析TSP 样品中微生物特征。
使用安德森六级采样器(JWL-6,北京中飞华正,中国)采集可培养生物气溶胶,采样流量28.3 L/min,高度1.5 m,采样时间10 min,每个采样日进行3 次平行采样和空白样品采集。安德森六级筛孔撞击式空气微生物采样器可模拟人体呼吸道的解剖结构及其空气动力学生理特征,将悬浮在空气中的微生物粒子按照不同粒径分别收集[24]。六级采样的有效截留粒径及对应的人体呼吸系统结构分别为7.0 μm(鼻腔)、4.7 μm(咽喉)、3.3 μm(气管和主支气管)、2.1 μm(次支气管)、1.1 μm (末端支气管) 和0.65 μm (肺泡)[25]。使用牛肉膏蛋白胨培养基采集可培养细菌气溶胶,沙氏葡萄糖培养基采集可培养真菌气溶胶。采样前用高压蒸汽灭菌锅对培养基进行灭菌处理(121 ℃,15 min)后装于直径90 mm 的培养皿中,并使用75% 酒精棉球擦拭采样器撞击盘。采样完成后,将所有培养皿盖上盖子,并立即运回实验室进行下一步的培养、计数。
采样同时测定并记录风速、风向、温度、湿度、云量、紫外强度等环境信息。采样结束后,使用四分法取500 g 餐厨垃圾称量各组分的质量并计算其占比,另采用相同方法取200 g 餐厨垃圾带回实验室进行理化分析,其中含水率和总固体含量采用烘箱烘干法测定,有机质含量采用灼烧法测定,pH 采用玻璃电极法测定,研究采集的餐厨垃圾主要成分为米面类(39.6%±2.7%)、蔬菜类(28.6%±2.5%)、蛋壳类(3.6%±0.8%)、肉骨头类(17.2%±6.4%)和水果类(11.0%±3.8%),其理化性质为含水率74.1%±2.2%、总固体含量25.9%±2.2%、有机质含量46.0%±8.4%、pH 5.7±0.3。
此外,每次采样均取10 g 混合均匀的餐厨垃圾对其中的微生物进行高通量测序。
1.2 微生物培养及计算
1.2.1 可培养微生物分析及计算方法
将采集到的细菌和真菌培养皿带回实验室分别于培养箱内37 ℃下培养48 h、25 ℃下培养96 h[26]。培养结束后统计每一级培养皿上的菌落数(Colony Forming Units,CFU),可培养空气微生物的浓度计算如式(1)所示:
式中:C为空气微生物总浓度(CFU/m3);T为六级总菌落数(CFU);t为采样时间(min);Q为空气流量(L/min)。
由于随着采样器捕获粒子数量的增加会导致出现粒子撞击在培养皿上同一位置的重叠情况,因此采用Positive-hole 法[24]对所捕获的各级细菌、真菌粒子进行校正,如式(2)所示:
式中:Pr为校正后的菌落数;r为实际的菌落数;N为采样器各级采样孔数。
1.2.2 非培养微生物分析及计算方法
采用16S rRNA 和ITS 对TSP 样品进行测序,细菌扩增区域选择16S V3-V4 区引物(338F5’-A CTCCTACGGGAGGCAGCA-3’)、(806R5’-GGAC TACHVGGGTWTCTAAT-3’),真菌选择ITS1-ITS2区引物(ITS3-F5’-GCATCGATGAAGAACGCAGC-3’)、(ITS4-R5’-TCCTCCGCTTATTGATATGC-3’)16S。使用Illumina Nova 6000 平台对构建的扩增子文库进行测序获得原始序列,通过QIIME-1.9.1 将原始序列去杂后得到高质量序列进行后续分析。以97% 的相似度作为可操作单元(Operational Taxonomic Units,OTUs) 进 行OTUs 划 分。利 用QIIME 分析序列可生成不同分类水平上(门、属)的物种丰度表,进而根据OTUs 列表中的各样品物种丰度情况分别计算α 多样性指数用以表征群落的物种多样性。
根据餐厨垃圾和生物气溶胶中的微生物相对丰度可以计算生物气溶胶化指数(BI),量化微生物的气溶胶化行为,可用于进一步评估潜在的健康风险。BI 的计算方法见式(3):
式中:RAaerosol为微生物气溶胶样品中微生物的相对丰度;RAwaste为餐厨垃圾样品中微生物的相对丰度。
1.3 健康风险分析
1.3.1 非致癌暴露风险评估
生物气溶胶的暴露途径主要包括呼吸吸入和皮肤接触。气溶胶中微生物整体可视为非致癌物,针对所有可培养微生物,基于美国环境保护署建议的平均日剂量率(ADD)对人体暴露风险进行评估,参考《中国人群暴露参数手册(成人卷)》[27],它适用于中国各地的环境,并已广泛应用于环境和微生物暴露风险评估[18,28],平均日暴露剂量率ADD皮肤和ADD呼吸的计算方法见式(4)和式(5)[29]:
式中:IR 为呼吸速率(m3/d),成年男性为18.65 m3/d、成年女性为14.80 m3/d;ED 为暴露年限(a),取值24 a;EF 为暴露频率(d/a),取值250 d/a;SA为皮肤接触面积(m2),取值0.215 m2;Pc为皮肤渗透率(m/h),取值0.001 m/h;BW 为人体质量(kg),成年男性为62.7 kg、成年女性为54.4 kg;AT 为平均寿命(d),成年男性为69.6×365 d、成年女性为73.3×365 d[30-31]。
使用式(6)中的健康风险熵(Hazard Quotient,HQ)[32]评估微生物的非致癌风险:
式中:HQ呼吸为呼吸吸入的健康风险熵;HQ皮肤为皮肤接触的健康风险熵;HQ 为总健康风险熵,当HQ<1,风险较小,可以忽略,当HQ>1 时,风险较高;RfD 为参考剂量,细菌取500 CFU/(d·kg)、真菌取500 CFU/(d·kg),该值引自美国政府工业卫生工作者会议(American Conference of Governmental Industrial Hygienists,ACGIH)提出的健康暴露风险参考剂量[29,33-34]。
1.3.2 微生物年暴露风险及疾病负担评价
以致病微生物菌属为特定危害物质,利用微生物年暴露风险及疾病负担评价方法,计算餐厨垃圾初期降解暴露人群的年感染风险(Py)和疾病负担(Disease Burden,DB)。根据国家病原微生物资源库中的致病性菌属种类,综合考虑本研究气溶胶中可培养微生物的浓度和菌属相对丰度,选择Pseudomonas和Fusarium作为条件致病细菌和真菌,其浓度计算方法见式(7):
式中:M为环境气溶胶中可培养的致病微生物浓度(CFU/m3);C为环境气溶胶中可培养的总菌落浓度(CFU/m3);F为测序数据中菌属在总可培养菌落数的占比(%)。
日暴露剂量的计算方法[35]如式(8)所示:
式中:d为日暴露剂量(CFU);t为日暴露时间(h),工作人员为8 h、学生为0.5 h;AG 为摄入率(%),工作人员摄入率取10%、学生摄入率取1%[36]。
日感染风险(Pi)和年感染风险(Py)的计算方法如式(9)和式(10)所示:
式中:Pi为日感染风险(d);γ为指数模型参数,取值8.05×10-8[37];Py为年感染风险,即暴露1 a 后被感染的风险(a);n为暴露频率,取n为250 d。
疾病负担的计算如式(11)所示:
式中:DB 为疾病负担,用伤残调整寿命年(Disability-adjusted Life-years,DALY) 指标来表示;HB 为健康负担,取HB 为0.045[37]。
2 结果与讨论
2.1 可培养生物气溶胶浓度分布特征
餐厨垃圾释放生物气溶胶中可培养细菌和真菌的平均浓度分别为(116.95±23.01)CFU/m3和(224.78±27.69)CFU/m3(图1)。真菌浓度高于细菌浓度,采样点细菌和真菌的环境本底浓度分别为(32.80±3.61) CFU/m3和(54.57±17.24) CFU/m3,餐厨垃圾释放的微生物浓度远高于环境本底值,说明餐厨垃圾堆放和初期降解过程大量微生物会以气溶胶的形式逸散至周围的空气中。孙帆等[38]发现校园垃圾房细菌气溶胶的浓度平均值为111 CFU/m3;卢冰洁等[20]发现校园垃圾房细菌气溶胶的浓度范围为56~428 CFU/m3,居民区垃圾房的浓度为51~422 CFU/m3,与本研究气溶胶浓度结果较为接近。郭康旗[39]发现夏季学校真菌气溶胶浓度为(481.96±272.34)CFU/m3,室外真菌气溶胶浓度为(635.03±337.84)CFU/m3,约为本研究餐厨垃圾真菌气溶胶浓度的2~3 倍。研究结果显示真菌浓度高于细菌浓度,原因可能是真菌和细菌的释放形式不同,真菌往往通过孢子形式释放到空气中,颗粒小,易进入空气,而细菌更多以颗粒形式存在,粒径更大[25],并且生物气溶胶的释放受到环境条件的影响,例如温度、湿度等。奚豪[21]对杭州某校室外餐厨垃圾堆放点不同季节气溶胶的采样也发现真菌浓度高于细菌浓度。相比于校园餐厨垃圾,垃圾填埋过程释放的生物气溶胶浓度通常较高。华北某生活垃圾填埋场作业区的空气可培养细菌浓度最高可达8 051 CFU/m3[40]。Madhwal 等[41]发现印度某填埋场空气真菌气溶胶平均浓度为(4 582.75±1 358.25)CFU/m3。垃圾填埋场的垃圾量大、成分复杂,且在填埋作业过程中垃圾倾倒、摊铺等操作均导致气溶胶浓度较高。本研究中校园餐厨垃圾处于初期降解阶段,堆存时间不超过1 d,因此气溶胶浓度较低。对比中科院生态研究中心发布的大气微生物评价分级标准[42]和张华玲等[43]的评级方法,校园餐厨垃圾释放气溶胶中的细菌浓度均未超过限值(500 CFU/m3),但真菌浓度超过了清洁空气限值(200 CFU/m3),属于较清洁空气。综上分析表明,餐厨垃圾在初期降解过程中,附着在垃圾上的微生物会进入到空气中形成生物气溶胶,且以真菌污染为主。
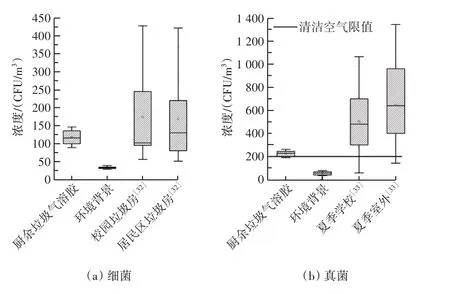
图1 不同样品来源的可培养生物气溶胶浓度Figure 1 Culturable bioaerosol concentrations of samples from different sources
2.2 可培养微生物气溶胶粒径分布特征
餐厨垃圾初期降解产生的细菌和真菌气溶胶在粒径分布上有较大差异,如图2 所示。细菌气溶胶主要分布在较大粒径的Ⅰ级和Ⅳ级上,其粒径范围和浓度分别为≥7.0 μm、(31.0±3.6)CFU/m3和2.1~3.3 μm、(26.1±55.8)CFU/m3。真菌气溶胶主要分布在中间粒径Ⅳ级和Ⅴ级,其粒径范围和浓度分别为2.1~3.3 μm、(55.8±17.6) CFU/m3和1.1~2.1 μm、(47.9±18.9) CFU/m3。有研究表明,某校园垃圾房可培养细菌粒径主要分布在Ⅰ级(占比37.30%)和Ⅲ级(3.3~4.7 μm,占比15.42%)[20]。孙强等[44]对兰州某小区垃圾房内微生物气溶胶粒径分布的研究发现,细菌峰值出现在Ⅲ级(占37.5%)。许鹏程等[45]发现某大学校园内细菌气溶胶粒径主要分布在Ⅰ级(约380 CFU/m3),其次为Ⅳ级(约220 CFU/m3)。微生物粒径<4.7 μm 时易通过人体的咽喉到达气管和肺泡等组织,并导致呼吸系统疾病[46]。研究中可培养细菌和真菌粒径在<4.7 μm 的尺度上占比分别为64.0%±6.4% 和74.0%±5.1%。与细菌相比,真菌气溶胶粒径明显更小。细菌主要依靠附着在固、液颗粒上形成细菌气溶胶,颗粒较大,而真菌通常以孢子或菌丝的形式独立存在于空气中[47-48]。因此真菌气溶胶有更大的吸入风险。

图2 可培养生物气溶胶粒径浓度和占比Figure 2 The concentration of each particle size and its proportion of the culturable bioaerosol
2.3 非培养微生物群落结构特征
不同样品的α 多样性指数如表1 所示。各样品覆盖度(Coverage)都接近1,可代表样品真实情况。细菌与真菌气溶胶样品的ACE 指数、Chao1 指数均大于环境背景值,表明气溶胶样品的丰富度大于环境空气,说明气溶胶中的微生物除来源于环境空气外,还有一部分来自于餐厨垃圾。细菌气溶胶的ACE 指数和Chao1 指数高于真菌,说明细菌气溶胶群落中含有的OTU 数目多,群落的丰度大于真菌。细菌气溶胶样品Shannon 指数大于真菌气溶胶,Simpson 指数则与之相反,说明细菌气溶胶中微生物群落的多样性更高。
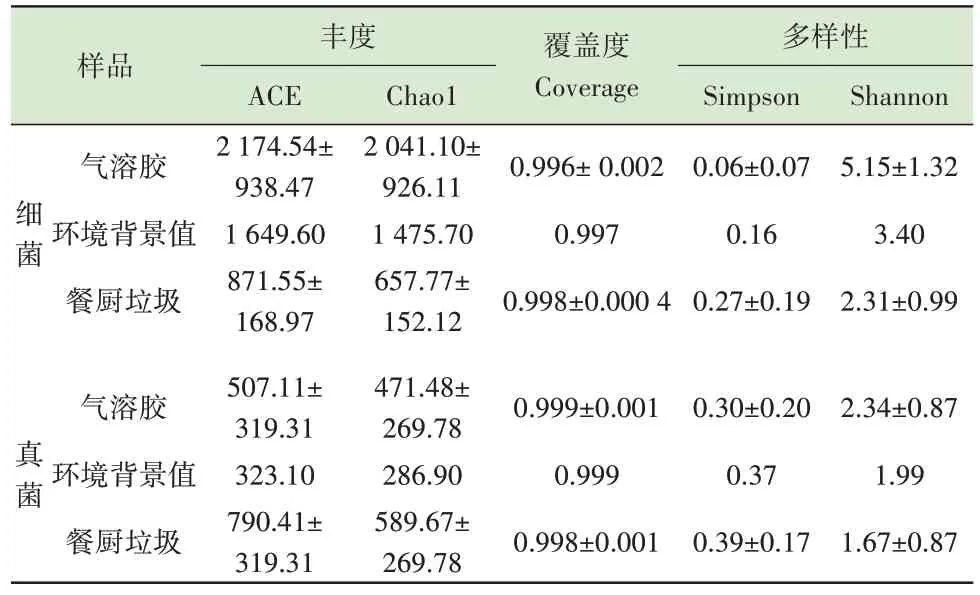
表1 不同样品α 多样性指数Table 1 α diversity index of different samples
细菌生物气溶胶、环境背景空气及餐厨垃圾样品在门水平的群落结构组成如图3(a)所示。可以看出在门水平上,气溶胶样品和餐厨垃圾样品群落结构相同但相对丰度存在一定差异。气溶胶样品的优势菌门为Proteobacteria、Firmicutes 和放线菌门(Actinobacteria),但餐厨垃圾中的优势菌门为Firmicutes。Proteobacteria 是细菌中最大的一门,包括许多病原菌,如沙门氏菌、大肠杆菌等。同样,奚豪[21]发现杭州市校园垃圾气溶胶中Proteobacteria占比较大。气溶胶中的蓝细菌门(Cyanobacteria)并未在餐厨垃圾样品中检出,也可说明气溶胶中的微生物同时会受到环境的影响。图3(b)为不同样品真菌群落结构,与细菌相比,气溶胶及餐厨垃圾中真菌群落的相对丰度明显下降,气溶胶和餐厨垃圾真菌群落结构相似,但相对丰度存在差异。环境空气样品真菌种类很少,仅有Ascomycota、Basidiomycota 和毛霉菌门(Mucoromycota)。Ascomycota 和Basidiomycota 能分泌多种纤维素和半纤维素降解酶,是垃圾降解过程中重要的菌门,也是研究中气溶胶样品的优势真菌门。刘晔[49]在广州某填埋场的气溶胶中也发现了类似的结果。此外,气溶胶和餐厨垃圾样品的优势菌门均有霉菌门(Mortierellomycota)和Mucoromycota,说明它们能从餐厨垃圾进入到空气中,形成生物气溶胶。

图3 细菌和真菌不同样品门水平群落结构(A:空气样品,W:餐厨垃圾样品,B:环境背景值)Figure 3 Bacteria and fungi phyla horizontal community structure of different samples(A:air sample,W:food waste sample,B:environmental background value)
细菌属水平注释的结果如图4(a)所示。气溶胶与餐厨垃圾样品在属水平菌群组成有相似之处,二者共有主导菌属无色菌属(Achromobacter)和Pseudomonas。此外,细菌气溶胶的主导菌属有Sphingomonas、假节杆菌属(Pseudarthrobacter)和马赛菌属(Massilia),餐厨垃圾的主导菌属有乳杆菌属(Lactobacillus)、不动杆菌属(Acinetobacter)和魏斯氏菌属(Weissella)。与环境背景样品相比,气溶胶样品中还出现了明串珠菌属(Leuconostoc),而其也在餐厨垃圾样品中存在,说明气溶胶中的微生物部分来源于餐厨垃圾。检测到的细菌中,有一些属于潜在致病菌或机会致病菌,如Pseudomonas是一种常见致病菌,会导致人体产生化脓性病变。Acinetobatcer在人体抵抗力下降时会引起呼吸道感染,是肺部感染的致病菌,Corynebacterium是一种条件致病菌,会导致急性呼吸道传染病[50-51]。真菌样品经过属水平注释结果如图4(b)所示,可以明显观察到空气真菌的群落结构与其对应的餐厨垃圾有很大相似性,餐厨垃圾中真菌的结构越复杂,则对应空气真菌的菌属种类越多。气溶胶样品的主导菌属均为单孢哈萨克斯坦酵母属(Kazachstania),餐厨垃圾中的主导菌属为念珠菌(Candida)。Fusarium虽未在前20 种主导真菌属中,但所有气溶胶样品中均有检出,其为致病菌属,可引起角膜真菌病、真菌肉芽肿(如足菌肿)、甲真菌病或创伤感染,需要注意防护[21]。

图4 细菌和真菌不同样品属水平群落结构(A:空气样品,W:餐厨垃圾样品,B:环境背景值)Figure 4 Bacteria and fungi genera horizontal community structure of different samples(A:air sample,W:food waste sample,B:environmental background value)
2.4 气溶胶化水平
从门和属水平对餐厨垃圾初期降解产生微生物的气溶胶化水平进行了探究,由图5 可知,门水平和属水平上,细菌都比真菌更容易气溶胶化,但各个菌门、属之间的气溶胶化水平差异明显。异常球菌-栖热菌门(Deinococcus-Thermus)、Massilia、Basidiomycota 和黑团孢属(Periconia)优先气溶胶化,气溶胶化指数分别为116.8±65.36、66.8±32.9、4.4±3.2 和14.6±13.6。Bacteroidetes、Pseudomonas、Acinetobacter和Fusarium为条件致病菌,气溶胶化指数>1,需引起关注。此外,Firmicutes 虽在餐厨垃圾及气溶胶细菌门的丰度较高,但其气溶胶化指数未超过1,说明研究中Firmicutes 与其他优势菌门相比具有更低的气溶胶化水平。

图5 细菌和真菌生物气溶胶化指数Figure 5 Bacteria and fungal bioaerosolization index
2.5 环境因素对气溶胶的影响
环境因素与气溶胶微生物属水平的相关关系如图6 所示。温度、湿度和大气压强与大部分优势菌属有显著相关性。温度和湿度是影响微生物生存和繁殖的重要因素[52],低温可降低微生物机体的代谢活力,抑制其生长和繁殖,高温可能使微生物体内的蛋白质和核酸变性失活。本研究校园餐厨垃圾气溶胶中Pseudomonas和无色杆菌属(Achromobacter)与温度呈明显正相关,鞘氨醇单胞菌属(Sphingomonas)与温度、湿度呈明显负相关。相比细菌,温度对真菌浓度的影响更大,绝大部分优势真菌属与温度、湿度呈负相关,与大气压强、云量呈正相关,Candida与温度正相关性较大,与湿度和风速呈弱正相关性。研究表明,环境温度为20 ℃左右时,空气微生物浓度最高,温度超过25 ℃时,微生物浓度随温度增加而逐渐降低[53]。Frączek 等[7]在波兰马洛波尔斯卡某填埋场的研究发现最高的真菌气溶胶浓度出现在夏季(平均气温17~19 °C,1 439~16 445 CFU/m3),明显高于秋季(平均气温10~12 ℃,172~3 567 CFU/m3)、冬季(平均气温-2~2 ℃,112~2 531 CFU/m3)和春季(平均气温8 ℃,245~1 939 CFU/m3)。Huang 等[54]发现,冬季空气中的真菌浓度较高,这归因于位于台湾南部的采样区,冬季湿度低于夏季,而低湿度是有利于真菌菌落产生分生孢子的重要因素。除微红微球菌属(Rubellimicrobium),紫外光强和风速与别的优势菌属相关性不强。风速会影响细菌和真菌繁殖体的传输,当风速小于2 m/s 时,环境中总空气微生物浓度随风速的增加逐渐升高;当风速大于2 m/s 时,浓度随风速的增加逐渐降低[47]。

图6 细菌和真菌生物气溶胶与环境因子的相关性热图Figure 6 Heatmap of the correlation between bioaerosol and environmental factors of bacteria and fungi
2.6 健康风险评价
校园餐厨垃圾释放生物气溶胶的非致癌健康风险如图7 所示。呼吸吸入的非致癌健康风险远高于皮肤接触的。而真菌气溶胶非致癌健康风险高于细菌气溶胶,其中真菌和细菌气溶胶的平均HQ 分 别 为7.68×10-3±1.51×10-3和1.82×10-3±1.83×10-3。成年女性HQ皮肤要高于男性,主要原因是女性的人体质量要低于男性。而HQ呼吸则与之相反,成年男性的HQ呼吸要远大于成年女性,主要原因是男性的呼吸速率要大于女性。但不论是成年男性还是成年女性,细菌和真菌的总HQ 均低于美国环保署(US EPA)[33]规定的最大可接受水平1。
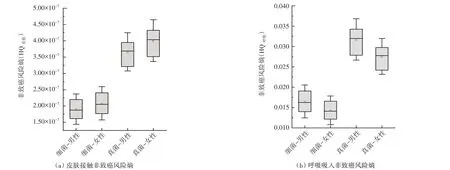
图7 不同人群暴露于餐厨垃圾气溶胶的非致癌健康风险Figure 7 Non-carcinogenic health risks in different populations from food waste aerosol exposure
进一步量化评估Pseudomonas和Fusarium的年感染风险和疾病负担。如表2 所示,工作人员的Py和DB 均高于学生且超过了US EPA 的年感染风 险 基 准 值(Py≤10-4a)[55]和 世 界 卫 生 组 织(WHO)的疾病负担基准值(DB≤10-6)[56-58],这主要与两者不同的暴露时间有关。Carducci 等[59]证实了健康风险随着暴露时间的增加而增加的趋势,学生的暴露时间要低于工作人员,因此其人体健康风险也要更低。无论是工作人员还是学生,男性的Py和DB 均高于女性,主要原因是男性的呼吸速率高于女性,从而导致更高的暴露风险[60]。Haas 等[61]证实正确使用口罩可以有效降低气溶胶的摄入率,从而显著降低感染风险[62]。
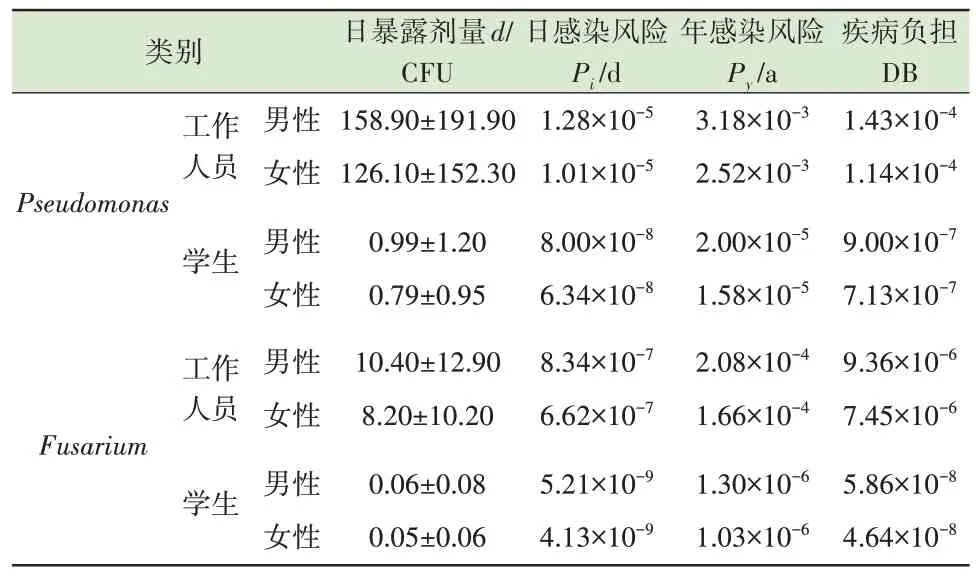
表2 校园学生及工作人员年感染风险及疾病负担Table 2 Annual infection risk and disease burden of campus students and staffs
3 结论与建议
3.1 结论
1)校园餐厨垃圾初期降解释放的生物气溶胶真菌浓度大于细菌浓度且高于环境背景浓度,可培养细菌和真菌微生物粒径分布存在明显差异,直径<4.7 μm 的细菌细颗粒物粒径占比低于真菌占比,细菌气溶胶主要分布在Ⅰ级(≥7.0 μm),真菌气溶胶在Ⅳ级(2.1~3.3 μm)。
2)气溶胶微生物群落结构与餐厨垃圾相似。细菌气溶胶微生物丰度大于真菌气溶胶,细菌气溶胶的优势菌门主要有Proteobacteria 和Firmicutes,前者更易气溶胶化;真菌气溶胶优势菌门主要有Ascomycota 和Basidiomycota,两者均易气溶胶化。
3)在一定范围内,细菌优势菌门和菌属主要与环境温度和湿度呈正相关,真菌优势菌门和菌属与环境温度呈负相关,其他环境因素如风速、紫外光强度、云量、大气压强等相关性较弱。
4)呼吸吸入的非致癌健康风险高于皮肤接触,但均低于US EPA 规定的最大可接受水平。但是Pseudomonas和Fusarium对工作人员的年感染风险和疾病负担均高于基准值。
3.2 建议
1)密封化处理:对校园餐厨垃圾的收集储存容器进行改进,采用气密性更好的密封化设计,减少生物气溶胶的源头释放。
2)定期清理:加强对校园餐厨垃圾收集容器的定期清理和消毒,可以减少餐厨垃圾细菌、真菌等微生物的滋生。
3)通风改善:优化校园餐厨垃圾堆存点的通风条件,利用人工通风设施,降低生物气溶胶在垃圾堆存点的积聚。
4)监测与评估:建立校园餐厨垃圾堆存点生物气溶胶释放水平的检测机制,定期对释放水平进行评估,并根据评估结果进行调整和改进。
5)安全防护:提高工作人员对感染风险的认识,工作人员应加强健康防护,包括佩戴口罩、手套等防护用具,以减少接触可能存在的病原微生物。此外应进行定期的健康检测,特别针对呼吸系统、皮肤等容易受到Pseudomonas和Fusarium感染的部位。
