减蛋综合征病毒抗体胶体金免疫层析试纸条的研制及初步应用
2024-03-09宋亚鹏孙亚宁杨继飞李新生张改平
宋亚鹏,孙亚宁,刘 琳,杨继飞,李新生,魏 蔷,张改平,
(1.河南农业大学动物医学院,河南 郑州 450046;2.河南省农业科学院动物免疫学重点实验室,河南 郑州 450002)
减蛋综合征(Egg drop syndrome)在1976 年由VAN ECK 首次在荷兰报道,也被称为减蛋综合征-76(EDS-76)[1]。减蛋综合征是由减蛋综合征病毒(Egg drop syndrome virus,EDSV)引起的产蛋鸡以产无壳蛋、薄壳蛋、畸形蛋及产蛋率下降为特征的禽类疫病,在世界范围内普遍存在。尽管EDSV 只有一种血清型,但基于限制性内切酶分析,在不同地区(欧洲、英国、澳大利亚和印度)已鉴定出4 种EDSV 基因型[2-3]。EDSV 的天然宿主是鸭和鹅,主要通过污染的水源感染并传播病毒[4-5]。鸭和成年鹅感染后均没有任何临床症状,但雏鹅感染后表现出精神不振,鼻孔有分泌物流出的急性呼吸道症状[6-7]。而典型的产蛋异常仅在鸡和鹌鹑中出现,可使产蛋高峰时期内产蛋率下降10%~40%,畸形蛋发生率高达40%[8-9]。减蛋综合征是引起产蛋量下降的重要疫病之一,给全世界家禽业造成重大经济损失。
EDSV 属于腺病毒科禽腺病毒属,是禽腺病毒Ⅲ群的唯一成员[10]。该病毒无囊膜,呈正二十面体结构,具有30~35 kb 的线性双链DNA 基因组[11]。病毒衣壳主要由240 个六邻体蛋白构成腺病毒的表面,五邻体蛋白及纤维蛋白(Fiber)以非共价键连接的复合物构成病毒二十面体的12 个顶点。在3 种主要的腺病毒衣壳蛋白中,作为向外延伸的Fiber,已被证明是诱导病毒中和抗体最有效的保护性抗原。位于Fiber 蛋白C 端的knob 结构域包含大多数的中和表位,参与病毒侵入宿主细胞,是亚单位疫苗开发的理想靶点[12-14]。EDSV Fiber 蛋白可作为检测病毒特异性抗体和疾病诊断的抗原候选物。
鉴于EDSV 的流行特点与病毒结构,疫苗接种和抗体监测成为控制EDSV 流行的重要手段。多种血清学方法已用于评估血清中的EDSV 抗体,包括酶联免疫吸附试验(ELISA)、病毒中和试验(VN)和血凝抑制(HI)法[13,15-16]。然而,这些方法需要昂贵的仪器、专业操作人员、耗时,不适合快速现场检测。因此,迫切需要一种敏感、特异且操作方便的测定方法来快速定量EDSV 抗体,用于EDSV 的流行病学监测和疫苗诱导的免疫效果评价。
与传统的免疫分析方法相比,胶体金免疫层析试纸是一种理想的免疫快速检测技术,广泛应用于激素、病原微生物、兽药、生物毒素等靶点的快速检测[17-19]。试纸条主要由4 种基本结构组成:样品垫、共轭垫、硝化纤维素膜和吸水垫。以硝酸纤维素膜作为载体,胶体金标记的抗原或抗体用作示踪剂,根据颜色变化和变化程度判断样本中是否存在靶标的抗体或抗原以及其量[20-22]。以EDSV 的Fiber 蛋白作为金标抗原,研制快速检测EDSV 抗体的免疫层析试纸条,对鸡EDSV 抗体水平进行监测,应用肉眼可见的信号评估免疫接种的有效性,旨在为鸡EDSV的快速监测提供技术支持。
1 材料和方法
1.1 重组质粒、菌种与血清
大肠杆菌BL21(DE3)感受态细胞、原核表达载体pET-28a(+)购自美国Novagen 公司;EDSV 血凝抑制试验抗原、标准阳性血清购自哈尔滨维科生物技术有限公司;抗H5 亚型禽流感病毒(AIV)、血清4型禽腺病毒(FAdV)、传染性支气管炎病毒(IBV)、传染性法氏囊病病毒(IBDV)、新城疫病毒(NDV)阳性血清及无特定病原体(SPF)鸡的血清均由河南省农业科学院动物免疫学重点实验室制备保存。
1.2 主要试剂和仪器
氯金酸、柠檬酸三钠购自美国Sigma 公司;HRP标记的兔抗鸡IgG 二抗购自武汉三鹰生物技术有限公司;羊抗鸡IgG、BCA 蛋白质测定试剂盒购自北京索莱宝科技有限公司;特超敏ECL 化学发光试剂盒购自武汉博士德生物有限公司;羊抗鸡纯化IgG 购自北京索莱宝科技有限公司;硝酸纤维膜、滤纸、玻璃纤维垫和吸水垫购自德国Millipore 公司;蛋白质纯化亲和层析柱Ni-NTA 购自德国Merck 公司;单向喷点仪X-only、三维喷膜仪XYZ3000、切割机CM5000 ™与读数仪TSR3000 均购自美国Biodot公司。
1.3 EDSV Fiber蛋白的表达
根据大肠杆菌密码子偏好性,将优化后的EDSV 127 株Fiber基因克隆到pET-28a(+)载体中,鉴定正确的单克隆菌按1%的比例接种于含有氨苄抗性的LB 液体培养基中,培养至OD600约0.6。用终浓度为0.1 mmol∕L 的异丙基β-D-硫代吡喃半乳糖苷(IPTG)进行20 ℃低温诱导20 h,离心收集菌体。重悬后用超声破碎仪破碎细菌,12 000 r∕min离心后分别收集上清与沉淀,沉淀用等量的PBS 缓冲液重悬。分别吸取破碎上清和沉淀样品,加入5×Loading Buffer,煮沸10 min,进行SDS-PAGE 电泳分析,观察重组蛋白的表达情况。
1.4 EDSV Fiber蛋白的纯化与鉴定
用镍离子亲和层析和凝胶过滤层析2种方法纯化目的蛋白。收集菌液破碎上清,先通过Ni-NTA亲和层析柱纯化,得到的蛋白质置于PBS 缓冲液4 ℃过夜透析。再经超滤浓缩及凝胶过滤层析进一步纯化处理,分离得到Fiber 蛋白,用BCA 蛋白质测定试剂盒定量蛋白质浓度。应用抗EDSV 阳性血清作为一抗,兔抗鸡IgG抗体作为二抗,经Western blot分析重组Fiber 蛋白性质,并通过质谱鉴定蛋白质序列。
1.5 胶体金标记EDSV Fiber蛋白偶联物的制备
根据报道方法制备纳米胶体金颗粒[23]。纳米胶体金的直径大小取决于柠檬酸三钠的用量,通过用柠檬酸三钠还原氯金酸溶液产生平均直径为15 nm的胶体金。肉眼观察胶体金溶液颜色为酒红色,透明无沉淀或漂浮颗粒。用0.25 mol∕L 碳酸钾将胶体金溶液的pH 值调节到8.5,避光保存。取120µL 的不同浓度的Fiber 蛋白,加入125 µL 胶体金溶液及2 µL 0.2 mol∕L K2CO3混合均匀后室温作用15 min,观察颜色变化。以不产生颜色变化的蛋白质最低浓度为稳定胶体金的最佳抗原浓度[24]。选取最佳抗原浓度加入适量胶体金溶液中,室温反应5~10 min后,加入3% 酪蛋白溶液,室温封闭10 min,以12 000 r∕min 的速度离心25 min,弃上清,加入含1.2%牛血清白蛋白(BSA)、0.05%叠氮钠的HB缓冲液重悬,4 ℃保存备用。
1.6 EDSV抗体检测免疫层析试纸的制备
免疫层析测试条由样品垫、结合垫、硝酸纤维素膜、支撑板和吸收垫组成(图1A)。利用三维喷膜仪将抗Fiber 抗体(1 mg∕mL)和羊抗鸡IgG(1 mg∕mL)喷涂在硝酸纤维素膜上分别作为检测线和质控线,两线平行间隔5 mm,42 ℃干燥箱中烘干2 h。使用单向喷点仪将金标Fiber 蛋白喷至玻璃纤维膜上作为结合垫,56 ℃干燥箱中烘干2 h。样品垫在缓冲液(0.01 mol∕L PBS,0.1% Triton X-100,0.03 %叠氮钠)中充分浸泡,56 ℃烘干。吸水垫干燥保存。
如图1A 所示,将样品垫、结合垫、硝酸纤维素膜和吸水垫依次粘合到支撑板上,每个相邻垫之间有1~2 mm 的重叠。最后,用闸刀切割机将组合板切成2.25 mm 宽的试纸,室温密封、干燥保存。免疫层析反应仅在质控线与检测线上出现,若试纸条的检测线和质控线同时呈现红色,被检测的样本判定为阳性;若仅质控线呈现红色,而检测线无色,则样本判定为阴性;若仅检测线出现红色或质控线和检测线都没有颜色变化,则判定为无效(图1B)。
1.7 免疫层析试纸定量标准曲线的建立
为了量化试纸条检测的EDSV 抗体效价,基于HI 试验建立标准曲线定量EDSV 抗体。分别将2 log2~13 log2 不同HI 滴度的EDSV 抗体阳性样品用纯水稀释,混匀后吸取100µL 加入检测卡中,室温反应15 min。每个样品做3 个重复。使用TSR3000读数仪扫描检测不同稀释度血清试纸条产生的相对光密度(ROD)。以ROD 值为纵坐标、不同稀释度血清为横坐标,利用软件GraphPad Prism 7中四参数s形(逻辑)模型绘制标准曲线。
1.8 免疫层析试纸的特异性测定
分别取抗H5 亚型AIV、血清4 型FAdV、IBV、IBDV 和NDV 阳性血清及SPF 鸡阴性血清进行检测,用生理盐水1∶20 稀释,取100µL 稀释后的样品进行检测,裸眼观察并使用TSR3000 薄膜读数仪扫描试纸条的ROD值。
1.9 免疫层析试纸的稳定性测定
为测定免疫层析试纸存放的稳定性,将试纸分别存放在4 ℃与37 ℃环境中6 个月,每月用EDSV阳性血清和阴性血清检测试纸条的灵敏性,每个样品做3个重复。
1.10 免疫层析试纸的临床应用
为了验证免疫层析试纸条的临床应用效果,分别用HI 方法和免疫层析试纸对采集的576 份鸡血清样品进行EDSV 抗体检测。利用统计学方法对2种方法进行比较。
2 结果与分析
2.1 EDSV Fiber蛋白的表达
用0.1 mmol∕L IPTG 诱导含有重组Fiber 蛋白表达质粒的大肠杆菌,收集并进行超声破碎处理。结果显示,重组菌株诱导后,在约30 ku 处有明显的蛋白质表达条带(图2A)。经可溶性分析表明,目的蛋白存在于破碎上清液中,为可溶性形式表达。重组Fiber蛋白经多重组合纯化后,纯度达90%左右。
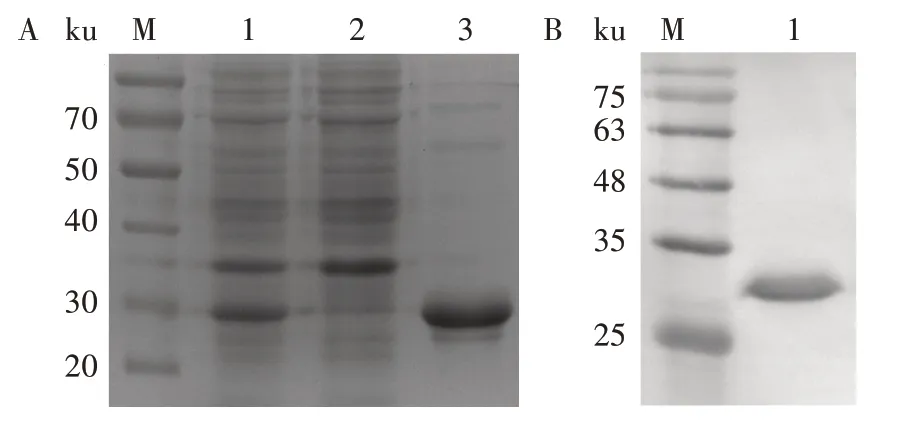
图2 EDSV Fiber蛋白表达(A)与鉴定(B)Fig.2 Expression(A)and characterization(B)of EDSV Fiber protein
2.2 EDSV Fiber蛋白的生物学鉴定
将纯化后的EDSV Fiber 蛋白进行Western blot分析,用抗EDSV 阳性血清作为一抗,兔抗鸡IgG 抗体作为二抗,进行ECL 曝光反应。SDS-PAGE 和Western blot 结果显示,重组蛋白能被特异性血清所识别,在30 ku 处出现清晰的条带(图2B)。重组Fiber蛋白和天然病毒蛋白质有相同的抗原特异性,可以被EDSV 阳性血清识别,并且有良好的反应原性。经质谱鉴定,表达的重组蛋白确为EDSV Fiber蛋白。
2.3 胶体金纳米颗粒电镜分析
为了测量胶体金纳米颗粒的大小和尺寸分布,应用透射电子显微镜(TEM)对金纳米颗粒进行了扫描。图3结果显示,金纳米颗粒均为球形,大小均匀,平均直径约为15 nm,具有良好的尺寸分布和分散性。

图3 TEM观察到的金纳米粒子Fig.3 The colloidal gold observed by TEM
2.4 EDSV抗体免疫层析试纸条标准曲线的建立和灵敏度测定
为了量化检测试纸条检测到的EDSV 抗体,将1.7 中稀释的EDSV 阳性血清样品分别进行HI 试验和本研究建立的免疫层析试纸检测,将所得HI滴度与ROD 值(图4B)绘制标准曲线(图4A)。利用GraphPad Prism 7 中四参数s 形(逻辑)模型绘制标准曲线(y=(A-D)∕[1+(x∕C)B]+D,R2=0.997 0(A=164.2,B=-22.10,C=12.60,D=8.249)。HI 效价在7 log2~12 log2 时,可观察到优异的线性关系(图4A)。这表明2种方法具有良好的一致性。

图4 EDSV抗体免疫层析试纸条与HI试验相关性标准曲线(A)及灵敏度(B)Fig.4 The standard curve of correlation(A)between EDSV antibody immunochromatographic test strip and HI test and the sensitivity(B)
2.5 EDSV抗体免疫层析试纸条的特异性和稳定性
通过检测其他密切相关的禽类病毒的抗血清来确定试纸条的特异性(图5)。试纸条分别检测H5 亚型AIV、血清4 型FAdV、IBV、IBDV 和NDV 阳性血清及SPF 鸡阴性血清,所有检测样品的质控线均有较强的红色条带,而检测线无颜色变化。但只有EDSV 阳性血清有明显的检测线,表明该试纸条具有较强的特异性,仅能检测出EDSV 阳性血清,但与其他抗血清无交叉反应。

图5 EDSV抗体免疫层析试纸条特异性检测结果Fig.5 Specificity of EDSV antibody detection by the test strip
通过在不同温度环境下储存不同时间后,测定试纸条的稳定性。结果显示,在37 ℃环境中,储存8 周的条带质控线和检测线的红色强度略弱于储存2 周的条带,但颜色强度降低不明显。而在4 ℃环境中储存6个月的条带仍然显示良好。
2.6 EDSV抗体免疫层析试纸条的临床应用
分别采用试纸条和HI 法同时检测了河南、安徽、山东等区域养殖场576份鸡血清,结果显示,337份临床样本经试纸条法检测为EDSV 抗体阳性,239份检测为阴性。HI法检测出EDSV 抗体阳性347 例(效价≥7log2),阴性229例(效价<7log2)。该检测试纸条的特异性、敏感性和准确性分别为94.76%(217∕229)、93.76%(325∕347)和94.10%(542∕576)。二者方法符合率为94.1%,Kappa 值为0.878(表1),介于0.75~1.00,说明免疫层析试纸条与HI 试验具有良好一致性。

表1 EDSV抗体免疫层析试纸条与HI临床样品检测结果对比Tab.1 The comparison results of the test strip with HI
3 结论与讨论
EDSV 是Ⅲ群禽腺病毒的成员,具有广泛的宿主范围。鸡是该病毒主要易感动物,其他禽类如鸭、鹅也是EDSV 的宿主,通过受污染的水传播病毒[25-26]。虽然对鸭、鹅不具有致病性,但是会保持带毒、排毒的现象,被认为是感染鸡群的主要来源[27-28]。腺病毒的组织嗜性主要取决于Fiber 蛋白对宿主细胞的识别和附着,因此认为Fiber蛋白是种间传播EDS 的主要贡献者[29-33]。目前,HI 法是监测免疫后禽类EDSV 抗体水平使用最广泛的方法[12,34-35]。然而,该方法需要专业操作人员和耗时较久,不能满足高通量、现场快速检测的要求,迫切需要为检测EDSV 抗体水平及评价相关免疫效果提供一种新的方法。
以免疫层析试纸为代表的快速检测技术,融合了新兴材料、免疫层析技术及标记技术等多种技术,能够为养禽业提供针对病原微生物的感染预警及免疫评估[36-39]。XIE 等[40]利用血清4 型FAdV Fiber-2 的单克隆抗体,制备检测血清4 型FAdV 的双夹心胶体金试纸条,用于区分血清4 型FAdV 和不同血清型禽腺病毒。与PCR 检测结果具有良好的相容性,用试纸条分别检测疑似病例的肝组织和病毒培养物,与PCR 的检测符合率分别为94.7%和100%。然而商品化的EDSV 特异性免疫层析检测技术尚未开发。本研究基于原核表达的Fiber 蛋白进行胶体金标记,开发了一种监测家禽EDSV 抗体水平免疫层析试纸。EDSV Fiber 蛋白含有病毒特异性抗原决定簇,并且在病毒感染过程中诱导机体产生良好的体液免疫应答。不同腺病毒的Fiber 蛋白在分子结构和功能上相类似。本研究中,EDSV Fiber蛋白经密码子优化,在大肠杆菌中实现了可溶性表达。对蛋白质性质进行分析发现,本研究原核表达得到的蛋白质具有生物学活性。纯化后用于制备试纸条的蛋白质纯度达90%,确保后期检测抗体的特异性不受到其他蛋白质因素的影响。
作为最常用的抗体测定法,HI法提供了准确而灵敏的抗体检测。根据《中华人民共和国兽医药典》标准[41],采用HI 法对免疫后EDSV 抗体进行测定,HI 抗体效价的几何平均值应不低于7log2。EDSV 的HI 效价≥7log2,判定为抗体阳性;HI 效价<7log2时,判定为抗体阴性。为了使研究的试纸条具有更强的临床使用价值,根据《中华人民共和国兽医药典》标准对试纸条的检测范围进行调整,通过基于HI 制备的标准曲线,使之与传统检测方法HI相一致。另外,为验证制备的EDSV 抗体试纸条的特异性,检测了禽类不同病毒的阳性血清,包括H5亚型AIV、血清4型FAdV、IBV、IBDV和NDV阳性血清及SPF 鸡阴性血清,结果显示,EDSV 抗体试纸条与其他血清无交叉反应,只与EDSV 阳性血清反应,说明该试纸条特异性强。在稳定性检测中,真空密封保存的试纸条在4 ℃条件下放置长达6 个月仍能获得有效的检测结果,意味着这些检测试纸条性状稳定。最后,为检验该试纸条的临床应用情况,采用HI 法和试纸条同时检测576 份鸡血清,发现二者方法符合率为94.1%,Kappa 值为0.878,表明这2 种方法的一致性高。
综上所述,本研究成功制备了简单、快速、准确检测EDSV 抗体的免疫层析试纸,能够替代HI 法作为临床快速评价EDSV 抗体水平的可靠手段,具有优异的临床应用价值和商业潜力。
