叶绿体类囊体腔蛋白功能研究进展
2024-03-08侯瑾蓉贾蒲连付爱根
侯瑾蓉 ,董 洁 ,贾蒲连 ,姚 强 ,付爱根,2 ,王 菲,2*
(1 西北大学 生命科学学院,西安 710069;2 陕西省碳中和技术重点实验室,西安 710069)
光合作用是指藻类和高等植物通过吸收和利用光能,最终将二氧化碳和水转变为有机物并释放能量的过程。叶绿体是一种半自主性细胞器,主要负责光合作用,除此之外还有一些其他功能,如氨基酸、脂肪酸、色素和激素的合成。叶绿体含有高度复杂的亚细胞器室,包括3个膜系统(外膜、内膜和类囊体膜)和3个腔室(膜间空间、基质和类囊体腔)[1]。类囊体膜是叶绿体的主要结构成分,参与光合电子传递和ATP合成。它由4个光合蛋白复合体组成:光系统Ⅱ(photosystem Ⅱ,PSⅡ),细胞色素b6f(cytochromeb6f,Cytb6f),光系统Ⅰ(photosystemⅠ,PSⅠ),和ATP 合酶(ATPase)。这四大光合复合体通过一系列协同反应最终产生NADPH 和ATP,为碳水化合物的合成进一步提供能量。
由类囊体膜包围的、狭窄的连续整体空间叫做类囊体腔。类囊体腔不仅可以为光系统Ⅱ的氧化保存水分,而且为质体蓝素介导的电子转移和光保护提供了空间环境。近些年,在类囊体腔中发现了许多直接或间接参与光合作用的蛋白质成分,这些蛋白大多调节类囊体生物发生,并且与光合蛋白复合体的活性和周转有关。拟南芥中约有80个蛋白定位于类囊体腔,在其他高等植物如菠菜中鉴定出26种类囊体腔蛋白,在豌豆中鉴定出15种,且这些蛋白可能具有功能保守性。目前已知功能的拟南芥类囊体腔蛋白有高叶绿素荧光(high chlorophyll fluorescence,HCF)蛋白YCF48(hypothetical chloroplast open reading frame 48)和LPA19(low pii accumulation 19)[2];C末端剪切酶(carboxyl-terminal processing enzyme,CTP)Ctp A[3];Deg(degradation of periplasmic)蛋白酶Deg1、Deg5和Deg8[4];蛋白磷酸酶TLP18.3(thylakoid lumen protein of 18.3 k Da);亲免蛋白(immunophilins)中的亲环素(cyclophilins,CYPs)CYP38、CYP20-2 和CYP28以及FK506 结合蛋白(FK506 binding proteins,FKBPs)FKBP20-2和FKBP13[5];放氧复合物(oxygen-evolving complex,OEC)蛋白Psb Q、PsbP、Psb O 和PsbR[6];PsbP 类蛋白(PsbP-like proteins,PPLs)PPL1 和PPL2[7];PsbP 结构域蛋白(PsbPdomain protein,PPDs)PPD1、PPD3、PPD5和PPD6(图1)[8]。
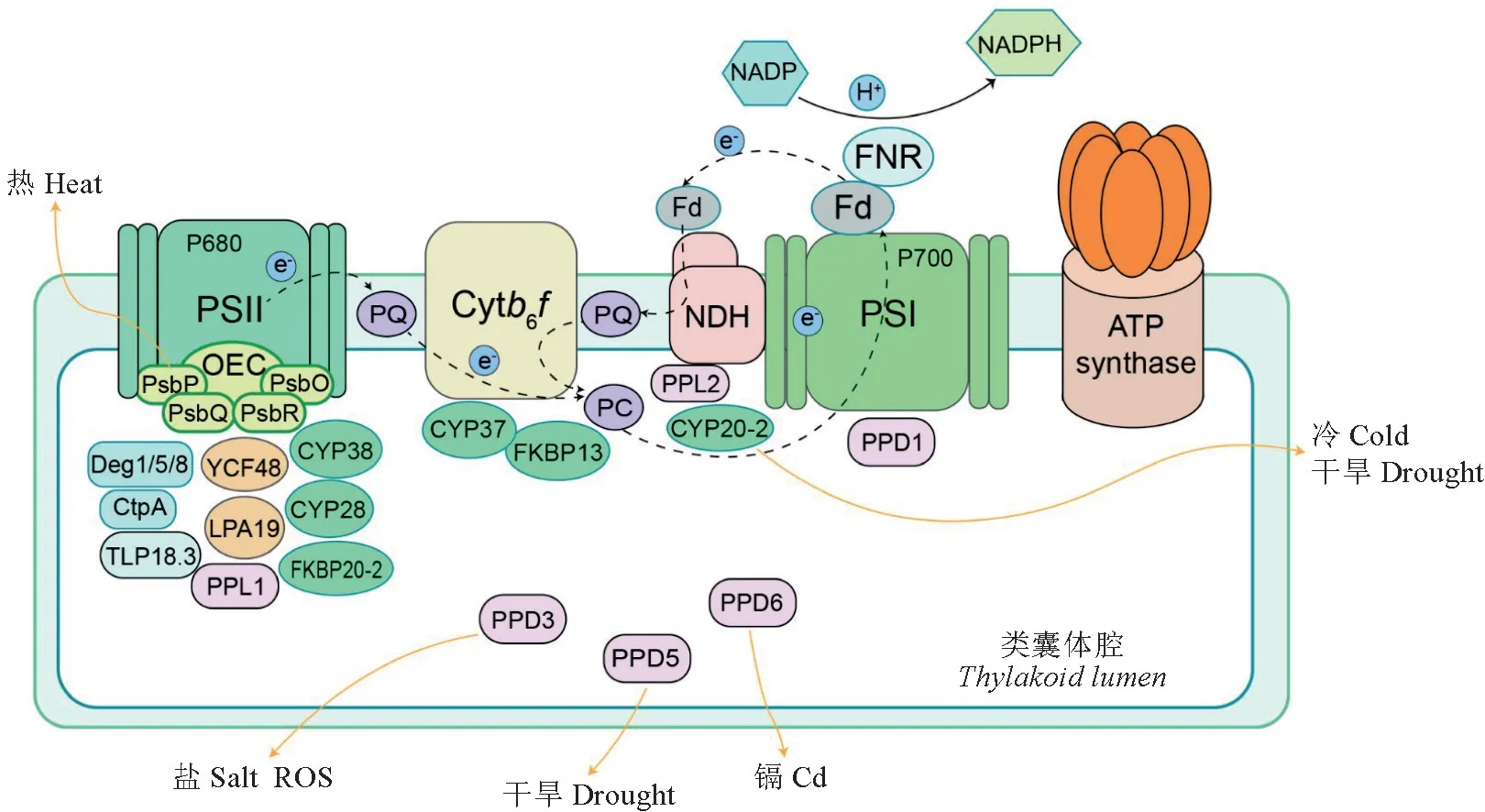
图1 拟南芥类囊体腔中光合相关蛋白的功能示意图Fig.1 Summary of the thylakoid lumen localized proteins with photosynthesis-related functions in Arabidopsis thaliana
1 高叶绿素荧光蛋白
叶绿素是光合生物含有的一类绿色色素,它在光能捕获、能量传递以及能量转化等方面起着重要作用。叶绿素吸收的光能主要有3个去向:以热量的形式耗散;通过光化学作用转化为化学能;以荧光的形式释放。在光合作用研究中对光合突变体的筛选方法之一是通过荧光表型筛选。正常情况下,植物的荧光释放量很低,当叶绿素吸收的光能无法有效进行光合作用或光合电子传递链受损时会导致植物产生荧光上升的现象,即高叶绿素荧光表型。目前,在拟南芥中筛选出了多个高叶绿素荧光突变体,如hcf164、hcf101、hcf153、hcf136和lpa19等。研究发现,定位在类囊体膜的HCF164和HCF153参与了Cytb6f的生物发生,HCF101参与了PSⅠ的组装[9-10]。其中,HCF136(YCF48)和LPA19 定位于类囊体腔,它们在PSⅡ生物发生中发挥重要作用。
1.1 YCF48
YCF48(hypothetical chloroplast open reading frame 48)是由核基因编码,定位在类囊体腔的蛋白,是真核光合生物中较早鉴定出来的PSⅡ组装因子。拟南芥ycf48突变体在幼苗时期就死亡。拟南芥YCF48同源蛋白存在于包括蓝藻在内的所有产氧光合生物中。集胞藻YCF48蛋白是一种脂蛋白,通过与未组装前体D1(p D1)亚基结合并促进其与D2蛋白结合形成PSⅡ反应中心(RCⅡ)组装中间体,在维持PSⅡ的组装过程中发挥着重要作用[11]。最新的研究表明,YCF48可以与D1的精氨酸残基结合,从而防止Mn4CaO5簇中的Mn2+和Ca2+与D1 过早结合,确保PSⅡ复合体的有效组装[12]。嗜热蓝藻和红藻中的YCF48蛋白都属于七叶β-螺旋桨家族,表面都有1个高度保守的精氨酸富集区域,从而在叶绿素结合蛋白整合到PSⅠ和PSⅡ复合体的过程中发挥重要作用[13]。
1.2 LPA19
拟南芥LPA19(low pii accumulation 19)蛋白定位于类囊体腔,是Psb27 的同源蛋白之一,被命名为Psb27-H2。Psb27蛋白最早在蓝藻中发现,与拟南芥Psb27蛋白不同,蓝藻Psb27蛋白紧密结合在类囊体膜上。拟南芥Psb27-H2突变体的PSⅡ最大光合速率降低,并且叶绿体编码的PSⅡ核心亚基D1、D2、CP47和CP43的表达水平也大大降低,这表明Psb27-H2 蛋白参与了PSⅡ的生物合成。Psb27-H2蛋白还可以与成熟D1和前体D1的可溶性C端相互作用,从而促进拟南芥D1前体蛋白的加工[14]。然而对拟南芥中另1个Psb27同源蛋白Psb27-H1的研究表明,它不是PSⅡ生物发生所必需的,而是植物应对变光条件的一个重要因子,并且这一过程不依赖状态转化[15]。拟南芥psb27-H1突变体在受到光抑制后PSⅡ活性的恢复速率减慢,这表明其在PSⅡ光损伤后的有效修复中起着重要作用[16]。
2 蛋白磷酸酶
TLP18.3(thylakoid lumen protein of 18.3 k D)被认为是一种位于类囊体腔中的蛋白磷酸酶,它的功能可能与类囊体腔蛋白的去磷酸化有关[17]。拟南芥tlp18.3突变体在正常光照条件下没有明显的生长表型,但在波动光照条件下生长受到明显抑制。另有研究表明TLP18.3有可能参与PSⅡ高光后的损伤修复。在PSⅡ修复过程中,受损的D1蛋白首先被磷酸化,之后迁移到基质片层,在蛋白磷酸酶的作用下发生去磷酸化,最后被蛋白酶降解并被新合成D1蛋白替换。在TLP18.3 蛋白缺失的情况下,受损的D1蛋白降解减慢并且PSⅡ单体无法组装成二聚体[18]。然而,TLP18.3定位于类囊体腔中,D1的磷酸化位点在类囊体基质侧,理论上两者不会发生物理互作。因此推测TLP18.3可能通过作用于类囊体腔中一些未知蛋白的去磷酸化,从而间接参与到PSⅡ的损伤修复中[17]。在最近的研究中发现,TLP18.3的缺失导致波动光下突变体免疫相关基因的表达调控受到影响,从而间接影响了突变体在波动光下的生长[19]。
3 蛋白酶
叶绿体中的大多数蛋白质由核基因编码,首先在细胞质中合成含有N 端转运肽的前体蛋白,之后运输到叶绿体被相应的蛋白酶切割得到成熟肽。过去几十年的研究已经揭示了20多种叶绿体蛋白酶,分别定位于特定的亚细胞器[20]。来源于细菌的Clp和Fts H 都是ATP依赖型的蛋白酶,分别定位于细胞质基质和类囊体膜,是维持蛋白质稳态的核心。此外,定位于类囊体腔的蛋白酶Ctp A 和Deg 对PSⅡ的生物发生和维持至关重要。
3.1 Ctp A蛋白酶
Ctp A(carboxyl-terminal processing enzyme A)蛋白酶定位在类囊体腔中。对斜链球菌Ctp A的结构分析中发现它是一个具有3个可折叠结构域(A、B和C)的单体酶,B结构域即PDZ(post-synaptic density-95/discs large/zonula occludens-1)结构域,可以与底物p D1的C末端结合[3]。最早在聚球藻和斜生栅藻中发现缺少Ctp A 会导致p D1的加工受阻,从而使光合活性下降。拟南芥ctpa突变体中的p D1 蛋白可以正常组装形成PSⅡ单体和二聚体,但LHCⅡ与PSⅡ二聚体不能结合形成超级复合体,这说明Ctp A 可以通过影响p D1的加工成熟来影响PSⅡ超级复合体的组装[21]。聚球藻、莱茵衣藻和小立碗藓的Ctp A基因均可回补拟南芥ctpa突变体的致死表型,因此Ctp A 加工p D1的功能从单细胞绿藻到高等植物是保守的[22]。
3.2 Deg蛋白酶
Deg(degradation of periplasmic)蛋白酶家族最早是在大肠杆菌中发现的,大肠杆菌Deg具有2个PDZ结构域,这2个结构域可以与底物蛋白C 末端的氨基酸残基相互作用[4]。拟南芥Deg1、Deg5 和Deg8是不依赖ATP的丝氨酸蛋白酶,定位在类囊体腔中。Deg1 形成1 个同源六聚体,而Deg5 和Deg8形成1个异源六聚体。当植物受到光胁迫时,Deg1、Deg5和Deg8蛋白酶协助降解受损的D1蛋白,并且Deg1可以作为分子伴侣与D2蛋白一起参与D1的翻译和组装[23]。最新研究发现Deg1表达水平降低的植株deg1-2和deg1-4的PSⅡ最大光合效率(Fv/Fm)显著降低,非光化学淬灭(NPQ)增加。此外,Deg1蛋白的减少还导致还原中心数量减少以及非还原中心的积累,抑制了PSⅡ受体侧电子转移。这些结果表明Deg1 蛋白酶在PSⅡ供体侧和受体侧电子转移过程中发挥着重要作用[24]。生化证据表明Deg1在植物体内的蛋白丰度高于Deg5-Deg8,并且Deg1具有较高的蛋白水解酶活性,因此在高光胁迫下,deg1突变体比deg5和deg8突变体受损更加严重,同时过表达Deg5 和Deg8仅可以部分补偿Deg1的缺陷[25]。
4 亲免蛋白家族
亲免蛋白包括CYPs(cyclophilins)和FKBPs(FK506 binding proteins)2个家族,它们共同的特点是都含有 PPIase(peptidyl-prolyl cis/trans isomerase)结构域[5]。PPIase是肽基脯氨酸顺反异构酶结构域,可以催化蛋白序列X-Pro之间肽键的顺反异构反应,这对于蛋白质的快速折叠是必需的。研究表明,植物体内部分亲免蛋白的生理功能并不依赖于PPIase活性。亲免蛋白广泛存在于细菌、真菌和动植物体中。植物体内拥有众多亲免蛋白,大多数与光合作用有关。在拟南芥中已经鉴定出52个亲免蛋白基因,包括29个CYPs和23个FKBPs;水稻中有56 个,包 括29 个FKBPs 和27 个CYPs[26];衣藻中有52个,包括26个FKBPs和26个CYPs[27]。类囊体腔中存在大量亲免蛋白,它们在调节植物生长发育、免疫反应以及光合作用中起着关键作用。
4.1 CYP38
CYP38是一种存在于类囊体腔的亲免蛋白,它的C端PPIase结构域没有酶活性。拟南芥cyp38突变体植株具有明显的发育不良和高光敏感表型,并且PSⅡ超级复合物几乎完全缺失,这说明CYP38对PSⅡ的组装和稳定起着关键作用[28]。对拟南芥CYP38的研究还发现突变体中D1蛋白的降解速度比野生型快,这可能是因为拟南芥CYP38蛋白可以通过抑制Psb O-2的GTPase活性,使D1处于相对稳定的磷酸化状态,避免过度降解[29]。此外,CYP38蛋白的缺失还会影响拟南芥叶绿体形态建成和类囊体堆积[30]。蓝藻CYP40 是拟南芥CYP38的同源蛋白,其C 端的PPIase结构域具有酶活性,并且在调节PSⅠ的组装过程中发挥关键作用[31]。CYP38的晶体结构已经被揭示:N 端由α螺旋组成,C 端由β折叠片组成,中间靠酸性loop环连接在一起。CYP38 可以与PSⅡ核心蛋白CP43和CP47的loop环之间相互作用。最近的研究发现loop区的碱性氨基酸可以通过调节CYP38的构型来调节N 端和C端2个结构域的相互作用,进而影响C 端结构域和靶蛋白相互作用[32]。通过筛选酵母双杂交文库以及通过pull-down和Co-IP实验鉴定出了一些与CYP38的C 端结构域有潜在互作的类囊体腔蛋白,这为未来研究CYP38在类囊体腔内的工作模式奠定了基础[33]。
4.2 CYP20-2
CYP20-2同样为类囊体腔的亲免蛋白,具有PPIase活性[34]。当拟南芥暴露在强光或低温下时,CYP20-2的转录水平显著增加,因此该蛋白可能在适应非生物胁迫中发挥重要作用[35]。将水稻CYP20-2基因在烟草和拟南芥中过表达增强了其对干旱和强光的耐受性,这说明水稻CYP20-2可能也具有和拟南芥CYP20-2相同的功能。蛋白质谱分析表明,水稻CYP20-2具有叶绿体和细胞核的双定位。在低温胁迫下,水稻CYP20-2分别靶向细胞核和叶绿体中的SLR1和FSD2,以协调植株的生长和耐冷性[36]。另有研究发现,拟南芥CYP20-2可以进入细胞核作用于BZR1,通过改变后者的二级结构,促进BZR1 的磷酸化。FLD 是BZR1 的直接靶点,BZR1与FLD结合可以调控拟南芥开花[34]。
4.3 CYP28
CYP28是最近发现的一种调节拟南芥PSⅡ-LHCⅡ超级复合体组装和积累的类囊体腔蛋白。在正常光照条件下,拟南芥cyp28突变体植株的叶片生长加快,开花时间提前,PSⅡ-LHCⅡ超级复合体的积累量增加。CYP28 具有PPIase活性,并且在体内通过改变Lhcb6的构象而调节拟南芥PSⅡ-LHCⅡ超级复合物的组装和积累[38]。莱茵衣藻CYN28是拟南芥CYP28的同源蛋白,研究表明它也具有PPIase活性[39]。衣藻cyn28突变体对高光极度敏感,并且PSⅡ-LHCⅡ超级复合体的积累显著减少。CYN28被证实通过与Fts H 蛋白酶相互作用来促进Fts H 的重新合成,参与高光胁迫下受损伤D1蛋白的周转,最终促进PSⅡ的修复。这2个同源蛋白的功能截然不同,表明亲免蛋白进化过程中可能出现功能分化。
4.4 CYP37
最近的研究表明,类囊体腔亲免蛋白CYP37与拟南芥高光抵御相关。高光生长条件下,拟南芥cyp37敲除突变体的线性电子传递速率降低,PSⅠ供体侧的电子传递受到抑制,活性氧(ROS)积累增多,花青素的积累减少[37]。此外,该研究发现CYP37可以与Cytb6f复合体亚基Pet A 相互作用,作为辅助因子来维持Cytb6f复合物的活性。CYP37的缺少会导致Cytb6f复合物活性下降,线性电子传递受阻,进而导致ROS过度积累,花青素的生物合成减少[37]。
4.5 FKBP20-2
FKBP20-2定位于类囊体腔,是FK506结合蛋白家族的一员。拟南芥fkbp20-2突变体植株生长矮小,PSⅡ超级复合物的积累下降,说明FKBP20-2在PSⅡ-LHCⅡ超级复合物的积累或稳定中起着重要作用。此外,该研究还发现FKBP20-2具有极低的PPIase活性,蛋白C端的二硫键能被硫氧还蛋白(thioredoxin,Trx)还原,该二硫键在除了蓝藻以外的陆地植物和真核藻类中保守,表明这种潜在的氧化还原调节仅存在于叶绿体[40]。
4.6 FKBP13
FKBP13与CYP20-2 一样,是目前已知具有PPIase活性的类囊体腔亲免蛋白。FKBP13的x射线结构展示其含有1对二硫键,这对二硫键可以被叶绿体或细菌来源的硫氧还蛋白还原,导致酶活性丧失[41]。FKBP13前体蛋白可以与Cytb6f复合体的Rieske亚基相互作用来抑制其在拟南芥中的积累,从而参与调控Cytb6f复合体的组装过程[42]。最新研究发现,白菜HTT4(heat-induced tas1 target4)蛋白在体内和体外都与FKBP13 存在互作。HTT4被报道是一种白菜分枝的负调节因子,推测它可能通过促进FKBP13的表达来影响Rieske蛋白的积累,进而通过光合作用调控白菜分枝[43]。
5 放氧相关复合物蛋白
放氧复合体(oxygen-evolving complex,OEC)能够在光照条件下催化水裂解并释放氧气[6]。在高等植物中,OEC由锰簇、氯离子、钙离子以及4个附着在PSⅡ管腔一侧的外周蛋白(PsbQ、PsbP、PsbO和Psb R)组成[44-45]。这些外周蛋白能够稳定锰簇蛋白进而促进水的裂解。在受到热、冷、盐和强光等非生物胁迫时,位于类囊体管腔侧的Psb O、PsbP、PsbQ 和PsbR 很容易受到破坏,这些蛋白的不稳定性会导致ROS分子的产生,从而破坏OEC,最终导致植物的光合速率下降[46]。在高等植物中,Psb O 和PsbP是光合自养生长所必需的,而Psb Q 及Psb R的缺失也会对PSⅡ活性产生影响[47-48]。
5.1 PsbO
Psb O 在稳定OEC的过程中发挥着重要作用,尤其对于Mn 簇的稳定,所以又叫做锰稳定蛋白(manganese stablizing protein,MSP)。在被子植物中有Psb O-1和Psb O-2两个亚型[49],它们在氨基酸组成和功能上具有差异。拟南芥Psb O-1 在PSⅡ利用钙离子促进放氧过程中发挥主要作用,Psb O-2具有GTPase活性,在PSⅡ修复过程中调节D1蛋白磷酸化[45]。植物和蓝藻的Psb O 蛋白表面都带有大量负电荷,从而保证其更好地结合在PSⅡ上[50]。莱茵衣藻Psb O 对维持成熟PSⅡ反应中心的稳定性是必需的,并且Psb O 蛋白寿命在很大程度上依赖于光强度和碳源种类[51]。小麦Psb O突变体植株呈现黄化表型,表明Psb O 的缺失会影响光合作用,进而导致植株的黄化[52]。
5.2 PsbP
拟南芥PsbP蛋白对幼苗早期发育阶段PSⅡ的初始组装是必需的[48]。高等植物PsbP蛋白通过调节必需辅助因子Ca2+和Cl-的结合特性维持PSⅡ内Mn簇的稳定。PsbP 的稳定性对于植物在逆境下的光合活性十分重要,甘薯中的Orange蛋白可以通过PsbP维持PSⅡ在热胁迫下的稳定性增强植物的耐热性[53]。
5.3 PsbQ
蓝藻中的Psb Q 通常被称之为Cyano Q,从而与植物和藻类区分。高等植物和藻类的Psb Q 结合在成熟PSⅡ复合物的类囊体腔一侧,最近对蓝藻PsbQ 的晶体结构解析发现它在PSⅡ上的结合位点与高等植物和藻类Psb Q[54]几乎相同。PsbQ 通过与PsbP相互作用来稳定PsbP与PSⅡ的结合,从而维持高等植物PSⅡ的锰簇稳定[55]。除此之外,拟南芥PsbQ与LHCⅡ的磷酸化和状态转化有关[48]。
5.4 Psb R
PsbR 是植物中特有的放氧复合物组分,参与PsbP与PSⅡ核心复合物的结合。Psb R 缺失显著减少了类囊体膜的放氧活性,并使得PsbP和Psb Q的积累量下降。Psb R 可以在强光及高温等逆境下稳定并维持PSⅡ的放氧活性[46]。
6 PsbP类蛋白和PsbP结构域蛋白
植物中还存在一些与Psb P 相关的蛋白家族,称为PsbP 类蛋白(PsbP-like proteins,PPLs)和PsbP结构域蛋白(PsbP-domain protein,PPDs),它们都与PsbP具有较高的氨基酸序列同源性,同时具有多样的功能[9-10]。目前PsbP 蛋白的研究已较为广泛,而关于PPLs和PPDs在真核生物中功能的研究相对较少。
6.1 PsbP类蛋白
植物PPL1和PPL2已被鉴定为叶绿体类囊体腔蛋白,系统发育分析表明,PPL1、PPL2 和蓝藻CyanoP可能存在同源关系[7]。
PPL1是一种类囊体腔外周蛋白,富集于基质薄片和基粒边缘。在正常光照和高光条件下,拟南芥PPL1蛋白的缺失都会影响PSⅡ的活性及有效修复。此外,在低光强下,ppl1突变体的PSⅡ超级复合体积累减少,表明PPL1 可能参与了拟南芥PSⅡ-LHCⅡ超级复合体的组装[7,56]。研究表明,拟南芥ppl1突变体从状态1到状态2的跃迁加快,这些差异会降低植物对不断变化的光环境的适应能力,从而导致植物在自然波动光环境下的生长减弱[56]。
PPL2是一种高等植物特异性PPL 蛋白,尚未在蓝藻、真核藻类、苔藓或蕨类植物中发现。拟南芥ppl2突变体中NDH 亚基不能积累,缺乏NDH 复合物活性[7]。此外,通过蓝绿胶活性电泳和免疫印迹分析发现,PPL2蛋白与NDH 亚基共迁移。这些数据表明,PPL2是叶绿体NDH 复合体的一个亚基。
6.2 PsbP结构域蛋白
PsbP 结构域蛋白(PsbP-domain protein,PPDs)与PsbP蛋白在结构和序列上的相似程度较低,对PsbP 家族成员的系统进化分析表明,大多数PPD 蛋白是高等植物和绿藻所特有的[7]。目前在拟南芥中发现了9种PPD 蛋白(PPD1-PPD9),这些蛋白可能在类囊体腔内发挥着广泛的功能[57]。
PPD1是一种核基因编码的类囊体腔蛋白。拟南芥ppd1突变体不能进行光合自养,并且PSⅠ复合物的组装存在缺陷。体内和体外实验都证明PPD1可以与PsaB和Psa A 暴露在类囊体腔的结构域相互作用,进而帮助PsaB和Psa A 正确折叠并整合到类囊体膜上[58]。通过RNAi获得拟南芥PPD1的敲低突变体,发现在有少量PPD1存在的情况下,PSⅠ复合物仅有少量积累,且这些复合物在LHCⅠ与PSⅠ的结合以及从质体蓝素到P700+的电子转移方面存在缺陷,这表明PPD1的减少会导致PSⅠ在类囊体腔侧的组装缺陷[59]。
拟南芥PPD2 的功能尚不明确,莱茵衣藻PsbP2与拟南芥PPD2具有较高的同源性,被认为是单线态氧信号通路的成员,参与调节复杂的单线态氧依赖性信号系统[60]。拟南芥PPD3 是感觉质体和叶绿体双定位蛋白。PPD3缺失的突变体表现出生长缓慢、开花延迟、活性氧信号传导紊乱以及盐胁迫敏感的表型。遗传和生化证据表明PPD3 与MSH1(MutS1 HOMOLOG 1)存在互作,参与感觉质体介导的表观遗传调控[61]。
拟南芥ppd5突变体表现出侧根分支增多和腋芽形成缺陷,而这种发育缺陷与突变体中独角金内酯合成不足相关[8]。在干旱胁迫中,ppd5突变体表现出气孔关闭增加以及保卫细胞H2O2的积累增多,从而负向调节植物的抗旱性[62]。PPD5基因可以和编码叶绿体或胞质核糖体蛋白的基因共表达,推测PPD5可能参与到蛋白质的从头合成过程中,当植物受到胁迫时在维持PSⅡ活性方面发挥一定作用[63]。
PPD6是一种独特的PsbP 家族成员,通过对PPD6的晶体结构进行解析发现它包含1个保守的二硫键,可以在体外被硫氧还蛋白还原[64]。Cd胁迫降低了黄瓜和烟草叶片中PPD6的基因表达[65-66],进而可能影响到植物的光合作用。
7 展 望
类囊体腔对于高效的光合电子转移、光复合体的组装和维持都至关重要。已知有许多类囊体腔蛋白参与了这些过程,但大多数类囊体腔蛋白的功能仍不清楚。类囊体腔中最丰富的蛋白质是PSⅡ的放氧复合体蛋白。其他已知的蛋白有亲免蛋白家族,PsbP类蛋白家族,分子伴侣和水解活性相关蛋白等。考虑到腔内蛋白在类囊体膜中的空间位置,可以预期有多种蛋白质参与了光合作用调控。而随着光合生物的长期进化,类囊体腔蛋白的功能也存在不同程度的分化。对类囊体腔蛋白的功能挖掘将加深我们对叶绿体亚细胞器的认识,研究结果将具有重要的理论意义。
