典型抗生素冲击对黄铁矿/硫基质反硝化修复体系的影响
2024-03-08曹惜霜杨雯钰潘先兵成都信息工程大学资源环境学院四川成都60225北京师范大学地下水污染控制与修复教育部工程研究中心北京00875
曹惜霜,信 欣,2*,杨雯钰,刘 鑫,潘先兵 (.成都信息工程大学资源环境学院,四川 成都 60225;2.北京师范大学,地下水污染控制与修复教育部工程研究中心,北京 00875)
目前地下水中的硝酸盐(NO3--N)污染已成为一个严重的全球环境问题[1].许多国家和地区的地下水是重要的饮用水源之一,若人们过量摄入NO3--N容易引起消化系统疾病、高铁血红蛋白血症(蓝婴病)等疾病[2].去除地下水中NO3--N 的技术包括反渗透、离子交换、电化学还原、活性炭吸附等[3],但是这些方法存在运行成本高、易产生二次污染等实际问题.而生物反硝化技术因其成本低、效果好、无二次污染等优势受到越来越多的关注[4-5].地下水含水层中反硝化的过程主要包括异养和自养反硝化[6].由于含水层大多为低营养,自养反硝化已被确定为主要的硝酸盐还原过程[7].黄铁矿(FeS2)分布广泛,成本低,能作为电子供体促进硫自养反硝化过程.如Torrento 等[8]在模拟地下水环境流动实验时发现FeS2通过提高自养反硝化细菌的种群丰度,加速了硝酸盐的去除.周娅等[9]采用黄铁矿/硫复合基质(FeS2/S0)进行自养反硝化对低碳氮比(C/N)水体进行脱氮,结果表明脱氮效果良好,TN 去除率可达72.2%.基于黄铁矿(FeS2)、单质硫(S0)或二者复合基质(FeS2/S0)驱动的反硝化作用被认为是低C/N 类水体中去除硝酸盐的主要途径[10-11].
近年来,抗生素作为一类新兴污染物常常在地下水体、土壤和沉积物中被检出[12],部分地下水区域特别是畜牧养殖、再生水利用以及污水排放地区存在抗生素与硝酸盐复合污染的现象[13-14].然而,各种抗生素由于其较高的生物活性,在不同条件下如不同种类、浓度和接触时长,会对反硝化作用产生不同程度的影响.张玉叶等[15]选取了5 种典型喹诺酮类抗生素药物,研究异养反硝化细菌对上述药物的敏感性,发现异养反硝化菌对这5 种抗生素的敏感程度会随喹诺酮类种类的变化而改变.邹华[16]研究发现以恩诺沙星(ENR)为代表的氟喹诺酮类抗生素对假单胞菌属类反硝化菌的敏感性具有高-低浓度效应,其效应临界值约为100 μg/L.邓璐等[17]研究发现随着洛美沙星(LOM)浓度升高,硝酸盐还原酶活性受到抑制程度越大.Guo 等[18]通过血清瓶批次试验发现磺胺嘧啶(SDZ)通过降低核黄素含量和反硝化酶活性来抑制反硝化电子传递活性(ETSA),而Chen等[19]发现NOR 对ETSA 有明显抑制作用,随着NOR浓度增加到100mg/L,电子传递系统的活性下降了43.3%,从而降低NO3--N 的还原效率.
然而,目前关于抗生素对生物脱氮过程的影响研究多集中于传统异养反硝化脱氮过程,且大多数抗生素浓度水平为μg/L ~ mg/L.而地下水中抗生素浓度多为ng/L ~ μg/L 低浓度水平[20],现有研究结果很难对低浓度抗生素短期胁迫下铁硫基(FeS2/S0)自养反硝化为主的修复体系的影响危害效应做出正确评估.因此,本文选择了地下水中检出率较高的恩诺沙星(ENR)、氧氟沙星(OFL)、磺胺甲噁唑(SMZ)、磺胺嘧啶(SDZ)、四环素(TCY)、土霉素(OTC)、红霉素(ERY)、螺旋霉素(SPM)作为典型抗生素,分别研究其对FeS2/S0体系反硝化效能的影响,获得了各抗生素对反硝化过程中氮素转化、关键反硝化酶活性和电子传递活性(ETSA)的影响规律,筛选出最为敏感的抗生素,旨在为评估各抗生素对地下水FeS2/S0修复系统的潜在危害和风险效应提供参考.
1 材料与方法
1.1 抗生素选择及实验水体
各类抗生素均购自中国上海阿拉丁公司(纯度>98%).实验用水取自四川省德阳地区典型红层地下水样品,过2mm 筛后外加(55±2)mg/L NO3--N 配置而成.
1.2 黄铁矿预处理及S0
单质硫为升华硫,购买自西安三浦化学试剂有限公司;天然黄铁矿购买自广西桂林松泉化工有限责任公司,使用前先将其在10% HCl 溶液中浸泡2h 以去除表面氧化物,再用去离子水清洗至中性,置于低温烘箱中过夜至干燥,然后用粉碎机粉碎过100 目筛备用.
1.3 FeS2/S0微宇宙实验体系构建与抗生素胁迫实验
模拟地下水生态微环境实验体系:反应模拟体系为500mL 的厌氧血清瓶,瓶口塞有丁基橡胶塞、补料瓶盖接头(双通盖)加黑色橡胶塞密封,瓶盖内插入适量长度气管用于取样(如图1(a)).其中,FeS2与S0质量比4:1(总填充量为5g/L),并接种40mL 本课题组前期培养得到的自养反硝化污泥[21],颗粒污泥接种前,重新富集培养 60d,确保自养反硝化菌(Thiobacillus)为主导反硝化种群(相对丰度36%;如图1(b)).富集配方(g/L):Na2S2O3·5H2O 0.64,NH4Cl 0.2,NaNO30.25,NaHCO30.15.

图1 微宇宙实验体系组成Fig.1 The composition of microcosmic experimental system
厌氧批次实验:基于FeS2/S0各个反应体系,每批次分别加入硝酸盐污染的模拟地下水400mL,每个反应体系分别加入100ng/L~500μg/L的典型抗生素,通纯N210min 以排除O2后放置于30℃、120r/min气浴震荡箱中避光反应7d.每隔24h 取15mL 水样,对水中NO3--N、NO2--N、SO42--S、TFe、Fe2+、pH值、ETSA、NAR、NIR 等进行检测.每批次连续监测7d,以研究分析典型抗生素对FeS2/S0反硝化过程的短期影响效应.
1.4 测试与计算方法
1.4.1 常规指标测定方法 本实验水体中的NO3--N、NO2--N、SO42--S、TFe、Fe2+的测定均参照国家标准方法[22].
1.4.2 污泥蛋白含量、ETSA 及反硝化相关酶活的测定 采用Folin-酚法测定细菌蛋白质含量:取1mL 样品溶液加入5mL 试剂甲混匀,于20~25℃放置10min,再加0.5mL 试剂乙(Folin-酚),立即摇匀,在20~25℃保温30min,然后于500nm 处比色,以1mL水代替样品作空白对照.试剂甲的制备如下:将1g Na2CO3溶于50mL 0.2moL/L NaOH 中,再将0.5g 硫酸铜(CuSO4·5H2O)溶于100mL 1%的酒石酸钾钠溶液,然后将前者50mL 与后者1mL 混合,现用现配.采用碘硝基氯化四氮唑蓝(INT)还原法[12]测定ETSA,硝酸盐还原酶(NAR)和亚硝酸盐还原酶(NIR)根据文献[23]测试分析.其中,ETSA 计算公式见式(1):
式中:ETSA 单位为μgO2/(g protein·min);15.9 为INT-formazan 特定吸收率;V1为甲醇体积,mL;V0为初始菌液体积,mL;t为培养时间,min;m为每mg 细菌的蛋白含量.
1.4.3 NO3--N 还原动力学及抑制率 NO3--N 还原动力学和抑制率计算均参照Zou 等[24]的方法进行.其中,NO3--N 还原的反应速率通过一级动力学模型模拟获得,拟合公式如式(2).
式中:Ct,NO3--N为t时刻拟合所得的反应体系NO3--N浓度,mg/L;C0为初始时刻拟合所得的反应体系NO3--N 浓度,mg/L;k1为NO3--N 还原的一级速率常数,d-1.
2 结果与讨论
2.1 典型抗生素对FeS2/S0 反硝化体系中氮素转化的影响
典型抗生素胁迫对 FeS2/S0反硝化过程中NO3--N 转化的影响如图2(a)所示.由于各体系中NO3--N浓度3d后趋于平稳,各体系中硝酸盐还原的抑制率按前3d 统计(表1).不同浓度的各类抗生素均对反应体系有抑制作用,抑制程度与抗生素介入浓度呈正相关.各抗生素对NO3--N 去除抑制强弱依次为OFL (5.81%~27.73%) > ENR (3.06%~14.17%)、OTC (1.95%~14.25%) > SMZ(2.54%~11.75%)、SDZ(1.87% ~ 10.90%) > TCY (1.98%~9.44%)、SPM(2.45% ~ 9.43%) > ERY (2.13%~8.47%).当抗生素介入浓度为100 和500ng/L 时,OFL 实验组的NO3--N去除抑制率分别为5.81%与7.77%,均高于其他类型抗生素的实验组,反应体系表现出了对低浓度OFL明显的敏感性.当抗生素介入浓度分别为10 和100μg/L 时,OFL 实验组的NO3--N 去除抑制率分别达到11.61%和17.75%(而其他同浓度的反应体系NO3--N 去除抑制率均<10%).当抗生素介入浓度继续增加为500μg/L 时,OFL 实验组的抑制率高达27.73%,同时,OTC、ENR 和SMZ 实验组也表现除了较高的抑制率,其值分别为 14.25%,14.17%和11.75%,而其他类型抗生素实验组的抑制率均低于10%.
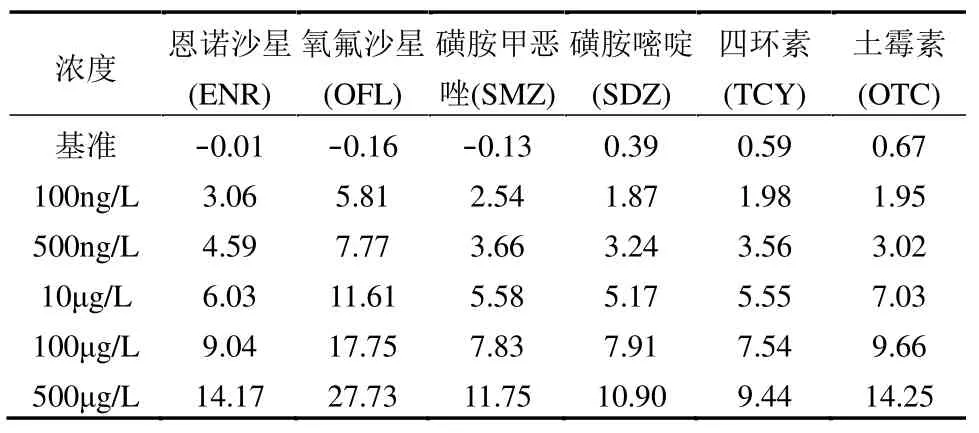
表1 不同种类抗生素胁迫对FeS2/S0反硝化过程NO3--N去除抑制率(%)Table 1 Inhibition of NO3--N removal during denitrification by FeS2/S0under different species of antibiotic stress (%)

图2 不同抗生素胁迫体系中氮素变化Fig.2 Nitrogen changes in different antibiotic stress systems
同时,各体系NO2--N 积累量呈现先增加(1~3d)后降低(4~7d)的趋势,至反应第7d 保持在较低浓度(图2(b)).其中ENR、OFL 与OTC 实验组随抗生素浓度提升,NO2--N 最大积累量表现出下降的趋势,OTC 实验组NO2--N 最大积累量最低且达到最大积累量的时间点滞后.空白组在反应第 3d NO2--N 达最大积累量,为(5.60±0.05) mg/L,ENR 与OFL 实验组5 个梯度浓度(100ng/L~500μg/L)下NO2--N 最大积累量分别为(5.25±0.13)与(4.02±0.03) mg/L、(4.88±0.15)与(3.88±0.18) mg/L、(3.50±0.01)与(3.43±0.05) mg/L、(2.90±0.00)与(3.38±0.02)mg/L、(5.18±0.10)与(4.49±0.03) mg/L;OTC 实验组则在反应第4d 达NO2--N 最大积累量,分别为(3.80±0.05) mg/L、(3.80±0.03) mg/L、(3.79±0.04)mg/L、(3.67±0.04) mg/L 与(3.39±0.08) mg/L,但经7d 反硝化后NO2--N 积累浓度下降,与其他典型抗生素实验组差异不大,而ENR 与OFL 实验组则NO2--N 积累浓度略高于其他抗生素实验组.值得注意的是,抗生素介入后,各反硝化体系中NO2--N的生成速率与去除速率差别较为明显,普遍表现出NO2--N 去除速率低于NO2--N 生成速率(图2c).有研究表明,反应体系中NO3--N 对NO2--N 还原酶基因表达具有显著的抑制作用,是NO2--N 积累的关键因素[25].本实验中,随着介入反应体系中的抗生素浓度升高,各反应系统中NO3--N 去除率下降促进了NO2--N 的积累,导致各体系中NO2--N 浓度呈现单峰规律变化,反应7d后,其浓度均降到1.0mg/L以下.
2.2 各反应体系中TFe、Fe2+及SO42--S 变化
批次实验过程中,各反应体系均检测到TFe、Fe2+,且7d 内各反应体系中TFe、Fe2+浓度呈现先增加后降低的变化趋势(图3),各批次空白组均在反应第1d 达最高浓度,分别(0.775±0.01)与(0.485±0.01)mg/L,第7d 降低至(0.235±0.01)与(0.165±0.01) mg/L,而抗生素实验组则随胁迫浓度的增加,TFe 与Fe2+达到浓度峰值的时间节点表现出滞后或提前.如100~500ng/L 水平胁迫下,TCY、OTC、ERY 和SPM 实验组TFe 浓度变化节点与空白组之间无明显差异;ENR、SMZ 与SDZ 实验组于第2d 达到最大TFe浓度,而OFL实验组于第3d达到最高浓度,表现出滞后性.而10~500μg/L 胁迫下,ENR、OFL 与SMZ 实验组达到最高浓度的时间点表现出1~2d 滞后,其中ENR 与OFL 实验组在100 与500μg/L 时,均于第2d达到最高浓度,分别为(0.925±0.02)、(0.885±0.01)mg/L (100μg/L)与(0.795±0.01)、(0.775±0.01) mg/L(500μg/L),高于空白组,随后浓度逐渐降低,至第7d 低于空白组浓度.典型抗生素胁迫实验组中Fe2+浓度变化趋势不一,且这种趋势与抗生素类型及浓度无相关性.随抗生素浓度由ng/L 提升至μg/L 水平,实验组Fe2+浓度逐渐降低,各实验组与空白组间Fe2+浓度变化差异更加明显,但至反硝化第7d 均降低至较低浓度,与空白组无显著差异.由此可以看出,抗生素的介入,对FeS2/S0反硝化体系Fe2+的释放有一定的影响,并且μg/L 体系的抑制效果明显大于ng/L 体系.

图3 典型抗生素胁迫下体系TFe、Fe2+浓度变化Fig.3 Concentration variations of TFe and Fe2+ under the stress of typical antibiotics
另外,随着各反应体系中NO3--N 逐步降低,各反应体系中SO42--S 浓度呈现先增加后保持稳定的变化趋势(图4).空白组运行至第7d 时SO42--S 浓度为(223.34±13.47) mg/L,高于各实验组体系.同时,各实验组体系中产生的SO42--S 浓度与介入抗生素浓度密切相关,一般表现为负相关关系.当抗生素浓度分别为10、100 和500μg/L 胁迫下,反应7d 后的各实验组中SO42--S 浓度与空白组间的差异愈发明显,尤其是OFL 实验组.如各μg/L 浓度水平抗生素胁迫下,OFL 反应体系中SO42--S 浓度分别为(178.10±3.37) mg/L、(173.34±10.10) mg/L 和(149.53±23.57)mg/L,明显低于空白组和理论值[26].由此可推测,随着抗生素浓度的提高,各反应体系中反硝化细菌受抑制性增强,铁硫基自养反硝化引导的硝酸盐还原过程受到明显抑制,最终导致体系中硫酸盐的生成量降低.

图4 不同抗生素不同浓度胁迫下SO42--S 浓度变化Fig.4 Changes of SO42--S concentration under different antibiotic stresses
2.3 NO3--N 还原动力
采用一级动力学方程对抗生素介入实验体系中NO3--N 还原的过程进行拟合(3d 后硝酸盐去除趋于稳定,反应速率≈0,舍弃该段过程),结果如图5 所示.
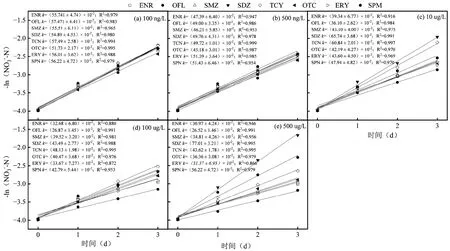
图5 不同抗生素胁迫下NO3--N 去除一级反应动力学拟合Fig.5 Fitting results of first-order reaction kinetics of nitrate removal under different antibiotic stress
当抗生素介入浓度为100ng/L 和500ng/L 水平时,各反应体系中的k值差别不大,说明ng/L 浓度水平的各抗生素短期冲击对硝酸盐还原没有实质的抑制性差异.随着抗生素介入浓度升至为10μg/L 时,各反应体系中k值差距变大,尤其是OFL 反应体系的k值下降为(36.10 ± 2.62)×10-2d-1,开始明显低于其他反应体系,说明该FeS2/S0自养为主的反硝化体系对OFL 比较敏感.当抗生素介入浓度升至为100μg/L 和500μg/L 时,OFL 反应体系的k值进一步下降为(26.87±1.45)×10-2d-1和(26.52±1.46)×10-2d-1,说明OFL 对FeS2/S0反硝化体系硝酸盐还原抑制作用具有明显的浓度效应.此外,随着抗生素介入浓度不断提高,反应体系的k值下降明显的还有ENR 和OTC 反应体系.当抗生素浓度由100ng/L逐渐上升到500μg/L,ENR 和OTC 实验组中NO3-的还原速率常数分别由(55.74±4.74)×10-2d-1和(51.73±2.17)×10-2d-1下降到(30.97±4.24)×10-2d-1和(36.36±3.08)×10-2d-1.有研究表明,速率常数k值可以反映由抗生素种类与浓度影响的NAR 活性,间接反映硝酸盐还原过程受阻程度[27].因此,各反应体系NO3-还原动力学速率常数变化表明,μg/L水平的OFL对FeS2/S0反硝化体系硝酸盐还原抑制作用显著.
2.4 NAR、NIR 酶活、ETSA 变化及影响机制讨论
各反应体系中NAR 和NIR 酶活性变化如图6所示.空白组和各实验组反硝化酶活性变化趋势一致,呈先增后降的单峰变化.反应前3d 各体系中NAR 活性逐渐增强,至第3d达到最大值,这与NO3--N的快速去除和NO2--N 的快速积累一致,随后其活性不断下降直至第7d 反应结束时降到较低水平.各反应体系中NAR 的峰值略有不同,对OFL、ENR 和OTC 胁迫的反应体系,第3d 时其NAR 活性(6.202~7.946,6.302~7.664,6.519~7.865nmol/(mg·min))明显低于其他实验组和空白组(8.191nmol/(mg·min)),这也表明反硝化体系中NAR 酶活性对OFL、ENR 和OTC较为敏感.研究表明,氟喹诺酮类抗生素由于其稳定的化学结构,生物可降解性更弱,且毒性更强[28],这与ENR 和OFL 介入体系中更低的NAR 酶活性一致.NAR催化反应体系中 NO3--N还原转化为NO2--N,是微生物厌氧反硝化的第一个关键环节.本实验中,OFL、ENR 和OTC 介入的反应体系NAR酶活性低于其他实验组,是导致其硝酸盐还原速率较其他组低的主要原因.其他抗生素胁迫下NAR 受到的抑制情况则并未随着浓度提高而有显著差异,但与空白组相比,也略有下降.与此同时,空白组与各实验组NIR 活性变化趋势一致,在反应的1~4d 内不断增强,于第5d 达到最大值,随后开始下降.介入抗生素浓度较低时(<100ug/L),各实验组NIR 活性相差不大,但当各实验组的抗生素浓度高于100ug/L 后,相对于空白组6.880nmol/(mg·min),其NIR 活性抑制开始明显,其中以OFL、TCY 和ENR 反应体系受抑制程度最大,第5d 时三者的NIR 活性分别为5.082,5.092,5.154nmol/(mg·min).整个实验过程中,NIR 活性变化相较于亚硝酸盐浓度变化存在滞后现象,这可能是由于硝酸盐得电子能力强于亚硝酸盐,体系优先利用NAR 将NO3--N 还原为NO2--N,导致反应体系中亚硝酸盐的短暂积累[9].

图6 典型抗生素胁迫下NAR、NIR 活性变化Fig.6 Changes of nitrate reductase and nitrite reductase activities under different antibiotic stress
反硝化过程需要消耗电子将NO3--N 还原为气态氮,电子的产生和传递在反硝化过程中起着重要的作用.各典型抗生素介入后反应体系ETSA 的变化情况如图7 所示.抗生素介入后各反应体系的ETSA 均受到明显的抑制,且受抑制程度随抗生素浓度升高而加剧.反应7d 后,与空白组相比(0.095±0.01)μgO2/(g protein·min)),各浓度抗生素介入反应体系的ETSA 数值均有不同程度的下降,尤其是OFL 胁迫体系的ETSA 数值下降幅度最大.抗生素胁迫浓度分别为100 和500ng/L 水平时,OFL 实验组的 ETSA 相较于空白组分别下降了 36.84%与47.37%,下降幅度明显高于其他类型抗生素胁迫组.其中,对于TCY 和SPM 抗生素介入的体系而言,其ETSA 活性的受抑制程度最小,下降幅度在10.53% ~15.79%和15.79% ~ 26.32%范围内,而其他反应体系在100 和500ng/L 水平抗生素的胁迫下,ETSA 活性分别下降了15.79% ~ 21.05%与15.79% ~ 36.84%.当抗生素介入浓度升至10, 100 和500 μg/L 时,OFL实验组的ETSA 分别下降了47.37%、57.89%与57.89%,而其他典型抗生素则下降了 21.05% ~36.84%、26.32% ~ 47.37%与42.11% ~ 52.63%.抗生素的介入阻碍了反硝化体系的电子传递,从而降低了反硝化能力,其中以OFL 抑制电子传递活性的能力最强,佐证了ug/L 水平的OFL 对FeS2/S0反硝化体系硝酸盐还原抑制作用最为显著.

图7 不同抗生素胁迫下电子传递活性(ETSA)Fig.7 Changes of ETSA under different antibiotics stress
综上,抗生素的介入会抑制FeS2/S0反硝化过程的NAR、NIR 酶活及电子传递,从而影响反硝化效果.Guo 等[29]通过血清瓶批次试验,探究了磺胺嘧啶(SDZ)在电子转移和消耗水平上对反硝化的抑制作用,表明SDZ 通过降低核黄素含量和反硝化酶活性来抑制反硝化ETSA.也有研究表明,ETSA 值不仅依赖于体系的电子转移性能,还很大程度上取决于反硝化酶的电子消耗能力[30].反硝化反应中每步均存在电子竞争的问题,相应的还原酶活性越强,其电子竞争能力就越强,对应的电子传递活性ETSA 则越强[31].本实验中,一方面,通过对各反硝化过程中NAR、NIR关键反硝化酶活性动态变化与ETSA 分析发现,随反应体系中抗生素浓度增高,尤其是大于100μg/L 时,各反应体系的NAR、NIR 活性的降低较为明显,从而进一步导致ETSA 值的降低,NAR、NIR 酶活和ETSA的降低是导致硝酸盐还原过程受到抑制的关键原因.另一方面,在FeS2/S0自养反硝化过程中,Fe2+的存在增强了电子转移的能力,降低了电子转移电阻,进而加速了自养反硝化速率.Li 等[32]研究表明,Fe2+可刺激自养反硝化菌分泌更特异的化学信号分子,进而改善微生物通信,故Fe2+的存在能够加速自养反硝化过程中TN 的去除.因此,若Fe2+在TFe 含量中所占比例越大,则体系反硝化效能越好.本实验中,由于典型抗生素的介入,产生Fe2+含量低于空白组,影响了反应体系的ETSA 的值,使得各体系反硝化过程进行不彻底.硝酸盐还原的动力学系数k值进一步表明,ng/L 浓度水平的各抗生素短期冲击对硝酸盐还原没有实质的抑制性差异,而抗生素介入浓度升至μg/L 水平时(10~500μg/L),各反应体系中k值差别开始明显,尤其是OFL 反应体系的k值下降幅度最大,明显低于其他反应体系,且硝酸盐还原速率k值和反应体系中的NAR、NIR 和ETSA 活性密切相关.
3 结论
3.1 100ng/L~500μg/L 典型抗生素短期胁迫对FeS2/S0自养反硝化体系NO3--N 的还原作用均表现出抑制作用,且抑制作用与浓度呈正相关;与此同时,各反硝化体系普遍表现出NO2--N 去除速率低于NO2--N 生成速率;反应结束后体系中SO42--S、TFe和Fe2+浓度与NO3--N 去除率呈正相关,各浓度水平下OFL 实验组对反硝化效能抑制最为显著.
3.2 100ng/L~500μg/L 浓度胁迫的FeS2/S0体系硝酸盐还原过程符合一级动力学反应.ng/L 水平不同抗生素胁迫不会引起组间k值较大差异,但当浓度升至为10~500μg/L 时,各反应体系中k值差值逐渐增大,且OFL 反应体系的k值明显低于其他反应体系.
3.3100ng/L~500ug/L 浓度抗生素胁迫时,反硝化体系中NAR 活性对OFL、ENR 和OTC 较为敏感,其NAR 酶活性低于其他实验组;当抗生素浓度高于100ug/L 后,各实验组反应体系的NIR 活性出现明显抑制,NIR 活性变化相较于NO2--N 浓度变化存在滞后现象,出现NO2--N 短暂积累.
3.4 各抗生素介入均能降低体系的ETSA,下降幅度与抗生素浓度呈正相关,其中以OFL 胁迫体系的ETSA 数值下降幅度最大:当OFL 介入浓度为100ng/L~500μg/L,其 ETSA 数值下降 36.84%~57.89%,进而导致整体反硝化速率显著降低.
