海藻酸钠-活性炭固定化藻菌球的制备及其对碱性橙Ⅱ的降解
2024-03-08赵联芳丁奎元于雪晴河海大学环境学院江苏南京210098河海大学浅水湖泊综合治理与资源开发教育部重点实验室江苏南京210098
赵联芳,丁奎元,于雪晴 (1.河海大学环境学院,江苏 南京 210098;2.河海大学,浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098)
印染废水是纺织业中的主要污染源之一,约70%的染料由偶氮染料组成[1-2].其中,碱性橙Ⅱ是一种典型的碱性阳离子偶氮染料[3],广泛应用于纺织、皮革、纸张等的染色.碱性橙Ⅱ废水释放到水体中会产生明显的色度,其降解中间产物具有剧毒性、致突变性和致癌性[4],严重威胁生态环境.并且与阴离子染料相比,阳离子染料毒性更强,它们易与带负电荷的细胞膜表面相互作用进入细胞,从而产生健康问题[5],因此有效降解水体中的碱性橙Ⅱ十分重要.目前常用的处理方法有物理、化学以及生物法[6-8].物理法和化学法因其成本高、能耗大、产生二次污染等缺点而受到很大限制[9],相较之下生物法操作方便,更具有成本效益和环境可持续性[10].然而,随着排放标准的提高以及印染废水高毒性的特点,传统的活性污泥法已经逐渐不能满足出水要求[11].近年来,研究者将藻类与活性污泥结合处理染料,发现相较于单一的处理工艺有更好的处理效果[11-12].细菌和藻类之间可以通过气体和营养物质的交换形成共生系统,不仅可以提高处理效率还能增强系统的耐受能力[13-14].但是传统的悬浮型菌藻系统生物量易流失,稳定性较差[15],在应用中受到一定的限制.相比之下,固定化菌藻系统因具有微生物密度高、分离提取操作简单、可重复利用,抵抗性强等优点而受到研究者的青睐[16].
海藻酸钠(SA)包埋法是目前常用的一种固定化技术,其形成的凝胶球具有良好的稳定性[17].包埋材料带来的扩散阻力导致的缺氧环境有助于胶球内好氧-厌氧多层环境的形成和不同微生物群落的增殖[18],为偶氮染料的降解创造了环境条件.有研究表明在包埋时添加活性炭(AC)可以增加固定化胶球内部的孔隙结构,从而显著提高传质性能[19],促进污染物与微生物的接触,改善包埋法机械强度差的缺点[20].此外AC 表面有丰富的含氧官能团,这为阳离子染料在AC 上的高效吸附提供了基础[21].在目前的研究中,利用SA-AC 固定化藻菌系统处理偶氮染料废水的研究还鲜见报道.
因此,本研究以偶氮染料碱性橙Ⅱ为目标污染物,以SA 和AC 为固定化材料,采用响应面法对固定化藻菌球的制备条件进行优化,并用扫描电镜(SEM)观察了藻菌球的外部和内部结构.为考察藻菌球的处理效果,研究了进水染料浓度、pH 值和光照强度等因素的影响,并采用紫外-可见全波长和GC-MS扫描法进一步分析了碱性橙Ⅱ的降解过程.该研究为探索菌藻共生系统处理偶氮染料废水提供了一定的理论参考.
1 材料与方法
1.1 材料与试剂
活性污泥取自安徽某印染厂的水解池.取回后加入蒸馏水对污泥进行洗涤,去除污泥表面吸附的杂质.接种藻类取自南京某污水厂的二沉池出水堰壁,静置弃去上清液,经200 目筛网过滤后得到藻类悬浮液,接种于BG11 培养基,并置于光照培养箱中扩大培养(光强:2030lux,温度:25 ℃,光照周期:12h/12h).
椰壳活性炭(DAIZEN)经研磨过筛后得到粒度为40~80 目的颗粒活性炭,使用前用蒸馏水加热煮沸,105℃下干燥箱(GZX-9070)内烘干后装入封口袋备用.所用SA 及CaCl2均为分析纯.本试验采用人工配水,主要成分和微量元素浓度[22]如表1 所示.采用的偶氮染料为碱性橙Ⅱ(Aladdin),分析纯,分子式为C12H12N4∙HCl,分子量为248.72.

表1 人工配水方案Table 1 Synthetic wastewater distribution scheme
1.2 试验方法
1.2.1 固定化菌藻球的制备 藻菌球的制作流程见图1.活性污泥(MLSS=4~6g/L)和微藻(OD680=1.154)经4000r/min、离心10min 后收获,之后重新充分悬浮在蒸馏水中后再次离心,重复3 次洗去培养成分残留,防止其对实验的干扰.将一定含量的SA和AC 加入到蒸馏水中溶解,放到120℃高压灭菌锅(SYQ-DSX-280B)内灭菌20min,随后加入一定含量离心得到的微藻和活性污泥.混合均匀后吸入注射器(12 号针头)内,在离液面20cm 处将混合液滴入CaCl2溶液中形成直径约为3~4mm 的凝珠,凝珠在CaCl2溶液中硬化.随后用蒸馏水清洗3~4 次.

图1 固定化藻菌球制作流程Fig.1 Production process of immobilised algal–bacteria pellets
通过前期单因素试验[23]对成球效果、传质性能、小球密度和小球机械强度的考察,确定最适CaCl2浓度为2%,固定化时间为14h,活性污泥和混合藻类的质量比为2:1.SA 浓度、AC 浓度和菌藻混合物包埋量的最适取值范围分别为2%~3%,0.5%~1%,0.5%~1.5%.考虑到SA 浓度、AC 浓度和菌藻混合物包埋量对藻菌球脱色和降解碱性橙Ⅱ的效果有重要影响,根据Box-Behnken 原理设计3 因素3水平响应面试验,对这3 个固定化参数进行进一步优化,试验设计见表2.将20mL 制成的藻菌球接种入内装200mL 上述人工配水(碱性橙Ⅱ:50mg/L,葡萄糖:200mg/L,pH 值:7.0)的250mL厌氧瓶中,使用全光谱照灯(Ledesk)提供光照,光照强度为8000lux,光照周期为14h/10h.静置反应72h 后,以脱色率为考察指标,对结果进行响应面回归分析.

表2 响应面设计因素及水平Table 2 Factors and levels of the response surface experiment
1.2.2 藻菌球的活化 由于活性污泥和混合藻类经包埋后微生物増殖能力和酶活性均有一定程度的降低,为使其恢复活性,取得更好的处理效果,对制备得到的、藻菌球进行活化:将采用最佳制备参数条件制成的藻菌球加入内装 200mL 人工合成废水的250mL 厌氧瓶中,进水条件及光照条件与响应面法一致.藻菌球与废水的体积比为 1:10,摇动搅拌使藻菌球与碱性橙Ⅱ废水充分接触,之后静置反应72h.
1.2.3 碱性橙II 的降解效果 在最佳固定化条件下制备并经上述响应面法试验条件驯化72h 得到藻菌球,之后改变进水染料浓度、pH 值和外加光照强度,在进水后反应10, 24, 34, 48, 58, 72h 时进行取样,检测水体中的碱性橙Ⅱ浓度和总有机碳(TOC)含量,考察藻菌球在多种进水条件下对碱性橙Ⅱ的处理效果.当进水染料浓度为100mg/L,pH 值为7.0,外加光照强度为8000lux 时降解效果较好,因此在该条件下对试验组出水中的物质进行测定紫外-可见光全波长(UV-vis)扫描和气相质谱联用分析(GC-MS)以分析碱性橙Ⅱ的降解过程.
1.3 测试和分析方法
通过紫外分光光度计全波长扫描发现碱性橙Ⅱ最大吸收波长为406nm,在此波长下得到染料浓度与吸光度的线性关系,由此可得到试验水样中的染料浓度.利用TOC 测定仪(V CPN,日本岛津)测定水样TOC.脱色率和TOC 去除率按照以下公式进行计算:
式中:A0和At分别为进水和出水在相应波长下的吸光度.TOC0和TOCt分别为进水和出水的TOC 值,mg/L.
活化前后藻菌球的外部和内部特征采用扫描电子显微镜(SEM)观察,采用pH 计(PHS-3G,雷磁)确定水样的pH 值.采用便携式溶氧仪(JPB-607A,雷磁)测定DO 浓度.
本试验对每个指标收集3 个平行样.采用平均数±标准差(μ±σ)的统计学结果进行表达,计算出试验结果可能达到的准确范围.
2 结果与讨论
2.1 藻菌球制备条件优化
以SA 浓度、AC 浓度、菌藻混合物包埋量为考察因素,脱色率为响应值,经Box-Behnken 试验设计共得到17 组实验点.其中,13~17 为中心点,共进行了5 次,用来估计误差.试验结果见表3.
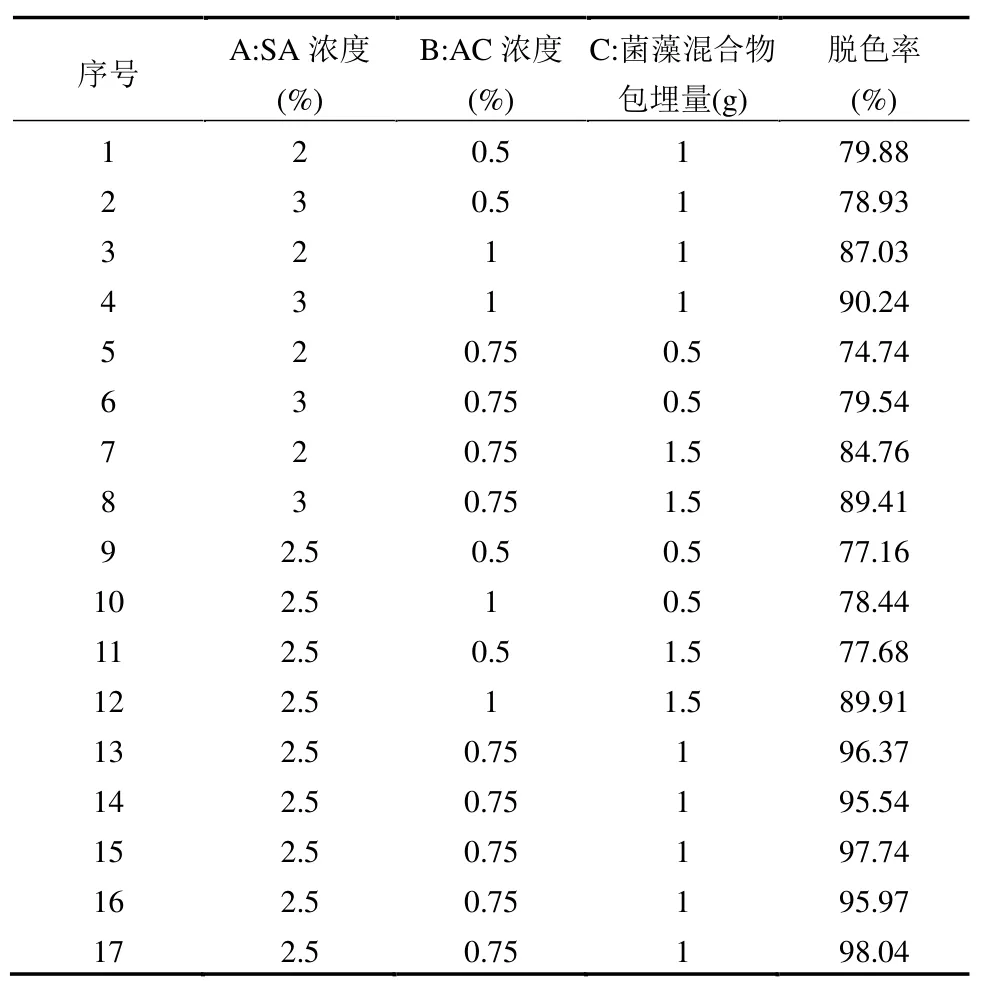
表3 响应面法试验结果Table 3 Results of the response surface experiment
对结果进行响应面分析,得到脱色率(R)与SA浓度(A)、AC 浓度(B)和菌藻混合物包埋量(C)之间的多元回归方程为:
回归方程的方差分析见表4.
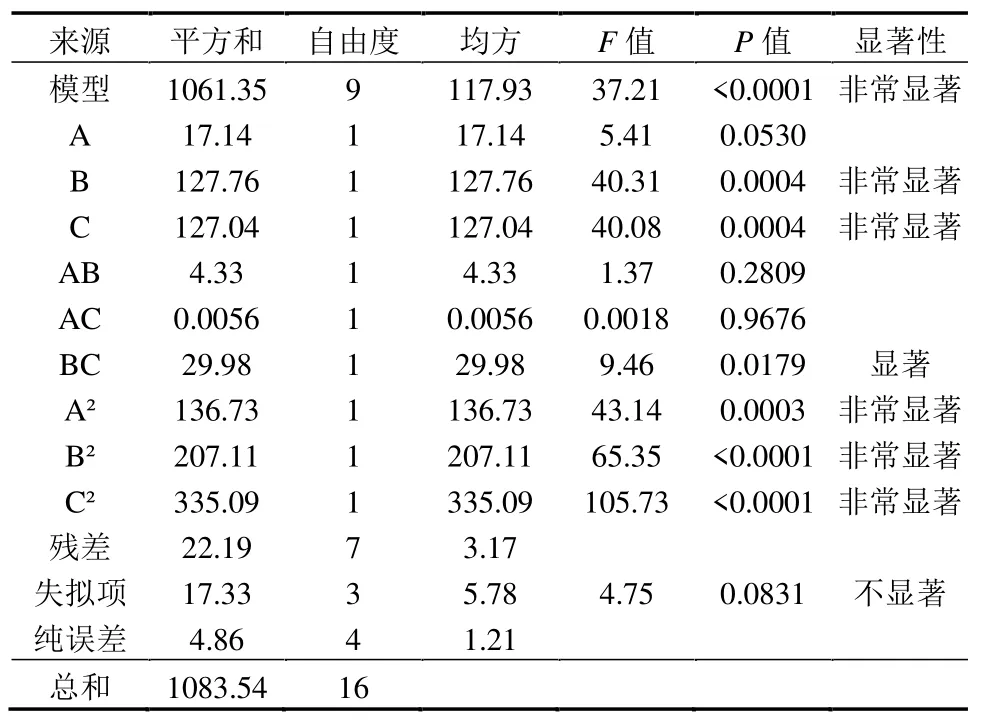
表4 回归模型方差分析Table 4 Analysis of variance in regression model
模型的P值<0.0001,达到非常显著水平,表明模型可靠;模型的失拟项P值为0.0831,大于0.05,不显著,说明模型无失拟因素,在试验范围内拟合情况好.因此,该模型可靠度高,能够进行预测分析.
对回归方程系数进行检验,对响应值脱色率的影响达到非常显著水平的有一次项B、C,二次项A2、B2和C2,影响达到显著水平的有交互项BC.因此,SA浓度、AC 浓度和固定化生物量都对脱色效果具有显著影响.且AC 浓度和固定化生物量存在显著的交互影响.通过F值和P值的大小可以判定回归方程中各系数对响应值脱色率的影响强弱,F值越大、P值越小,则该系数的影响越大;模型回归方程中系数的绝对值也能反映该项对于脱色率的影响强度,绝对值越大该系数影响越大.因此,根据结果,各单因素的影响排序为B≥C>A,即AC 浓度≥固定化生物量>SA 浓度.
固定1 个因素在中心值,考察其余2 个因素对脱色率的交互影响,响应曲面图和等高线图如图2所示.图2a、b 中的响应曲面走势较平缓,等高线接近圆形,说明SA 浓度和AC 浓度、SA 浓度和固定化生物量的交互影响较弱.图2c 中的响应曲面走势较陡,等高线呈椭圆形,说明AC 浓度和固定化生物量的交互影响较强,与显著性检验的结果吻合.

图2 两因素交互作用对脱色率的影响Fig.2 Effects of the interaction of two factors on the decolourisation
利用Design Expert 软件对二次模型进行最优值分析,得到最优值即脱色率取得最大值时的最优解如表5 所示.在此条件下进行3 次验证性实验,得到脱色率分别为96.99%、98.07%、98.69%,相对误差均值<1.5%.因此模型预测结果可靠,具有指导意义.
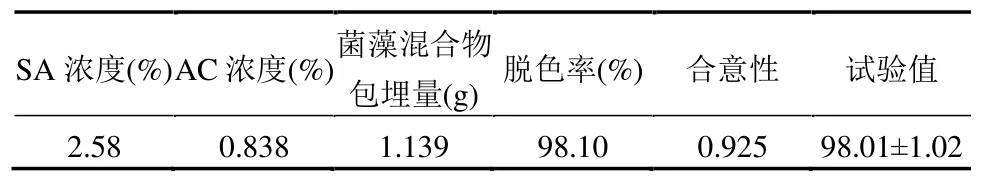
表5 模型验证试验结果Table 5 Model validation test results
2.2 藻菌球的SEM 分析
由图3A1 可见,活化前的藻菌球表面局部区域有球状团聚物.放大后(图3A2)可以看到藻菌球表面呈现多层次扇形结构,具有较大的比表面积,有利于对碱性橙Ⅱ染料分子的吸附.由图3B1 可见,活化后的藻菌球表面有多种形态的微生物附着生长,推测经过一段时间的活化过程,包埋在小球内部的微生物不断生长并在寻找合适的氧气环境,部分穿过固定化载体并在小球的表面上附着生长.进一步放大(图3B2)发现微生物与固定化基质紧密连接,且观察到黏性物质,推测为藻菌共生系统产生的蛋白、多糖等胞外聚合物(EPS).EPS 一方面增强了包埋效果,有助于维持结构稳定性[24].另一方面也有利于藻和细菌对碱性橙Ⅱ毒性的抵抗作用.

图3 活化前后藻菌球外表面SEM 图Fig.3 SEM images of the outer surfaces of algal–bacteria spheres before and after activation
活化前的藻菌球内部呈现为结构致密的网状结构(图4A1),放大(图4A2)发现内部存在着大量孔隙,允许反应底物的传递.这些孔隙也保证了藻菌球的透光性,藻能够正常进行光合作用.此外,观察到藻菌球各层网状结构之间存在着丝状物质,这可能是由于微生物分泌了EPS,EPS 的官能团会与SA 发生交联作用,改变凝胶球的内部形貌[25].由图4B1 可见,活化后藻菌球内部结构发生了明显的变化,藻和细菌的增殖生长使得SA 凝胶中的孔隙被进一步填充,结构更为致密,但出现了形状不规则的较大的孔洞,有利于污染物、营养物质、氧气和光照等的传递[26].进一步放大后(图4B2)可见,活化后的藻菌球内部也存在着大量黏性物质EPS,使得整体结构更加紧密和稳定.

图4 活化前后藻菌球内表面SEM 图Fig.4 SEM images of the inner surfaces of algal–bacteria spheres before and after activation
2.3 进水条件的影响
2.3.1 进水染料浓度 在微生物降解染料的过程中,染料初始浓度对脱色反应过程有较大影响[27-28].如图5a 所示,进水染料浓度从50mg/L 增加到250mg/L,72h 脱色率均达到90%以上;当进水染料浓度较低时,脱色可以在短时间内达到良好的效果,当进水染料浓度过高时脱色效果会受到影响.如进水染料浓度为50mg/L 时,藻菌球在24h 内对其脱色效果达到了96.5%,几乎达到完全脱色,当进水染料浓度增加到200mg/L 时,48h 内脱色率为90%,当进水碱性橙II 浓度达到250mg/L 时,虽然72h 脱色率仍有90%,但较之低进水浓度脱色率明显降低.分析认为这可能是因为较高浓度的染料会对微生物产生更大的毒性,进而抑制了微生物的活性,微生物需要更长的时间来适应,也可能是因为缺乏更高的生物量导致脱色率下降[29].另一方面,在冯晓丽[30]的研究中,固定化产电菌小球处理200mg/L 阳离子染料X-GRL 时,48h 脱色率仅为24.2%,意味着本研究制备的藻菌球中的藻类可能对碱性橙Ⅱ的脱色发挥了重要作用.藻细胞内含有叶绿素及其他光和辅助色素,叶绿素在光照下会形成水和电子(eaq-)和电子空穴(Chl+),可与O2作用形成活性氧自由基(ROS)[31].由图6可见,BQ 和TBA 的加入使得脱色率分别下降了4.87%和4.31%,表明藻在光作用下引发的·O2-和·OH 在藻菌球降解碱性橙Ⅱ的过程中发挥了一定的作用.

图5 不同进水染料浓度下脱色率、TOC 去除率、DO 浓度变化Fig.5 Changes in decolourisation rate, TOC removal rate and DO concentration change under different influent dye concentrations

图6 不同捕获剂对碱性橙Ⅱ降解效果的影响Fig.6 Effects of different capture agents on the degradation of basic orange Ⅱ
由图5b 可见,TOC 浓度在前10h 内迅速下降,但在10~24h 里缓慢回升,分析认为是由于碱性橙II分解产生的大量小分子中间产物还未来得及发生矿化作用,仍然以有机态溶解于水中,导致系统TOC浓度上升[32],后文的UV-Vis 扫描和GC-MS 检测分析也证实了此分析;在24~72h 内TOC 浓度随着时间呈现缓慢下降的趋势.最终在72h 内,藻菌球对4 组不同进水染料浓度碱性橙Ⅱ废水的TOC 去除率分别为87.68%、89.31%、85.06%、79.25%.
根据对染料降解过程中水中DO 浓度的检测(图5c)可见,试验进水DO 为(6.00 ± 0.25),各组试验在10h 后DO 均降到了0.30mg/L 以下,之后一直未超过0.30mg/L.考虑到藻类的存在,几乎为零的DO浓度实际上反映了藻类光合作用和细菌呼吸的紧密耦合,即藻类产生的氧气被细菌充分利用,细菌又为藻类产生CO2,这和Ji 等[33]的试验结果一致.因此推测认为藻类光合作用产生氧气使得固定化菌藻球中出现厌氧-好氧多层环境,这是藻菌球能够基本实现中间降解产物彻底矿化,保证良好的TOC 去除效果的重要原因.
2.3.2 进水pH 值 实际情况下偶氮染料废水成分极其复杂,其中pH 值是影响微生物脱色效率的重要因素[34].它能通过影响细胞膜表面电荷性质及通透性,干扰微生物对染料分子的吸收与转运,限制微生物对染料的脱色[35].图7 为不同进水pH 值对碱性橙Ⅱ降解效果的影响,当进水pH 值在6.0~10.50 范围内时,试验组72h 脱色率无显著差异,均保持在97%以上,说明固定化处理在一定程度上提高了微生物对酸性环境和碱性环境的耐受能力,这是由于固定化基质的传质屏障作用会阻碍H+向基质中细胞的运输[36].此外,相比于单一活性污泥系统,菌藻共生系统产生的EPS 浓度更高[37],也有助于其对于恶劣环境条件的适应.

图7 不同进水pH 值时试验组72h 脱色情况及TOC 去除情况Fig.7 Decolourisation and TOC removal in the experimental group at 72h under varying influent pH
TOC 的去除率在 pH 值为 7 时达到最高(89.31%),当进水pH 值分别为6.0、10.50 时,试验组72h TOC 去除率分别降到了78.46%、74.82%,可见酸性或者碱性条件都会影响藻菌球对TOC 的去除.这是因为不同的pH 值会改变微藻中酶的结构和活性[38],酸性或者碱性胁迫抑制了藻类生长[39],藻类的光合速率降低,产氧能力下降.使得芳香胺类中间产物的进一步降解受到影响.徐怡[40]利用固定化嗜盐菌-杜氏藻共生系统处理腌制废水时也得到类似的结果,当初始pH 值分别为5.0 和9.0 时,脱氮除磷效果较差.
2.3.3 光照强度 在自然条件下,由于白天和黑夜的交替,光照强度会发生变化.光通过调节营养吸收、细胞原生质合成和产物积累在微藻生长中起着重要作用[41].本试验通过改变全光谱照灯与厌氧瓶底的距离改变外加光照强度,考察其对藻菌球降解碱性橙Ⅱ效果的影响,同时进行空白对照,以探究纯光照对碱性橙Ⅱ的降解作用,结果如图8 所示.当光照强度分别为2000, 8000, 16000lux 时,试验组72h脱色率分别为93.42%、98.04%、92.76%;TOC 去除率分别为77.23%、89.31%、77.43%.空白组72h 脱色率分别为0.77%、3.34%、6.79%;TOC 去除率接近于0,因此忽略不计.综合来看,光照强度对各组脱色效果无显著差异,但是对于TOC 的去除影响较为明显.TOC 的去除主要依靠好氧微生物的作用,而藻类通过光合作用产生的氧气对好氧微生物的生存至关重要[42].较低或较高的光照强度会导致光限制或光抑制现象,从而影响了微藻细胞的光和产氧[43].邬容伟等[44]认为小球藻光合作用的光饱和点在4217~10126lux 之间,当光照强度超过这个范围时,藻类的生长受到了抑制,进而影响了好氧菌的活性,导致TOC 的去除率下降.可以看出,藻菌球对碱性橙Ⅱ降解的最佳光照强度为8000lux.
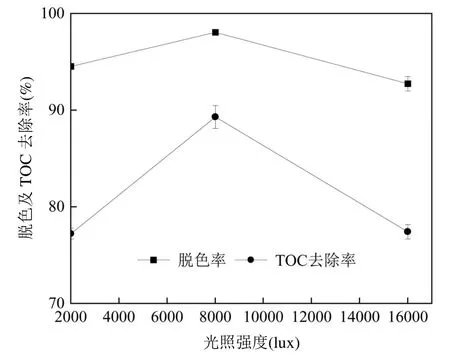
图8 不同光照强度下试验组72h 脱色情况及TOC 去除情况Fig.8 Decolourisation and TOC removal in the experimental group at 72h under different light intensities
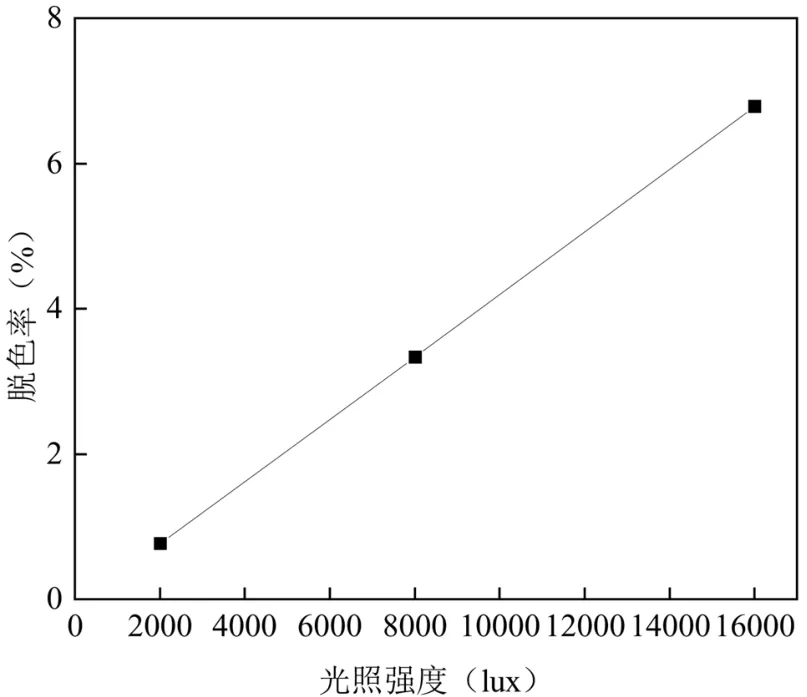
图9 不同光照强度下空白组72h 脱色情况Fig.9 Decolourisation in the blank group at 72h under different light intensities
2.3.4 藻菌球的重复利用效果 本研究利用固定化藻菌球对碱性橙Ⅱ进行了5 次重复降解试验,脱色及TOC 去除情况如图10 所示,材料耗损情况如图11 所示.在第5 轮试验中,藻菌球的脱色率可以达到90.02%.TOC去除率可以达到89.43%,说明固定化藻菌球在5 次循环利用过程中的脱色和TOC 去除效果较为稳定,虽会有部分损耗,但大部分藻菌球仍可保持较好的结构.

图10 重复利用时藻菌球脱色及TOC 去除情况Fig.10 Decolourisation and TOC removal of algae balls during reuse

图11 重复利用时藻菌球耗损情况Fig.11 Consumption of algae balls during reuse
藻菌球中叶绿素a 含量变化如图12 所示,在循环利用过程中,藻菌球的叶绿素a 含量持续增加,说明藻类在偶氮染料废水中保持了较高的活性,能够进行正常的光合作用并获得较为理想的叶绿素a 积累.研究表明,藻菌共生系统能产生较高浓度的EPS,能够有效促进微生物的聚集,提高共生系统的稳定性[37].

图12 重复利用时两个实验组叶绿素a 含量变化Fig.12 Changes in chlorophyll a content in the two experimental groups during repeated use
2.4 碱性橙Ⅱ的降解过程分析
采用UV-Vis 扫描和GC-MS 检测分析碱性橙Ⅱ的转化过程.图13 为进水及反应10, 24, 34, 58,72h 出水的全波长扫描结果.由图13 可见,主要含有4 个吸收峰,分别是250, 340, 406, 449nm.其中,250nm处的吸收峰归属于芳烃或多环芳烃的本征吸收, 350nm 处的吸收峰是芳烃或多环芳烃与一些生色基团相互作用的拓展吸收峰[45],406nm 是碱性橙Ⅱ的最大吸收峰[46],449nm 处的吸收峰归属于碱性橙Ⅱ的偶氮双键的生色基团及偶氮双键形成的大共轭体系产生的吸收[47].随着反应的进行,10h 时位于406nm 处的碱性橙Ⅱ吸收峰消失,位于449nm 附近的偶氮结构吸收峰高度上升.研究表明,当碱性橙Ⅱ溶于水中时,会与水分子发生相互作用使其质子化,吸收峰会从406nm 移到449nm[48].24h 时偶氮结构吸收峰高度显著下降,说明此时大量偶氮结构被断开,这与先前24h 脱色率达到73.57%相一致.24h时还出现了位于350nm 附近的降解中间产物的吸收峰,说明偶氮双键断开后生成了芳烃或多环芳烃,其环结构此时还没有被完全破坏,这与此时TOC 去除率仅为48.37%相符.34, 48h 出水中这几处的吸收峰高度逐渐下降,58, 72h 出水中4 个的吸收峰几乎全部消失,这意味着染料分子中偶氮键共轭体系以及芳香环结构均遭到破坏而发生分解.

图13 试验组水样的全波长扫描图Fig.13 Full-wavelength scan spectra of water samples
为了进一步明确碱性橙Ⅱ的降解中间产物,对试验组10, 24, 34, 72h 出水取样进行GC-MS 检测,各时段出水GC-MS 扫描图如图14 所示.由图14a可见,10h 出水中出现保留时间分别为 3.04/4.28min、6.91min 的3-氨基苯甲酸和[(E)-甲氧基苯基甲亚基]羟胺,也检测到保留时间为19.90min 的酯类物质,保留时间为15.58,16.79,17.94,19.04min 的直链烷烃.结合UV-Vis 扫描图谱可知,此时水中同时存在偶氮结构、苯环结构及降解中间产物,由此推测偶氮双键的裂解和中间降解产物的矿化是同步进行的.24h 出水中直连烷烃和酯类物质的丰度上升(图14b),这与24h 出水的TOC 浓度回升的情况相吻合.一方面推测是由于芳香胺类中间产物的进一步降解,生成更多分子量较小的脱色产物,这些脱色产物呈现更高的TOC[32].另一方面之前被AC 吸附的降解产物可能还未来得及被完全降解,又释放到水体中.34h 出水中保留时间为6.93min 的芳香胺类物质的相对丰度上升,直链烷烃和酯类物质的相对丰度下降(图14c).这与此时脱色率上升到94.71%,TOC 去除率仅达到54.30%相符.尽管72h 出水中仍有少量降解产物存在,各组分的相对丰度都已明显降低(图14d),与72h 时TOC 去除率为89.31%相符.

图14 试验组不同时间水样的GC-MS 扫描图Fig.14 GC-MS scanning spectra of water samples at different times in the experimental group
结合以上分析,得到藻菌球生物降解碱性橙Ⅱ的可能路径:首先在细菌和藻类作用下,偶氮双键裂解生成芳香胺类中间产物.由于藻类光合作用产氧,藻菌共生系统中同时存在厌氧-好氧的微环境,这些脱色产物得到进一步降解,芳香环结构遭到破坏,生成不稳定的直链烷烃,以及一些结构相对简单的酸类、酯类物质,进而逐渐矿化成CO2和H2O.
3 结论
3.1 从响应面分析结果可以得出,SA 浓度、AC 浓度和固定化生物量都对藻菌球的脱色效果具有显著影响.藻菌球的最佳制备条件为:SA浓度为2.58%,CaCl2浓度为2%,AC 浓度为0.838%,固定化生物量为1.139%,其中泥和藻的质量比为2:1,固定化时间为14h.
3.2 在进水染料浓度为50~250mg/L 时,进水pH 值在6~10.5 范围内,脱色率均可达到90%以上,TOC 的去除率在74%~90%之间.其中当进水染料浓度为100mg/L、pH=7.0±0.25,光照强度为(8000±500)lux时,脱色率和TOC 去除率达到最高,分别为98.07%、89.31%.经过5 次循环利用,藻菌球对碱性橙Ⅱ的脱色率和TOC 去除率仍能保持一个较高水平.
3.3 结合紫外-可见全波长扫描和GC-MS 扫描图谱分析推测,碱性橙Ⅱ首先在细菌和藻类作用下,偶氮双键裂解生成芳香胺类物质,然后在好氧环境下进一步分解生成烷烃、酸类、酯类等物质,最终完全矿化生成CO2和H2O.藻菌球不仅实现高效脱色,而且最终将碱性橙Ⅱ完全降解.
