乳酸钠共代谢对铜绿假单胞菌NY3 降解四溴双酚A 的促进机理
2024-03-08聂红云郭镝妮陈丽娇聂麦茜西安建筑科技大学环境与市政工程学院陕西西安70055膜分离重点研究室陕西西安70055陕西省环境监测中心站陕西西安70054
张 琪,聂红云,2*,郭镝妮,陈丽娇,聂麦茜,2,王 磊,2,王 蕾 (.西安建筑科技大学环境与市政工程学院,陕西 西安 70055;2.膜分离重点研究室,陕西 西安 70055;.陕西省环境监测中心站,陕西 西安 70054)
四溴双酚A(TBBPA)是使用最广泛的溴代阻燃剂,作为一类化学助剂广泛应用于电子产品、塑料制品以及家具中[1-2].由于TBBPA 的大量生产与使用,使其释放到环境中,污染了水、空气和土壤,严重威胁人类健康和生态安全[3].快速有效地去除环境中的TBBPA 成为研究热点.
生物法降解有机污染物简单、高效、无二次污染,因此,常用生物法降解 TBBPA[4].已报道的TBBPA 降解菌株中,仅有少数,如苍白杆菌[5]能以TBBPA 为唯一碳源对其进行降解,多数微生物降解TBBPA 时需要其他碳源作为共代谢碳源[6].作为共代谢碳源的物质包括葡萄糖、丙酮酸钠、乙酸钠、乳酸钠、柠檬酸钠、乙醇等电子供体[7],但仅葡萄糖作为共代谢碳源的促进机理研究较深入[5],其他共代谢碳源对TBBPA 降解的促进机理尚不明确.
基于此,本研究选择乳酸钠、乙酸钠、柠檬酸钠等小分子酸钠盐为共代谢碳源,以无共代谢碳源体系为对照,从代谢活性组分角度,研究了乳酸钠共代谢作用对NY3菌降解TBBPA 的促进作用及其机理,旨在为TBBPA 污染的微生物控制技术提供参考.
1 材料与方法
1.1 菌种来源
从陕西污染土壤中分离纯化的铜绿假单胞菌NY3(NCBI 登录号为GU377209)
1.2 试剂及培养基
牛肉膏培养基:根据参考文献[8]制备.组成为NaCl 5g/L、蛋白胨10g/L,牛肉膏3g/L,调pH 值至7.8,121℃灭菌30min,备用.
无机盐(MSM)培养基:根据参考文献[9]制备.组成为NH4NO31g,磷酸盐缓冲液25mL, MgSO4·7H2O(1mol/L)0.5mL,CaCl2·2H2O(1mol/L)0.1mL, 微量元素1mL,加纯水定容至1L,121℃灭菌30min,备用.
磷 酸 盐 缓 冲 液 :NaH2PO4·2H2O:42.9g;K2HPO4·3H2O:42.9g,蒸馏水定容至1L,用NaOH 颗粒调pH 值至8.0.
微量元素:根据参考文献[10]制备.主要组成有ZnSO4·7H2O 0.148g;MnSO4·H2O 0.258g; NiSO4·6H2O 0.022g;CoCl2·6H2O 0.024g;CuCl2·2H2O 0.013g;H3BO30.062g;Na2MoO4·2H2O 0.10g; FeSO4·7H2O 4.5g,加纯水定容至1L.
TBBPA 溶液的制备:称取0.8g 的TBBPA 于烧杯中,加纯水至80mL,用NaOH 溶液溶解至澄清,定容至100mL.
1.3 实验方法
1.3.1 NY3 菌种子液的制备 在无菌条件下,用接种环勾取平板上的NY3 菌单菌落于牛肉膏培养基中,置于31.5 ℃,(150±10) r/min 的恒温水浴摇床中震荡约16h,至其OD600nm约为(1.60±0.5),备用.
1.3.2 共代谢碳源对NY3 菌降解TBBPA 的影响按照1.2 的方法配制无机盐培养基,无菌环境下分别添加乳酸钠、乙酸钠、柠檬酸钠,使体系的浓度均为1g/L,再添加TBBPA 溶液使其浓度为50mg/L,接入20%的NY3 菌种子液组成降解体系(设置平行样),以不添加有机酸钠盐作为对照组,以不添加有机酸钠盐且以20%无菌水替代NY3 菌种子液的接种体系作为空白组.在31.5 ℃,150r/min 的恒温水浴摇床中进行摇瓶实验.降解120h 后,测定体系的剩余TBBPA 峰面积、OD600nm、pH 值等指标,并计算TBBPA 的降解率.
1.3.3 乳酸钠共代谢对NY3菌降解TBBPA 的活性物定域 无菌环境下配制NY3 菌接种量为20%,TBBPA 浓度为50mg/L,乳酸钠浓度为1g/L 的NY3菌生长体系,使其在31.5℃ ,150r/min 的恒温摇床中进行摇瓶实验,收集48h 后添加乳酸钠的NY3 菌降解体系.
静息细胞的制备:将培养好的NY3 菌降解体系在3750r/min、4℃条件下无菌离心10min,收集菌体,用无机盐洗涤3 次,获得NY3 菌静息细胞,并用等体积的无机盐重悬获得静息细胞菌悬液,备用.
无菌胞外液的制备:将培养好的NY3 菌降解体系无菌离心10min(10000r/min、4 ℃), 弃菌体细胞,收集上清液,并用0.22μm的水相滤膜过滤,得到NY3菌无菌胞外液.
静息细胞和无菌胞外液对TBBPA 的降解:分别取菌悬液和无菌胞外液各10mL,添加TBBPA 溶液使其浓度为50mg/L,于31.5 ℃,150r/min 的恒温水浴摇床中进行摇瓶实验,降解8h 后,测定体系的剩余TBBPA 峰面积,计算TBBPA 降解率.
蛋白酶K 对无菌胞外液降解TBBPA 的影响:在10mL 的含l g/L 乳酸钠的无菌胞外液中添加200U 的蛋白酶 K,与不加蛋白酶 K 做对比,于31.5℃,150r/min 的恒温水浴摇床中进行摇瓶实验,于8h 后测定体系的剩余TBBPA 峰面积,并计算TBBPA 降解率.
1.3.4 NY3 菌乳酸钠共代谢降解TBBPA 体系的ROS 检测 按照1.3.3 制备NY3 菌乳酸钠共代谢降解TBBPA 体系,并制备无菌胞外液,定期取样,测定胞外液中的过氧化氢、超氧负离子自由基和羟基自由基等ROS.
1.4 分析方法
1.4.1 NY3 菌生长量的测定 取待测样品5mL,用分光光度计在波长600nm 处测定吸光度.
1.4.2 pH 值的测定 取待测样品5mL,用PHS-3C型的pH 计测定.
1.4.3 TBBPA 浓度测定 样品前处理:取发酵好的待测样品,调pH 值至2 进行酸化,加入6mL 三氯甲烷进行萃取,重复萃取3 次,合并有机相,放置通风橱挥发干后,加入1mL 乙酸乙酯溶解,过0.22μm 有机滤膜,制成样品.
TBBPA 浓度采用气相色谱法测定,具体条件如下:用PE 680FID 检测器测定剩余TBBPA 的峰面积.色谱条件根据参考文献[11]设置:检测条件为进样口温度300 ℃,分流比20:1.检测器温度:300℃ ,氢气流量45mL/min,空气流量450mL/min.程序升温,初始105 ℃,保留2min,再以20℃/min 升温至160 ℃,保留4min,以20℃/min 升温至240 ℃,保留4min,最后以20℃/min 升温至280℃保留7min.进样量为1µL.TBBPA 降解率公的计算式如下:
式中:R为TBBPA 降解率,S0为空白组TBBPA 峰面积;St为实验组剩余TBBPA 峰面积.
1.4.4 胞外液中ROS 的检测 过氧化氢(H2O2):采用采用N,N-二乙基对苯二胺(DPD)/辣根过氧化物酶(POD)法测定:配制1g/L 的POD 溶液(超纯水溶解)、10g/L 的DPD 溶液(0.05mol/L 的H2SO4溶解)和0.5mol/L pH 值为6 的磷酸盐缓冲液(PBS).取2.7mL 的胞外提取液于5mL 的离心管中,向其中加入300µL 的PBS、25µL 的POD 溶液和25µL 的DPD溶液,用紫外-可见分光光度计于551nm 处测量其吸光度,体系以不加POD 为空白对照.在测定时需同步制作标准样品,根据所测吸光度值与H2O2标准曲线求相应H2O2浓度[12].
超氧负离子自由基(∙O2-):采用硝基四氮唑蓝(NBT)显色法测定:配制50µmol/L 的NBT 溶液,吸取2mL的胞外提取液于5mL离心管中,加入50µL NBT溶液,避光静置5min,测其在560nm 处的吸光度值[13].
羟基自由基(∙OH):采用硫代巴比妥酸(TBA)法测定:配制质量分数为1%的TBA 溶液(0.05mol/L 浓度的NaOH 溶解),取2mL 胞外提取液于5mL 离心管中,向其中加入170µL浓度为30mmol/L的2-脱氧-D-核糖,在35℃下反应15min.取1mL 混合液加入1mL 的TBA 溶液和1mL 乙酸,沸水浴20min,室温冷却后,测其在532nm 处的吸光度[12].
1.4.5 乳酸钠共代谢体系中NY3 菌胞外小分子物质的表征 收集NY3 菌在1g/L 乳酸钠生长体系中的细胞生长液,取4mL 过固相萃取柱,用甲醇(色谱级)洗脱,于通风橱挥干,用1mL 甲醇溶解,所得洗脱液用高效液相-离子阱-飞行时间质谱(LCMS-ITTOF)分析所含胞外小分子物质.参考文献[7]的检测方法稍作调整.色谱柱为C18柱(Shimpack XR-ODS,2.2µm intotal porous,2.0mm×250mm),进样量为10µL.流动相为1%乙酸(体积分数)的超纯水和色谱级甲醇,采用梯度洗脱的方式先将甲醇的体积分数30min 内从10%升到50%,在30min~40min 升到100%,在45~60min 降至10%,流速为0.2mL/min.
小分子物质的定性通过飞行时间质谱与已报道的相关小分子物质的质谱图对比确定.小分子物质的浓度以其对应色谱图中的峰面积表示,只作为相对定量分析的依据.
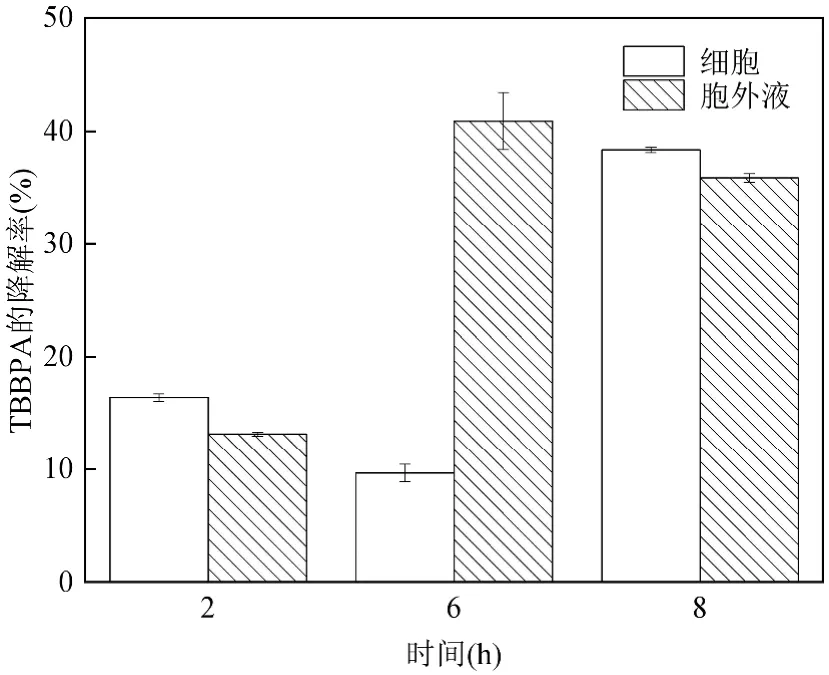
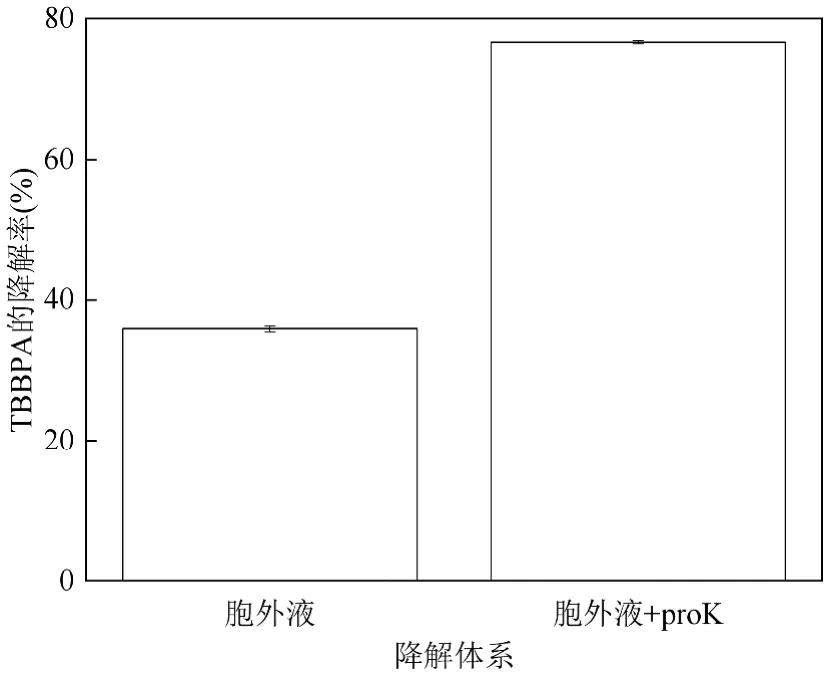
1.4.6 数据处理 ROS 的显著性分析:利用SPSS软件对ROS 待测样与对照组做独立样本T检验,分析两者的显著性,P<0.05 说明具有相关性.(用*表示相关性强弱,***:P<0.001;**:P<0.01;*:0.01 ROS 与NY3 菌胞外小分子的相关性分析:利用R 语言矩阵相关性分析程序对ROS 水平与NY3 菌胞外小分子色谱图对应的峰面积做相关性分析. 按照1.3.2 的实验方法,在NY3 菌降解TBBPA体系中分别外加乳酸钠、乙酸钠和柠檬酸钠为共代谢碳源,并以无共代谢碳源体系(不添加)为对照,测定不同时间体系的NY3 菌生物量、pH 值和TBBPA降解率,以及120h 降解体系上清液的外观(图1). 图1 小分子有机酸钠盐对TBBPA 降解体系中NY3 菌生长特性的影响Fig.1 Effect of small molecule organic acid sodium salt on the growth of Pseudomonas aeruginosa NY3 in the degradation system of TBBPA 由图1a 可知,与对照组相比,共代谢碳源加入后,NY3 菌的对数生长期延长,生物量增加.其中乳酸钠共代谢对NY3 菌生物量的促进作用最大,其次是乙酸钠,柠檬酸钠共代谢对NY3 菌生物量促进作用最弱.与之相对应的体系pH 值也与对照组存在明显不同(图1b).共代谢碳源存在时,体系pH 值随NY3菌生长时间的延长而升高,当NY3 菌处于对数生长期时,体系pH 值上升速度快,当NY3 菌处于生长平台期和死亡期时,体系pH 值上升缓慢或保持稳定.3种共代谢碳源中,乳酸钠共代谢使体系pH 值上升最少,柠檬酸钠使体系pH 值上升最多.对比图1a 和图1b 可知,共代谢碳源对NY3 菌生物量和体系pH 值的促进趋势相反,这可能是由于pH 值大于9.0 不利于NY3 菌生长.由图1c 可知,在4h 内不同条件体系降解率差别不明显,但降解48h 时乳酸钠和乙酸钠为共代谢碳源体系TBBPA 的降解率明显高于对照组.尤其是乳酸钠为共代谢的体系,其48h 的TBBPA降解率已显著高于对照组120h 的TBBPA 降解率.究其原因,这可能与乳酸钠和乙酸钠共代谢体系中长时间保持较高生物量有关,也可能与NY3 菌在不同共代谢体系的胞外分泌物有关.如图1d 所示,与对照组相比,乳酸钠和乙酸钠为共代谢体系的NY3 菌胞外液呈现墨绿色.根据Huang 等[6]的研究结果可知,胞外液中的墨绿色可能是NY3 菌分泌的绿脓菌素.降解后期,由于共代谢碳源不足,NY3 菌分泌的过量绿脓菌素产生自毒效应引起的生物量降低,这也解释了乳酸钠和乙酸钠共代谢体系的NY3 菌生物量在降解后期为何锐减.综上可知,当以乳酸钠为共代谢碳源时,TBBPA 降解体系中NY3 菌迅速生长,分泌大量绿脓菌素类胞外物质,使TBBPA 降解率显著高于无共代谢碳源体系.这与万博等报道的乳酸钠共代谢能促进NY3 菌对TBBPA 的脱溴效果一致[14]. 当以乳酸钠为共代谢碳源时, TBBPA 降解体系中NY3 菌生物量和胞外分泌物均不同于无共代谢碳源体系.为定位NY3 菌乳酸钠共代谢体系TBBPA降解的活性物,按照1.3.3 的实验方法,在无菌条件下分别获取静息细胞和其对应无菌胞外液,分别测定其对TBBPA 的降解率(图2). 图2 乳酸钠为共代谢碳源的无菌胞外液对TBBPA 降解率的影响Fig.2 Effect of sodium lactate as co-metabolic carbon source on the degradation rate of TBBPA by the cell-free extracellular fluid 由图2 可知,添加乳酸钠的细胞和胞外上清液均具有降解TBBPA 的能力,降解8h 后,无菌胞外液对TBBPA 的降解率为35.91%,静息细胞对TBBPA的降解率为38.38%,无菌胞外液与相应的NY3 菌静息细胞对TBBPA 的去除效率几乎相同.顾晨等[15]研究表明,对于GCW 菌株,参与TBBPA 降解的活性组分分布于胞内和胞外,而对于 GCY 菌株,参与TBBPA 降解的活性组分几乎全在胞外.说明NY3 菌降解TBBPA 的活性物分布与GCW 菌株相同.据前人研究可知[4],细菌降解TBBPA 的胞内活性组分主要与脱溴和矿化相关的基因及其表达有关,如cyp450,gstB,gstA,HADH,bioC,yrrM,Tam和Ubil等,而与菌细胞对TBBPA 降解率贡献几乎相同的胞外活性组分尚不明确,值得深入研究. 在细菌胞外液中,蛋白类物质与非蛋白的小分子分泌物共存.为进一步探索乳酸钠共代谢体系的NY3 菌无菌胞外液中降解TBBPA 的活性组分究竟是蛋白还是非蛋白的小分子分泌物,以NY3 菌无菌胞外液中加入过量蛋白酶K 为实验组,以未加蛋白酶K 的为对照组,分别测定其对TBBPA 的降解率.由图3 可知,降解8h 后,对照组中TBBPA 的降解率约为35%,实验组TBBPA 的降解率约为76%,比对照组提高了40%左右.该结果说明,乳酸钠共代谢的NY3 菌无菌胞外液中,蛋白类物质在TBBPA 的降解过程中起负面作用,TBBPA 降解的活性组分应为非蛋白的小分子分泌物.根据Huang 等[6]的研究结果可知,这可能与铜绿假单胞菌分泌的吩嗪类物质在有氧条件下形成活性氧有关,因为这类活性氧能够降解TBBPA. 图3 胞外蛋白对无菌胞外液对TBBPA 降解的影响Fig.3 Effect of extracellular proteins on the degradation of TBBPA by the cell-free extracellular fluid 研究表明,绿脓菌素类物质形成的活性氧包括超氧负离子自由基、羟基自由基和过氧化氢等[16].为验证NY3 菌乳酸钠共代谢体系胞外液中活性氧种类与水平,以无共代谢碳源为对照组,以乳酸钠共代谢体系为实验组,分别测定其TBBPA 降解过程中胞外液中的超氧负离子自由基、羟基自由基和过氧化氢. 由图4 可知,在NY3 菌降解TBBPA 的乳酸钠共代谢体系,超氧负离子自由基、羟基自由基和过氧化氢的水平随降解时间延长而增加.其中,体系中超氧负离子自由基和过氧化氢的水平在降解8h 后显著高于对照组,羟基自由基水平在降解24h 后显著高于对照组.这可能是因为绿脓菌素与胞外物质反应初步生成的活性氧主要是超氧负离子自由基和过氧化氢,羟基自由基是由生成的过氧化氢和胞外液中金属离子反应生成的[17]. 图4 乳酸钠共代谢对NY3 菌降解TBBPA 体系ROS 的影响Fig.4 Effect of sodium lactate as co-metabolic carbon source on the ROS level in the the degradation system of TBBPA by Pseudomonas aeruginosa NY3 按1.4.5 的实验方法以固相萃取技术提取NY3菌乳酸钠共代谢体系胞外液的小分子分泌物,然后通过LCMS-IT-TOF 对其进行定性分析.由表1 可知,NY3 菌乳酸钠共代谢体系的胞外液含4 类小分子分泌物,分别为喹诺酮类、吩嗪类、螯铁蛋白和鼠李糖脂类.依据MS 和MS/MS 质谱特征,以及前人研究结果推测喹诺酮类和吩嗪类的结构[18],发现NY3 菌乳酸钠共代谢体系包含5 种喹诺酮类物质,分子量分别为242, 274, 260, 286, 396;2 种吩嗪类物质,分别是绿脓菌素和吩嗪-1-羧酸.根据MS 和聂麦茜等[19]的研究结果,发现NY3菌乳酸钠共代谢体系分泌6种单鼠李糖脂和2种双鼠李糖脂.此外,NY3菌乳酸钠共代谢体系的胞外分泌物还包括一种螯铁蛋白. 表1 胞外液中的小分子分泌物Table 1 Samll molecular secretions in the extracellular fluid 将2.5 部分的LCMS-IT-TOF 色谱峰根据鉴定结果分为喹诺酮类、吩嗪类、螯铁蛋白和鼠李糖脂类,分别加和同一类物质的峰面积,对其进行相对定量.随降解时间的变化,NY3 菌乳酸钠共代谢体系胞外小分子分泌物的水平如图5a 所示.利用C 语言软件,分析2.4 部分不同活性氧水平与胞外小分子分泌物的相关性. 图5 胞外小分子分泌物与胞外液中 ROS 水平的关系Fig.5 Relationship of small molecular secretions and level of ROS in the extracellular fluid 由图5a 可知,吩嗪、螯铁蛋白和喹诺酮的变化趋势为逐渐增多,鼠李糖脂的浓度先升高后降低.四种胞外小分子分泌物与活性氧均呈正相关.其中,吩嗪类的浓度与超氧负离子自由基、羟基自由基和过氧化氢水平相关性均接近于1;喹诺酮类物质和超氧负离子自由基的相关性较高,接近于1,与羟基自由基和过氧化氢的相关性略低,在0.8 左右;螯铁蛋白和羟基自由基的相关性较高,约在0.4 左右,与超氧负离子自由基和过氧化氢的相关性较弱,约在0.2 左右;鼠李糖脂仅与过氧化氢有很弱的相关性,与超氧负离子自由基和羟基自由基的相关性几乎为0.以上结果说明,胞外小分子分泌物对活性氧的贡献次序为吩嗪类>喹诺酮类>螯铁蛋白>鼠李糖脂类.聂红云[20]等研究发现,绿脓菌素与胞外的NADH 反应生成超氧负离子自由基和过氧化氢,若体系中存在螯铁蛋白,则进一步反应生成羟基自由基.这与本研究分析的相关性一致. 3.1 乳酸钠共代谢可明显提高铜绿假单胞菌NY3以TBBPA 为碳源的细胞增殖量和降解率.当乳酸钠浓度为1g/L时,铜绿假单胞菌NY3 在48h 对TBBPA的降解率可达到74%. 3.2 乳酸钠共代谢时,铜绿假单胞菌NY3 的无菌胞外液具有与其细胞相当的TBBPA 降解能力,其胞外液的降解能力主要与非蛋白的小分子分泌物相关. 3.3 当乳酸钠共代谢时,铜绿假单胞菌NY3 的无菌胞外液中过氧化氢、超氧负离子自由基和羟基自由基浓度显著高于无乳酸钠存在体系.喹诺酮、吩嗪类、螯铁蛋白和鼠李糖脂的分泌量均与ROS 水平呈正相关,其中吩嗪类浓度与胞外ROS 水平相关性最高,鼠李糖脂浓度与ROS 水平的相关性最弱.2 结果与讨论
2.1 乳酸钠共代谢对NY3 菌降解TBBPA 的促进作用

2.2 乳酸钠共代谢对NY3 菌降解TBBPA 的活性物定域
2.3 乳酸钠共代谢对NY3 菌胞外液降解TBBPA的活性组分
2.4 乳酸钠共代谢对NY3 菌胞外ROS 的影响

2.5 NY3 菌乳酸钠共代谢体系的胞外分泌物

2.6 NY3 菌乳酸钠共代谢体系胞外小分子分泌物与ROS 的相关性分析

3 结论
