Anammox 生物膜富集培养过程中硝化菌的增殖特性
2024-03-08于莉芳彭党聪西安建筑科技大学环境与市政工程学院陕西西安70055西安建筑科技大学西北水资源与环境生态教育部重点实验室陕西西安70055西安建筑科技大学陕西省环境工程重点实验室陕西西安70055
李 韧 ,于莉芳 ,刘 甜 ,刘 然 ,余 涛 ,彭党聪 (.西安建筑科技大学环境与市政工程学院,陕西 西安 70055;2.西安建筑科技大学,西北水资源与环境生态教育部重点实验室,陕西 西安 70055;3.西安建筑科技大学,陕西省环境工程重点实验室,陕西 西安 70055)
短程硝化-厌氧氨氧化(PN/Anammox)工艺具有O2需求量低、不需要外源有机电子供体等优点,在污水处理厂TN 总量控制和节能降耗方面具有巨大应用前景.然而,PN/Anammox 工艺实现稳定生物脱氮的关键问题之一在于亚硝酸盐氧化菌(NOB)的抑制.NOB 会与厌氧氨氧化菌(AnAOB)共同竞争氨氧化菌(AOB)产生的NO2--N,从而减缓AnAOB 的生长速率和代谢活性,影响PN/Anammox 工艺的处理效率和稳定性.
现有研究表明,采用Anammox 生物膜可以有效提高Anammox 生物持留率[1],但在Anammox 生物膜的培养过程中,开放式污水处理厂中O2不可避免地会以多种方式进入缺氧池,如:初沉池溢流堰处的渠道混合充氧;回流污泥进入缺氧池的跌水充氧[2];缺氧池的机械搅拌充氧[3];含有高浓度溶解氧(DO)的好氧池硝化液内回流进入缺氧池充氧等[2].为避免缺氧过程中的DO 对反硝化和Anammox 过程的抑制,进入缺氧池的DO 会被其中的兼性厌氧反硝化细菌和好氧硝化细菌消耗,进而引起NOB 增殖[4].现有研究大多集中于对Anammox 生物膜的启动特性的调查[5],但对Anammox 生物膜培养过程中硝化细菌的增殖情况关注较少.
为此,本文采用上流式厌氧固定床生物膜(UAFB)反应器,通过梯度增加表面氨氮负荷率(SALR)培养Anammox 生物膜,考察了反应器长期运行期间的脱氮性能及硝化菌活性变化,通过氮平衡计算分析UAFB 反应器中的氮转化途径,并通过荧光原位杂交(FISH)和Illumina MiSeq 测序进一步验证硝化细菌的共存和相对丰度变化特征,探讨了Anammox 培养过程中NOB 增殖的潜在影 响.
1 材料与方法
1.1 试验装置及运行
UAFB 反应器如图1 所示,考虑到已有研究证明缺氧池中的污泥及填料有利于AnAOB 接种[1,6],为了快速富集Anammox 生物膜,接种所用的K3 填料(AnoxkaldnesTM,瑞典)取自西安市某污水处理厂的缺氧池,比表面积为500m2/m3.反应器有效容积为5.0L,其中填料区容积为3.5L,填充率为70%.利用恒温水浴设备将反应器内温度维持在(33±2)℃,pH 控制在7.5~8.2.

图1 UAFB 反应器示意Fig.1 Schematic diagram of UAFB reactor
进水采用人工配制,使用NH4Cl 和NaNO2配制AnAOB 富集所需的NH4+-N 和NO2--N,具体进水氮浓度见表 1.其余成分包括:KHCO30.5g/L,MgSO4·7H2O 0.14g/L,CaCl2·2H2O 0.14g/L,KH2PO40.03g/L 以及1mL/L 微量元素1 和2.其中微量元素浓缩液根据文献[7]配制.UAFB 反应器以序批模式运行,根据不同培养阶段SALR 的变化,运行过程共分为5 个阶段,具体运行周期及水力停留时间(HRT)见表1,每个周期中进水5min,出水5min,闲置5min,其余时间反应器通过外循环泵使内部水流充分混合,换水比为50%.为了模拟污水处理厂中露天培养状态,反应器的液面可以自由复氧,运行周期结束时出水DO 浓度低于0.2mg/L.
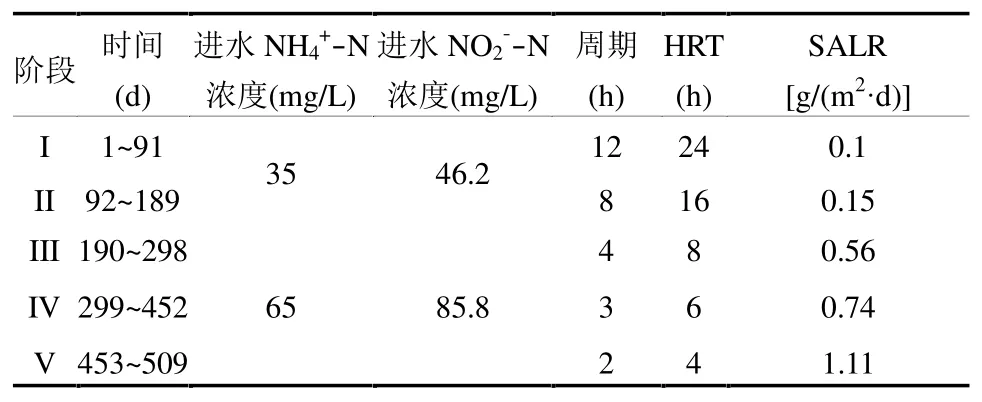
表1 UAFB 反应器运行条件Table 1 Operational conditions of the UAFB reactor
1.2 分析项目及测定方法
本试验中NH4+-N、NO2--N 和NO3--N 等常规水质指标根据标准方法[8]进行测定; DO 和pH 值分别采用Seven2Go S9 型溶氧仪(Mettler Toledo,瑞士)及雷磁PHS-3C pH 计进行测定.Anammox 最大活性(rAMX,以NH4+-N 的减少量计)和硝化活性均采用直接取样法进行异位测定,以氮素浓度变化来确定Anammox 活性,具体方法参照文献[9],测定温度为33 ℃.
硝化活性具体方法如下:从反应器中取出适量填料后,用去离子水(预热至30℃)清洗3 次并放置于600mL 广口瓶中,分别加入NH4Cl 和NaNO2使初始NH4+-N 和 NO2--N 浓度为 40mg/L,通过添加NaHCO3控制pH 值在7.0~8.0 之间,在30℃恒温水浴中充分曝气并定时取样,分析NH4+-N 和NO2--N浓度降低速率以确定最大硝化活性.
收集接种填料及UAFB 反应器中第200d 和第492d 的生物膜样品进行荧光原位杂交(FISH),然后采用冷冻切片机(Leica CM1950,德国)进行切片,切片厚度为20µm.详细的预处理及杂交步骤见先前研究[10],所用的FISH 探针见表2[11].杂交后风干载玻片,包埋于Vectashield 中.采用共聚焦激光显微镜(TCSSP8X,德国)记录荧光信号,每次分析10 张图片.

表2 荧光原位杂交过程使用的探针序列[11]Table 2 List of probes used in this study
1.3 氮平衡分析计算公式
考虑到进水中没有COD,因此氮平衡分析过程中假定不存在反硝化过程,而Anammox、氨氧化以及亚硝酸氧化过程可以根据式(1)~式(3)描述[12].
根据上述反应式(1)~式(3),通过式(4)~式(6)分别计算R1、R2和R3.
式中:R1是AnAOB 氧化的NH4+-N 浓度,mg/L;R2是AOB 氧化的NH4+-N 浓度,mg/L;R3是NOB 氧化的NO2--N 浓度,mg/L.
1.4 高通量测序
分别收集2g(湿重)的接种填料以及UAFB 反应器中第137、357 及492d 的生物膜样品进行DNA的提取.使用引物 515F(5’-GTGCCAGCMGCCGCGGTAA-3’)/806R(5’-GGACTACHVGGGTWT CTAAT-3’)扩增细菌16S rRNA 基因的V4 区域.纯化的扩增子在Illumina MiSeq PE300 平台(美国)上进行测序.样品提取DNA 检测后构建文库并上机测序进行质控分析(北京奥维森有限公司).
2 结果与讨论
2.1 反应器性能
UAFB 反应器在5 个不同SALRs[0.10、0.15、0.56、0.74 和1.11g/(m2·d)]下共运行了509d,各个阶段的脱氮性能如图2 所示.

图2 UAFB 反应器不同阶段的氮浓度及Anammox 活性历时变化Fig.2 Profiles of nitrogen concentration and Anammox activities under different stages in the UAFB reactor
2.1.1 脱氮性能及厌氧氨氧化活性变化 考虑到较高的基质浓度对AnAOB 的活性有明显抑制作用[13],且较短的HRT 不利于启动期的Anammox 持留,因此在培养初期的阶段I(第1~91d)中,系统以较低的SALR 运行[0.1g/(m2·d)].
在阶段I 中,前16d 系统出水水质波动较大(图2a),TN 去除率仅有(37.61±18.84)%,同时出水NO3--N 浓度仅为(6.76±3.63)mg/L,这可能是由于培养初期系统出现了反硝化现象.有研究表明,微生物在缺乏底物的新环境下趋向于发生细胞裂解,释放出有机物和氨氮,从而形成有利于反硝化的底物环境[14],系统第1d 出水NH4+-N 浓度(34.51mg/L)甚至高于进水浓度也证实了这一点.随着培养的进行,出水NH4+-N 和NO2--N 浓度逐渐下降并趋于稳定,第29d 后二者均低于5mg/L 且去除率分别达到96.53%和98.88%,TN去除率逐渐增加至76.22%,这表明系统出现了Anammox 现象.到了第30~59d,系统运行逐渐稳定,出水基本不含 NH4+-N 和NO2--N,系统NO3--N 浓度为(20.68±3.26)mg/L,同时,rAMX从接种填料的0.11g/(m2·d)逐渐增加至第48d 的0.15 g/(m2·d).而第60~91d,系统NO3--N 浓度逐渐升高至(28.45±5.34)mg/L,系统TN 去除率也从(77.60±4.76)%相应降低至(62.84±9.67)%,这表明随着培养的进行系统中NOB 逐渐开始增殖.阶段 II 通过缩短 HRT 的方式使 SALR 升高至0.15g/(m2·d),从第92~189d,系统始终运行稳定,基质被完全消耗的同时系统出水NO3--N 浓度保持在(25.53±3.67)mg/L.此时,rAMX快速从第101d 的0.16g/(m2·d)增加至第185d 的0.38g/(m2·d),增加了138.11%.
考虑到长期处于饥饿状态会导致AnAOB 活性的损失[15],从阶段III 开始增加进水NH4+-N 浓度和NO2--N 浓度分别至 65mg/L 和 85.8mg/L,在第190~298d 内,由于基质浓度的增加,出水NO3--N 浓度相对于阶段II略有上升且始终保持稳定[(32.80±2.24)mg/L].阶段IV 进一步缩短HRT 至6h,相对于阶段III,出水NO3--N 浓度在初期(第299~395d)略微降低并维持在(26.43±3.30)mg/L,这可能是由于AnAOB 的大量增殖,导致AnAOB 在和NOB 竞争NO2--N 的过程中占据绝对优势,rAMX也相应地从第304d 的0.87g/(m2·d)大幅增加至第371d 的1.70g/(m2·d);而到了阶段 IV 末期(第 396~452d),出水NO3--N 小幅增加至(28.66±1.15)mg/L,这是由于rAMX已达到此负荷下的最大生物活性且不再继续增加,甚至由于典型周期内的AnAOB 长期处于内源呼吸期,rAMX逐渐降低至 1.64g/(m2·d),此时竞争NO2--N 的NOB 得以增殖并使出水NO3--N 浓度小幅上升.
阶段V 进一步通过缩短HRT 使SALR 维持在1.11g/(m2·d),阶段初期(第454~482d)系统NH4+-N 和NO2--N 浓度均小于0.5mg/L,TN 去除率维持在(79.47±1.86)%,而第483d 后,系统逐渐恶化,出水NH4+-N 浓度升高至(3.06±1.76)mg/L,TN 去除率也跌至第509d 的73.87%.同时,系统的rAMX从第468d的2.2g/(m2·d)降低至第492d 的2.1g/(m2·d).此时,系统内生物膜厚度明显增加,部分填料甚至出现堵塞现象,严重影响传质能力,因此导致出水水质逐渐恶 化.
2.1.2 硝化菌活性变化 为了直观地证实硝化菌的存在及活性变化情况,对不同SALR 阶段稳定期下的Anammox 生物膜最大硝化活性进行了异位批次实验.如图3 所示,相比于接种填料的生物膜硝化活性,第137d 的AUR 和NUR 有显著的增加,说明缺氧池中填料上的硝化细菌丰度有限.随着Anammox生物膜的培养,AUR 和NUR 逐渐升高并趋于稳定,第357d(阶段IV)和第492d(阶段V)的AUR 分别为(0.73±0.01)和(0.76±0.02)g/(m2·d),略高于第137d(阶段II)的(0.62±0.01)g/(m2·d);第357d 和第492d 的NUR 分别为(2.41±0.19)和(2.36±0.31)g/(m2·d),略大于第 137d 的(2.15±0.18)g/(m2·d).因此可知,在AnAOB 富集过程中,虽然SALR 在持续增加,且Anammox 活性始终呈上升趋势(图2b),但受限制于系统中较低的DO 浓度,AUR 和NUR 不会一直增加,而是逐渐趋于稳定,这一现象与 PN/Anammox-IFAS(活性污泥-生物膜复合系统)的硝化菌生物量浓度模拟结果相似[16].
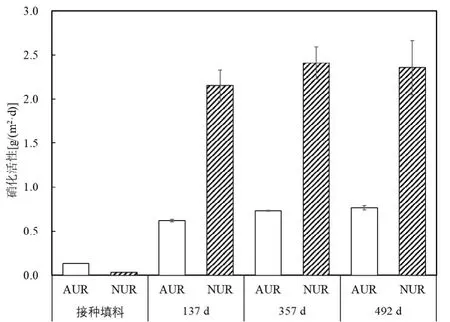
图3 不同阶段下的最大硝化活性变化趋势Fig.3 Batch tests of ex-situ nitrifying activity of AOB and NOB
2.2 化学计量数之比及氮平衡分析
通常认为ΔNO2-/ΔNH4+和ΔNO3-/ΔNH4+的化学计量比是Anammox 反应的关键指标[17](图4a).在启动阶段(I 期),由于异养菌在第1d 发生细胞裂解,出水NH4+-N 浓度甚至高于进水NH4+-N 浓度,导致系统的ΔNO2-/ΔNH4+和ΔNO3-/ΔNH4+的比值均为负值.第2~7d 时,由于系统中出现反硝化现象,因而导致二者比值(5.58±2.58 和2.07±0.61)均高于理论值(1.32 和0.26)[12].随着培养初期反硝化过程结束以及 Anammox 现象的出现,系统 ΔNO2-/ΔNH4+比值从第11d的0.88 逐渐上升到理论值1.32,并保持稳定直至试验结束.而第 17~24d,系统ΔNO3-/ΔNH4+比值(0.27±0.07)也接近理论值0.26,这表明此阶段系统中主要进行的是Anammox 过程,而随后该比值逐渐升高,这可能与系统中NOB 的增殖有关.而系统中用于NOB 增殖的DO 可能来自于UAFB 反应器液面的自然复氧和进水的携带[18],虽然系统出水DO 浓度始终维持在0.14mg/L 以下,但在进水完成后的前5~20min,系统内DO 范围为(0.4~2.41)mg/L,这导致了少量硝化细菌得以在缺氧环境下增殖.Persson 等[19]在探究低温下移动床生物膜反应器(MBBR)-PN/Anammox 系统的脱氮性能时发现,尽管生物膜上仅存有较小丰度的NOB,但仍会引起ΔNO3-/ΔNH4+比值高于理论值近11%,且当温度低至10℃时这一现象更加明显.在负荷强化阶段(阶段II~V),系统平均ΔNO2-/ΔNH4+比值为 1.34±0.11,接近于理论值 1.32,但ΔNO3-/ΔNH4+(0.49±0.17)则明显高于理论比值0.26,这一现象在阶段I 末期和阶段II 中尤其突出.由图4a 可知,第78~189d内的平均ΔNO3-/ΔNH4+比值高达0.76±0.11,而阶段III~V 的比值则相对较低(0.42±0.10).虽然 NOB 的亚硝氮半饱和常数通常为AnAOB 的100 倍左右[20],理论上NOB 更适合在高基质浓度下生长,但本研究中,周期结束时的出水DO 浓度均低于0.2mg/L,不利于NOB 发挥最大活性,由此导致系统氮负荷较高时NOB 在与AnAOB 竞争NO2--N 时处于劣势地位.

图4 不同阶段化学计量数之比和氮平衡分析Fig.4 Stoichiometric ratios and mass balance analysis in UAFB reactor
为进一步了解UAFB反应器中的氮素转化途径,对整个运行期间的3 个生化反应过程进行了氮质量平衡分析(图4b).由于阶段I 初期系统内存在细胞裂解导致的有机物和氨氮释放以及反硝化现象,因此第0~15d 内的R2和R3存在负值,此阶段并不适用于假定没有反硝化参与的氮平衡分析.如图4b 所示,由于阶段 III 进水基质浓度的增加,AnAOB 氧化NH4+-N 的浓度(R1)从(24.95±2.26)mg/L(阶段II)增加到(55.44±4.00)mg/L(阶段III~V);而第78~189d 内(阶段I 末期至阶段II)NOB 氧化NO2--N 的浓度[R3,(23.09±4.77)mg/L] 明显大于阶段 III~V 的(16.13±3.5)mg/L,且始终大于AOB 氧化NH4+-N 的浓度[R2,(7.08±3.72)mg/L],这与阶段III~V 更低的ΔNO3-/ΔNH4+比值结果相一致.由此说明,UAFB 反应器中的NOB 可能比AOB 具有更高的群落丰度或微生物活性,同时,高负荷下Anammox 生物膜的培养过程更加不利于NOB 竞争NO2--N.
2.3 微生物多样性
2.3.1 荧光原位杂交(FISH) 为了定性检测生物膜中硝化菌和AnAOB 的增殖和分布状况,分别对接种填料、第200d 和第498d 富集后的厌氧氨氧化生物膜进行FISH 分析.由图5 可知,取自西安市某污水处理厂缺氧池中的接种填料存在一定丰度的AnAOB,而随着培养进行AnAOB 丰度明显增加.值得注意的是,与探针Nso1225 杂交的AOB 属在生物膜中始终未检测到杂交信号,且NOBmix在接种填料和培养200d 后的生物膜中也未被检出.图5d 显示了生物膜在培养498d 后的硝化种群(AOB+NOB)和AnAOB 的原位空间构成,不难发现,与探针Amx820杂交的AnAOB 在生物膜中具有绝对优势,而NOB主要在生物膜外部被检出,Kindaichi 等[18]也得出了相似的结果.这些结果证实了AnAOB 在UAFB 反应器中可以成功富集,且NOB的确存在,这与阶段V高于理论值的ΔNO3-/ΔNH4+比值结果相一致(图4a).

图5 Anammox 生物膜的荧光原位杂交(FISH)图片Fig.5 FISH images showing the in-situ spatial organization of AnAOB and nitrifying bacteria in Anammox biofilm
2.3.2 高通量测序 由图 6 可知,随着培养进行,AnAOB 富集成功,CandidatusBrocadia丰度明显从接种填料的0.88%逐渐增加至阶段II 的26.22%、阶段IV 的30.14%和阶段V 的33.38%.值得注意的是,接种填料中还检出了另一种 AnAOB——CandidatusJettenia,其培养后的相对丰度为3.02%.上述两种 AnAOB 的成功富集(35.06%)是导致UAFB 系统实现Anammox 脱氮效率提升的关键(图2a)[21].

图6 接种填料及第137、357 和492d 生物膜属水平群落结构组成Fig.6 Microbial classification of bacterial 16S rRNA gene reads at genus level on day 0, day 137, day 357, and day 492
另外,在接种填料上共检测到2 个属的AOB(即Nitrosomonas和Nitrosospira)和 2 个属的 NOB(Nitrospira和Nitrolancea),但相对丰度均小于0.04%.对于AOB,Nitrosospira的丰度从0.017%下降到0.001%,而Nitrosomonas的相对丰度从0.005%逐渐上升到阶段 V 的 0.78%.而培养至阶段 V 的Nitrolancea已无法被检出,但Nitrospira始终是UAFB 反应器中主要的NOB 菌属,其相对丰度从接种填料的0.01%增至阶段V 的2.32%.有研究同样发现,在NH4+-N 受限的培养系统内,Anammox 颗粒污泥中Nitrospira富集后的丰度约为2.1%,且Illumina MiSeq 测序结果同样未检出AOB[22].对于AOB 来说,Nitrosomonas是典型的r-策略菌,有着相对较高的基质半饱和常数以及较弱的基质亲和力,同时其拥有较高的氧亲和力,导致其相较于Nitrosospira更适宜在高基质浓度和低DO 浓度下生存,但由于UAFB 反应器实际运行周期内的基质浓度较低且缺氧条件下DO 浓度有限,因此Nitrosomonas更容易成为系统优势AOB;而Nitrospira作为一种常见的K-策略菌,有着较强的基质亲和力和较低的基质半饱和常数,同时有着较强的DO 亲和力[10,23],因此对低NO2-浓度和DO 都有着较强的适应性的Nitrospira在 Anammox 生物膜培养条件下相较于Nitrosomonas得以迅速增殖.
综上所述,由于进水中存在少量DO 且培养过程UAFB 反应器顶部液面可以自由复氧,即使反应器出水DO 浓度始终低于0.2mg/L,但硝化菌不可避免地会在Anammox 生物膜培养过程中出现部分增殖现象,且NOB 的增殖程度明显大于AOB.
2.4 Anammox 生物膜中硝化菌增殖的影响
事实上,AOB、NOB 以及反硝化菌可以与AnAOB 在生物膜中共存,生物膜中的硝化细菌可以消耗系统中微量的DO,异养菌可以利用AnAOB 的有机副产物,从而减轻DO 对AnAOB 的抑制以及有机废弃物在生物膜中的积累[18,24].然而,PN/Anammox 工艺实现稳定生物脱氮的关键在于NOB的稳定抑制.NOB 的存在一方面会与AnAOB 共同竞争AOB 产生的NO2--N,从而减缓AnAOB 的生长和代谢速率,影响Anammox 生物膜的脱氮效率[25];另一方面,长期低DO 条件下运行的短程硝化系统中,NOB 对低DO 的适应性和竞争力会逐渐强于AOB,从而导致NO2-无法正常积累,最终使长期稳定运行的PN/Anammox 系统出现不稳定性[20,26].
本文中Anammox生物膜培养后的AOB总丰度由0.02%增加至0.78%,NOB 总丰度由0.03%明显升至2.32%.值得一提的是,目前尚无研究表明系统AOB/NOB 的相对丰度比例达到多少时会导致短程硝化失败,然而,在通过游离亚硝酸(FNA)抑制实现短程硝化的研究中,无论是含有相对丰度为0.87%的AOB-Nitrosomonas和2.53%的NOB-Nitrospira的接种污泥,还是经FNA 处理后并长期运行至短程硝化崩溃的活性污泥(Nitrosomonas:2.53% 和Nitrotoga: 4.62%),两种不同相对丰度组合下的活性污泥均无明显NO2-积累,甚至进水NH4+-N 会被完全转化为NO3--N[27];同样,在PN/Anammox 系统中即使AUR>NUR,AUR/NUR=1.61 时,短程硝化过程最终也会失败[28].根据上述研究中的AOB/NOB 丰度比值以及AUR/NUR 活性比例,本研究中NOB 的优势增殖会对耦合系统的NO2--N 积累带来负面效果,高于理论值的出水NO3--N 浓度以及TN 去除率的明显下降也印证了这一点(图2).
另外,有研究还发现污水处理厂进水中携带的NOB 会不断地为主流处理系统接种NOB 群落,从而破坏NOB 的抑制并导致短程硝化失败[10,29];通过低DO(0.17mg/L)和高Anammox活性维持的NOB抑制在系统DO 升高后(1.4~1.6mg/L),Anammox 生物膜上的NOB 丰度会大幅上升(1.3%~2.1%),甚至超过了活性污泥相(0.05%~0.17%),相应的出水NO3--N浓度也持续增加[16].考虑到在生物膜上固着生长的NOB 无法通过调节污泥龄(SRT)的方式被淘汰出系统,因此在耦合运行过程中如何防止接种Anammox生物膜中携带过多的NOB 以及后续抑制IFAS-PN/Anammox 系统中Anammox 生物膜上的NOB 增殖变得尤为重要.
3 结论
3.1 通过逐步提升氮负荷可以快速实现AnAOB 的高效富集和Anammox 生物膜的培养,其中包括33.38%的Ca.Brocadia和3.02%的Ca.Jettenia.
3.2 高基质浓度下培养的Anammox 生物膜中的ΔNO3-/ΔNH4+比值较低,NOB 利用的NO2--N 更少,因此更有利于Anammox 生物膜的培养和AnAOB与NOB 竞争NO2--N.
3.3 Anammox生物膜培养过程中硝化菌的增殖是不可避免的,但受限制于较低的DO 浓度,随着培养进行,NOB 丰度虽然会逐渐增加,但Anammox 生物膜上的AUR 和NUR 最终会趋于稳定.
3.4 由于 NOB 对低 DO 具有较强的适应性,Anammox 生物膜中的优势AOB 为Nitrosomonas且丰度仅有0.78%,而NOB-Nitrospira(2.32%)则出现了明显的增殖,这对基于短程硝化的PN/Anammox工艺的启动和长期运行具有重要影响.
