钛表面PAMAM-PQQ功能层构建及对心内壁细胞生物学行为的影响
2024-03-08王义隆黄金全袁娅婷宋思齐陈俊英
王义隆,黄金全,袁娅婷,宋思齐,陈俊英
(西南交通大学 材料先进技术教育部重点实验室,成都 610031)
目前,心血管疾病仍是国内死亡的主要原因[1]。植/介入治疗是目前心血管疾病重要治疗手段,因此,植/介入器械在临床已经广泛使用。常见的植入器械包括药物洗脱支架、心脏瓣膜和心脏起搏器等。植入器械(如心脏起搏器)植入时,材料表面与周围内皮细胞(Endothelial cells,EC)、心肌细胞(Myocardial cells,MC)及血液相接触。材料的植入还会对植入部位造成损伤从而引起炎症[2-3],产生氧化应激,进一步损伤内皮细胞和心肌细胞的功能。因此,植入材料对内皮细胞和心肌细胞的保护作用及良好的血液相容性[4]尤为重要。通过对材料表面进行改性,能有效改善植入材料的生物相容性。
目前,研究者通过表面接枝等技术对金属材料表面进行功能化修饰,例如接枝多肽、肝素等生物功能分子来提高植入器械表面内皮化、抗凝血能力[5-7]。其中,聚酰胺胺树状大分子(Polyamido amine,PAMAM)是一种内部具有空腔结构、表面分布大量可修饰官能团的纳米材料,在药物传递[8]和材料表面改性[9]中具有很好的应用价值。Li等[10]研究显示,材料表面固定PAMAM能维持内皮细胞的生长及能降低血小板的黏附与激活。吡咯喹啉醌(Pyrroloquinoline quinone,PQQ)是一种水溶性醌类化合物,是继烟酰胺和黄酮核苷酸后发现的第三种辅酶[11]。PQQ具有抗炎、抗氧化、保护神经及保护心脏的能力[12-17]。已有研究者探究了PQQ对心肌肥大[15]、心肌纤维化[16]、心力衰竭[17]等的作用,但都是基于喂养[18-21]和注射[22-24]的方式,而未有心血管植入器械材料表面功能化修饰的相关研究。因此,本文将PAMAM固定于钛表面后,利用其氨基基团,采用1-乙基-(3-二甲基氨基丙基)碳酰二亚胺/N-羟基丁二酰亚胺(EDC/NHS)体系,将功能分子PQQ引入到材料表面,构建PAMAM-PQQ功能层,并探究不同浓度PQQ材料表面的血液相容性和细胞相容性及抗氧化损伤能力。
1 实验材料及方法
1.1 原材料
钛(Ti),宝鸡有色金属股份有限公司;树状大分子聚酰胺胺(PAMAM,第三代),晨源分子新材料有限公司;吡咯喹啉醌(PQQ),上海阿拉丁生化科技有限公司;1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(1-ethyl-(3-dimethylaminopropyl)carbamide diimide,EDC)、N-羟基丁二酰亚胺(Nhydroxysuccinimide,NHS)、超纯水、无水乙醇、酸性橙、氢氧化钠、活性氧荧光探针(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA),Sigma-Aldrich;乳酸脱氢酶(Lactate dehydrogenase,LDH)试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒,上海碧云天生物技术有限公司;丙二醛(Malonaldehyde,MDA)试剂盒,北京索莱宝科技有限公司。
1.2 PAMAM-PQQ功能层构建
图1为样品表面功能层构建示意图,具体工艺及其参数如下。
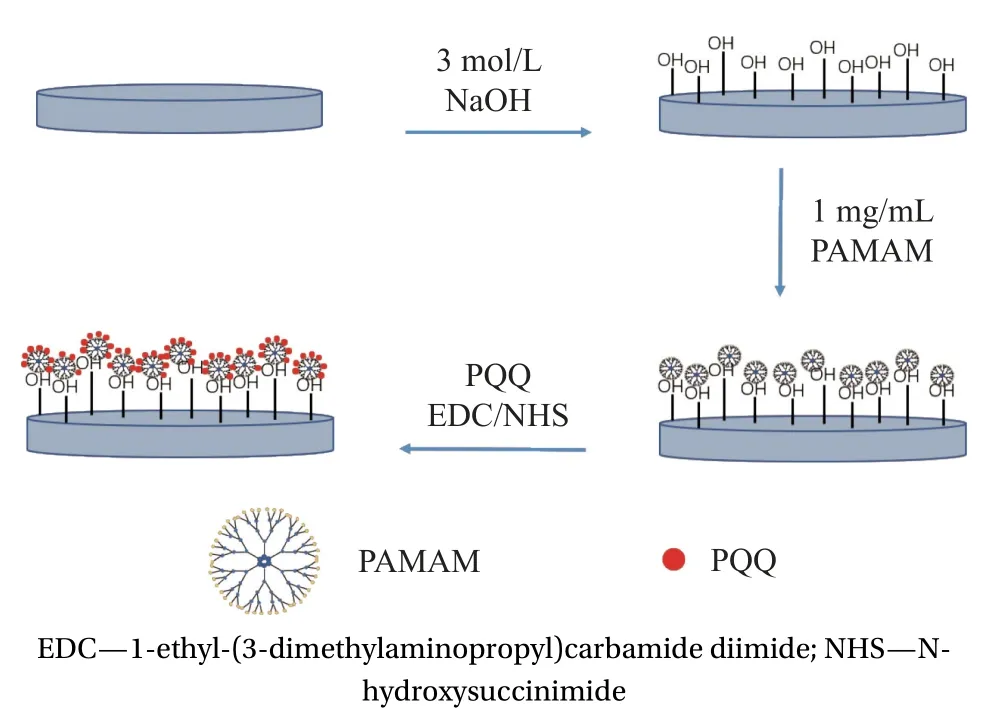
图1 聚酰胺胺(PAMAM)-吡咯喹啉醌(PQQ)功能层的制备过程Fig.1 Preparation process of polyamido amine (PAMAM)-pyrroloquinoline quinone (PQQ) functional layer
(1) 将钛基材打磨并抛光后分别使用无水乙醇和超纯水超声清洗,样品标记为Ti。
(2) 配制3 mol/L的氢氧化钠溶液;将Ti浸没于氢氧化钠溶液中,置于80℃条件下反应12 h,使用超纯水清洗,获得碱处理后的Ti,样品标记为TiOH。
(3) 在TiOH样品表面滴加质量浓度为1 mg/mL的PAMAM溶液,室温下反应12 h,样品标记为TiP。
(4) 分别配制浓度为200、250、300 nmol/mL的PQQ溶液,使用EDC/NHS活化PQQ,将共混溶液滴加于TiP样品表面,室温下反应24 h,将样品标记为TiPP,根据PQQ浓度分别标记样品为TiPP200、TiPP250、TiPP300,如表1所示。

表1 各样品编号Table 1 Marking of each sample
1.3 材料学表征
采用X射线光电能谱XPS (K-Alpha,Thermo Scientific)、傅里叶红外光谱(Nicolet iS50,Thermo Scientific)分别对材料表面的成分、结构及官能团进行表征。采用扫描电子显微镜(JSM 7800F Prim,日本电子株式会社)观察样品表面形貌,并采用水接触角检测仪对样品表面水接触角进行检测。进一步采用酸性橙检测材料表面氨基的变化量,并检测样品表面功能分子释放特征。
1.4 血液相容性评价
1.4.1 血小板黏附和激活实验
取新鲜血液,1 500 r/min离心15 min,上层得到富含血小板的富板浆(PRP);在样品表面滴加PRP,37℃孵育1 h;生理盐水清洗样品表面,使用质量分数为2.5wt%的戊二醛固定,过夜;将固定好的样品使用罗丹明染色,采用荧光显微镜(OLYMPUS IX73,奥林巴斯株式会社)观察材料表面的血小板;将样品脱水,喷金后使用SEM观察血小板形态。
1.4.2 凝血实验
取新鲜血液滴加于样品表面,37℃下分别孵育30 min、45 min;到达时间后加入超纯水静置3 min,收集上清液,采用酶标仪(Gen5,美国Biotek)检测吸光度值。
1.5 体外细胞学评价
采用内皮细胞和H9C2心肌细胞(以下称为心肌细胞)探究不同浓度PQQ功能层对细胞增殖和迁移的影响。将细胞以1×104个/mL的密度接种至样品表面,培养1天、3天后,使用质量分数为2.5wt%的戊二醛固定,罗丹明染色,荧光显微镜下观察细胞形态,使用细胞计数试剂(CCK-8)试剂检测细胞活性。
制备1 cm×2 cm的Ti样品并将其对折90°,在一端构建功能层,另一端为未改性表面。先将细胞以5×104个/mL的细胞密度接种至未改性表面,培养12 h后,再将样品翻转90°,添加新鲜培养基,继续培养24 h。使用质量分数为2.5wt%的戊二醛固定,罗丹明染色,荧光显微镜下观察细胞迁移情况。
1.6 抗氧化损伤能力评估
构建H2O2损伤下内皮细胞和心肌细胞的氧化损伤模型。将细胞以5×104个/mL的密度接种在样品表面,培养24 h后,使用200 µmol/L的H2O2与细胞共培养6 h。使用吖啶橙(Acridine orange hydrochloride,AO)/碘化丙啶(Propidium iodide,PI)试剂检测内皮细胞凋亡率,使用DCFH-DA探针检测内皮细胞内活性氧(Reactive oxide species,ROS)的含量。通过检测心肌细胞LDH释放量、SOD活性和MDA生成量来评价材料对心肌细胞抗氧化损伤的能力。
1.7 统计分析
对实验数据进行统计学分析,结果采用3次测定的均值±标准差(SD)表示。然后进行单因素方差分析,确定不同组间的差异有统计学意义。当p值小于0.05时,认为样本组间差异显著。*、**、***分别表示p< 0.05、p< 0.01、p< 0.001。
2 结果与讨论
2.1 PAMAM-PQQ功能层表征
图2为改性前后样品FTIR结果。在3 300 cm-1处TiOH、TiP及TiPP样品均有吸收峰,该吸收峰为O-H的伸缩振动峰。样品TiP表面含有氨基,因此,引入了N-H伸缩振动,该特征吸收峰在3 200~3 500 cm-1处发生重叠;1 640 cm-1和1 550 cm-1处分别出现了酰胺I带C=O的伸缩振动峰及酰胺II带的N-H面内弯曲振动吸收峰,由此可以判断PAMAM成功接枝到表面上。TiPP样品中1 550 cm-1处振动峰减弱,这是由于PQQ分子上的羧基基团消耗了表面的氨基导致的,且在1 600~1 700 cm-1之间出现了多个峰,这是喹啉环中C=N和C=C、醌和羧基中的C=O伸缩振动叠加引起的,因此,该结果表明PQQ在表面成功接枝。
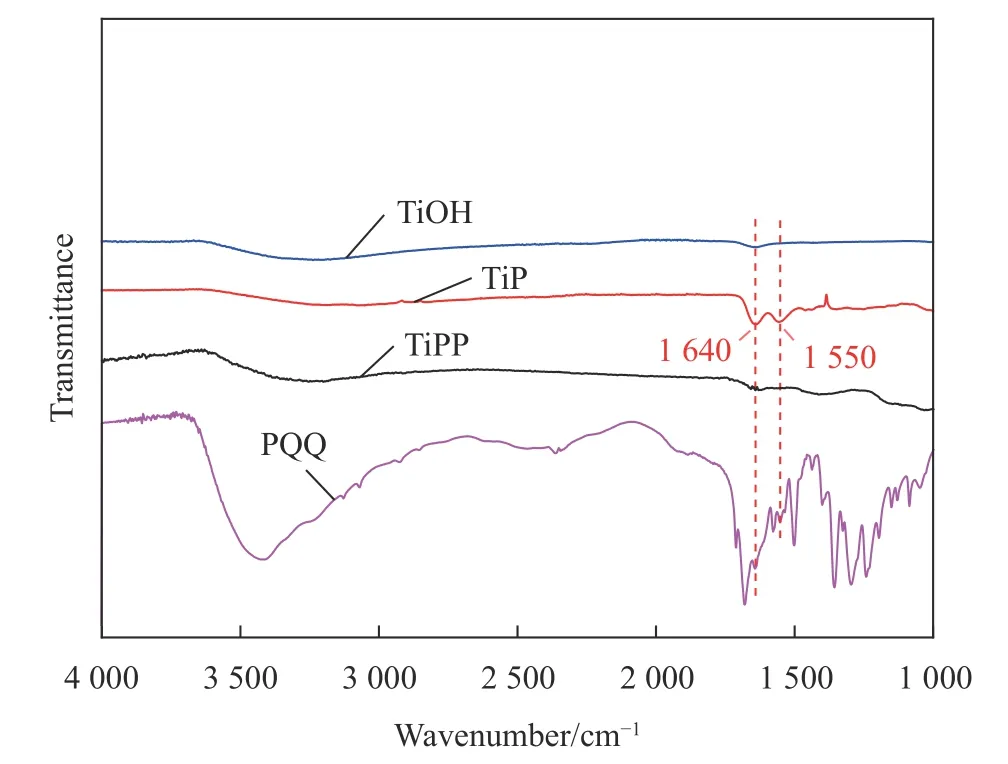
图2 各样品FTIR图谱Fig.2 FTIR spectra of samples
图3为改性前后样品XPS检测结果。相比于TiOH,TiP中出现了N元素峰,这是由于PAMAM分子中有大量含N元素的酰胺基团和氨基基团;由于PQQ分子元素组成和PAMAM相同,因此TiPP和TiP相比没有出现新的元素峰。
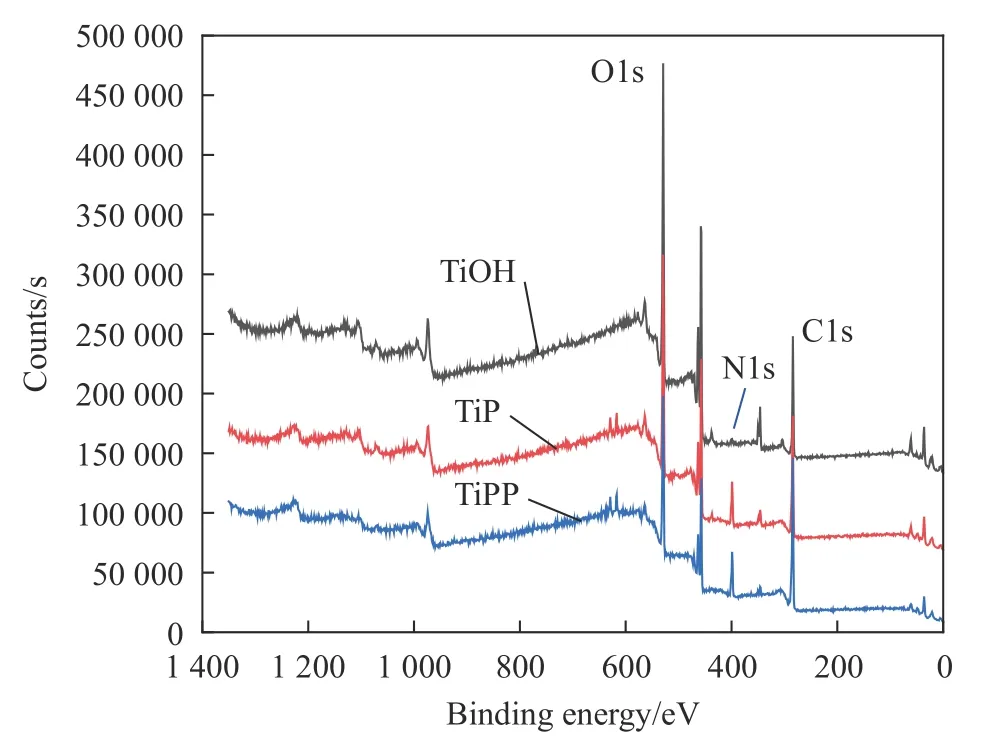
图3 各样品XPS全谱Fig.3 XPS spectra of samples
表2为改性前后样品表面各元素含量。通过各元素含量计算得到两个样品前后C/N的原子比由4.3增加至4.9。这是由于PAMAM分子接枝PQQ后,C元素增加量大于N元素增加量,且随着接枝PQQ分子数量增加,C/N的比值会逐渐增加。
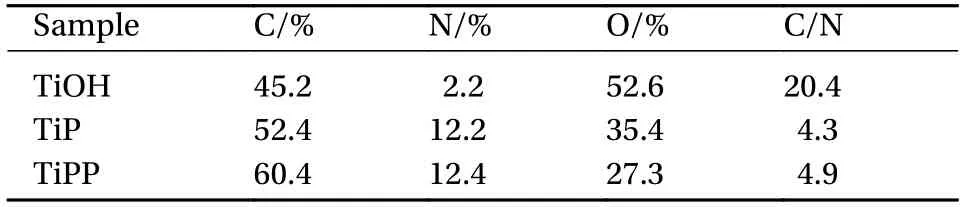
表2 各样品表面元素原子含量Table 2 Atomic proportion of each element on the sample surface
图4为改性前后样品表面氨基暴露量检测结果。由于PAMAM含有大量的氨基基团,因此,相对比TiOH,TiP表面氨基量显著增加。但在接枝PQQ后,消耗了材料表面氨基量,使表面氨基量有所减少。因此,可以说明PAMAM和PQQ均引入到了材料表面。
图5为改性前后样品SEM图像。碱活化后的TiOH样品表面呈现多孔网状结构。根据Reggente等[25]研究显示,该多孔网状结构呈微纳厚度。由于PAMAM和PQQ均是水溶性分子,因此引入PAMAM和PQQ后对样品表面形貌无明显影响。

图5 各样品表面SEM图像Fig.5 SEM images of the sample surface
图6为改性前后样品表面水接触角检测结果。样品表面水接触角的变化反映材料表面亲疏水性的变化。接枝了PQQ后样品表面水接触角有所降低,说明PQQ的引入使样品表面更加亲水,这与样品表面呈现网状多孔结构及表面富含有大量亲水基团有关[26]。有相关研究显示,提高材料表面的亲水性能提高材料表面的生物相容性[27]。
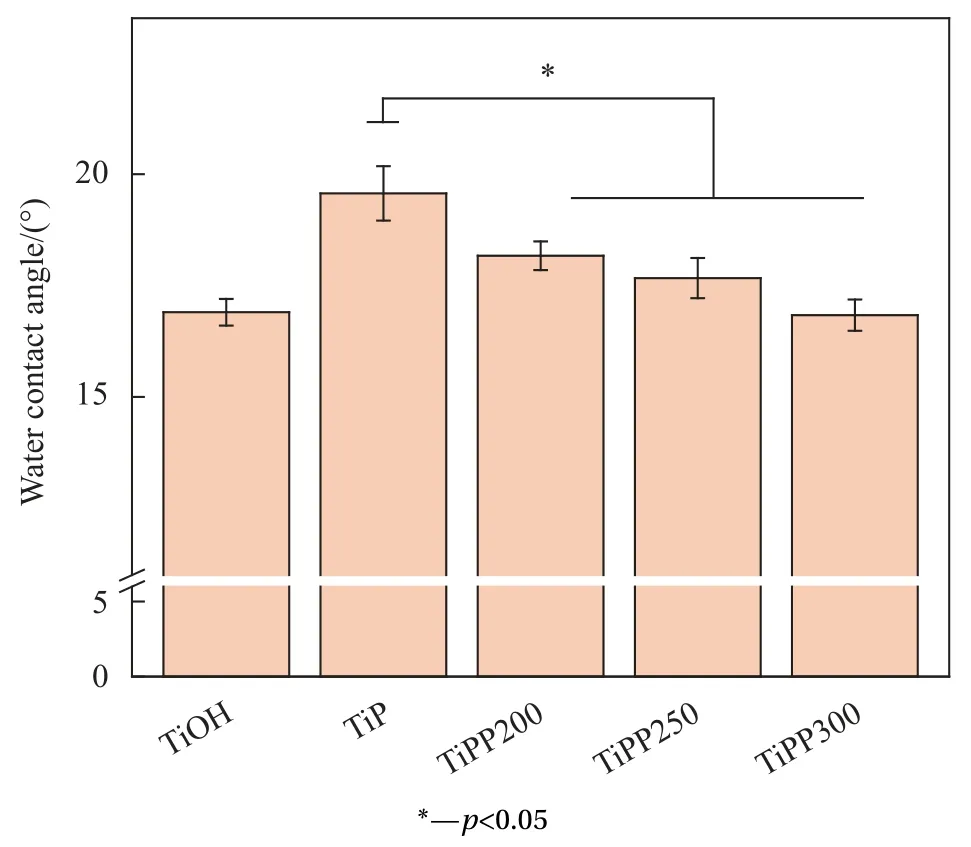
图6 各样品的水接触角Fig.6 Water contact angle of samples
接着,检测了样品表面一周时间内PQQ的释放量。图7为样品表面PQQ释放曲线。由于表面接枝量较少,因此,选取了最高浓度样品进行检测。可以看出,一周时间内释放总量仅为7.1%,说明功能层具有良好的稳定性。由于是利用静电作用先将PAMAM固定在Ti表面,再将PQQ分子引入,因此PQQ的释放量反映出PAMAM-PQQ功能层的释放特征。此外,钛具有较高的强度及良好的抗腐蚀性能,因此,构建的功能层不易降解且具有良好的稳定性。

图7 改性后样品TiPP300表面PQQ释放量Fig.7 Release of PQQ from the modified TiPP300 sample surface
2.2 样品表面血小板黏附与激活结果
图8为样品表面血小板荧光及数量统计结果。由图8(a)可得,TiOH表面黏附有大量的血小板。在表面引入PAMAM后,TiP样品表面血小板数量变少。相较于TiP,接枝PQQ后样品表面血小板数量均有减少。图8(b)中血小板黏附数量统计结果显示,随着PQQ浓度升高,血小板黏附数量减少。
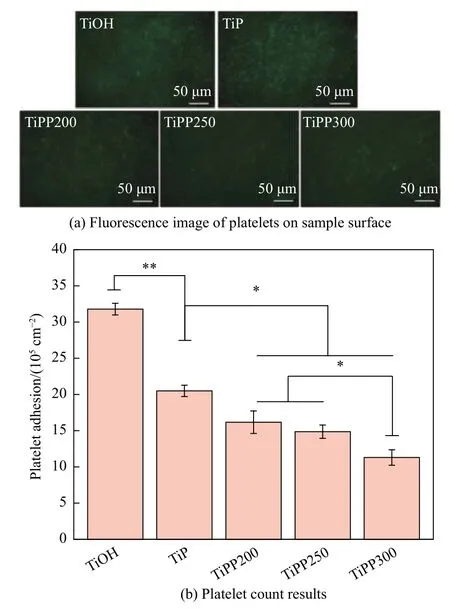
图8 各样品表面血小板荧光及数量统计结果Fig.8 Results of platelet fluorescence and number on the sample surface
图9为样品表面血小板SEM扫描结果。TiOH表面血小板严重激活,血小板几乎呈完全铺展形态。TiP表面部分血小板也伸出伪足,但激活程度不如TiOH表面。TiPP200、TiPP250和TiPP300表面血小板数量较少,少量伸出伪足,其中TiPP300表面血小板呈现圆形、几乎无伪足伸出,说明引入PQQ后材料表面具有良好的抗血小板黏附和激活能力。

图9 样品表面血小板微观形貌的SEM图像Fig.9 SEM images of platelets on the sample surface
2.3 样品表面凝血结果
将样品和血液孵育一定时间后,检测上清液的吸光度值(Optical density,OD)可以反映材料表面凝血情况。吸光度值越大,反映样品表面生成的血栓量越少。图10为血液在样品表面孵育30 min、45 min后上清液吸光度值结果。引入PAMAM和PQQ的样品上清液吸光度值均高于TiOH样品。TiPP200、TiPP250和TiPP300吸光度值均高于TiP,其中TiPP250和TiPP300吸光度值高于TiPP200。说明接枝PQQ后提高了材料表面抗凝血能力,且TiPP250和TiPP300样品效果更优。

图10 样品表面30 min和45 min凝血结果Fig.10 Coagulation results at 30 min and 45 min on the sample surface
2.4 样品表面内皮细胞活性、增殖及迁移结果
植入材料表面除了具有良好的抗凝能力外,还应具有促内皮的能力。图11为样品表面内皮细胞静态培养结果。图11(a)和图11(b)为内皮细胞静态培养1天、3天的荧光图和CCK-8结果。培养1天时,各样品表面细胞数量与细胞活性无明显差异,细胞均匀铺展在样品表面,且细胞形态较好。培养至3天后,各样品细胞的数量和活性都有提高,TiPP200、TiPP250和TiPP300表面细胞数量明显多于TiP表面。说明材料表面利于细胞黏附和增殖。其中,TiPP200活性稍优于TiPP250和TiPP300,这是由于PQQ属于醌类小分子化合物,醌浓度低时作为抗氧化剂,过高的浓度时起到促氧化剂的作用,对细胞具有毒性[28]。

图11 各样品内皮细胞静态培养结果Fig.11 Results of endothelial cell culture of samples
进一步探究了材料表面内皮细胞的迁移能力。由图11(c)和图11(d)可以看出,接枝了PQQ的样品迁移距离显著优于TiP表面;且随着PQQ浓度的增加,迁移距离也随之增加。Ge等[29]研究发现在材料中加入PQQ后提高了内皮细胞的迁移距离,本实验结果与其一致。
2.5 样品表面心肌细胞活性、增殖及迁移结果
H9C2心肌细胞,来源于BD1X大鼠胚胎心脏组织,该细胞易于培养,常被用于研究心肌细胞分化的前体干细胞模型。由于植入材料也与心肌细胞相接触,因此,材料对心肌细胞也应具有较好的相容性。
图12为心肌细胞在材料表面静态培养结果。图12(a)和图12(b)分别为细胞静态培养1天、3天的荧光图和细胞计数试剂(Cell counting Kit-8,CCK-8)结果,图12(c)和图12(d)为细胞迁移荧光图和迁移距离结果。由图12(a)可得,培养1天时,各样品组之间数量无明显差异,但TiPP250和TiPP300表面细胞形态亮好,多表现为梭形。培养3天后,各样品表面细胞数量都有明显增多,其中接枝PQQ的样品表面细胞数量多于TiP样品。由图12(b)可得,接枝PQQ的样品细胞活性均高于TiP样品。

图12 各样品心肌细胞静态培养结果Fig.12 Results of myocardial cells culture of samples
由图12(c)和图12(d)迁移结果可得,PQQ的引入显著提高了心肌细胞的迁移距离,且TiPP300样品促进心肌细胞迁移效果最好。这是由于细胞在迁移过程中会受到能量的影响[30],而PQQ可以增加细胞中健康线粒体的数量[28],从而提供更多的能量促进细胞的迁移。
2.6 功能层抗氧化损伤能力评估结果
H2O2是体内多种代谢途径的产物,是重要的活性氧之一,其可以氧化细胞内核酸、蛋白质等分子,还可以氧化细胞膜的脂质及蛋白质,引起细胞膜功能受损。因此,选用H2O2损伤细胞来模拟体内氧化应激微环境。
2.6.1 H2O2损伤下内皮细胞行为
图13为H2O2损伤后内皮细胞检测结果。图13(a)和图13(b)分别为内皮细胞活死染色结果(上面为活细胞,下面为死细胞)和细胞凋亡率结果。由图13(a)可得,在H2O2损伤后,TiP样品出现大量细胞凋亡,TiPP200、TiPP250和TiPP300仅有少量凋亡细胞。图13(b)细胞凋亡率结果显示,TiP样品细胞凋亡率为33.5%,TiPP200、TiPP250和TiPP300细胞凋亡率分别为7.9%、5.8%、4.1%,PQQ的引入显著降低了由H2O2引起的内皮细胞凋亡。

图13 各样品内皮细胞活死染色结果Fig.13 Results of live and dead staining of endothelial cells of samples
在H2O2损伤内皮细胞后,使用DCFH-DA荧光探针染色检测内皮细胞内的ROS含量,如图14所示。可以看出,TiPP200、TiPP250和TiPP300样品表面荧光亮度低于TiP表面,说明PQQ的引入能抑制细胞内的ROS生成。

图14 各样品内皮细胞内活性氧(ROS)含量检测结果Fig.14 Results of reactive oxide species (ROS) content in endothelial cells of samples
2.6.2 H2O2损伤下心肌细胞行为
图15为H2O2损伤后心肌细胞染色结果。TiP样品表面细胞形态呈现为圆形,部分细胞出现空泡化,这说明细胞状态不好且趋于凋亡。TiPP200、TiPP250和TiPP300样品表面细胞铺展均匀,形态良好呈长梭形。

图15 各样品H2O2损伤后心肌细胞荧光图片Fig.15 Fluorescence images of myocardial cells of samples after H2O2 injury
图16为H2O2损伤后心肌细胞LDH释放量、SOD活性和MDA生成量结果。TiPP200、TiPP250和TiPP300样品降低了LDH释放量,提高了SOD活性及减少MDA的生成量。说明PQQ的引入能降低H2O2带来的损伤及对心肌细胞具有保护作用。

图16 各样品H2O2损伤下心肌细胞检测结果Fig.16 Results of myocardial cells detection of samples under H2O2 injury
PQQ可以催化O2与O2-相互转化,从而在PQQ和PQQH2(PQQ还原型)间转换;PQQH2还可以与单线态氧、羟自由基等反应再次氧化为PQQ,以此来维持体内氧自由基平衡[31]。PQQ可以通过自身氧化还原循环来调节LDH酶活性,促进丙酮酸生成[32]。PQQ还可以作为非共价结合辅基与超氧化物歧化酶SOD协同消化自由基,降低自由基对细胞的伤害[33]。
3 结 论
(1) 利用聚酰胺胺(PAMAM)端部氨基基团,将吡咯喹啉醌(PQQ)引到Ti表面,成功构建了PAMAM-PQQ功能层。PAMAM及PQQ固定后表面呈现多孔网状结构及具有高度亲水性,且功能层具有良好的稳定性。
(2) PQQ的引入减少了表面血小板黏附数量及激活程度,并表现出较好的抗凝血能力,其中使用PQQ浓度为300 nmol/mL时效果更优。
(3) PQQ的引入提高了内皮细胞和心肌细胞活性、增殖及迁移能力,同时,PQQ均以浓度依赖的方式促进两种细胞迁移。
(4) PQQ的引入减少了内皮细胞因氧化损伤引起的死亡且抑制胞内活性氧(ROS)产生。PQQ的引入也降低了氧化损伤后的心肌细胞乳酸脱氢酶(LDH)释放量、丙二醛(MDA)生成量及提高了细胞内超氧化物歧化酶(SOD)的活性,降低了心肌细胞受到的氧化损伤。
