改性羟基磷灰石/混酸氧化多壁碳纳米管的制备及应用
2024-03-08何迎迎王瑞雪周渊樊林奎窦妍
何迎迎,王瑞雪,周渊,樊林奎,窦妍*
(1.长安大学 水利与环境学院,西安 710054;2.长安大学 旱区地下水文与生态效应教育部重点实验室,西安 710054;3.长安大学 水利部旱区生态水文与水安全重点实验室,西安 710054)
锰作为过渡区重金属之一,在地壳中储量丰富,分布广泛。锰矿的开采对国民经济具有重大的战略意义[1-4]。然而,锰矿的开采和加工、工厂污染物的违规排放及环境变化引起含水层中含锰矿物的溶解,导致水体锰浓度超标现象频出[5-9]。环境中较高浓度的锰不仅会引发人体的骨骼缺陷、不孕症、心脏病和高血压,还会降低生物体的适应性[10]。针对水体中锰污染的去除方法的研究,目前主要包括化学沉淀法、传统吸附法、离子浮选法、离子交换法、混凝/絮凝法、电化学法等。然而,吸附去除法在工业化应用中具有高效、低廉和操作简单的优势[11],因此开发吸附性能更优异的吸附材料依然是研究的热点。
碳纳米管根据层数可以分为单层或多层[12]石墨烯卷曲而成的无缝中空管,其两端由半球形的富勒烯封帽形成。碳纳米管中空内部、间质通道、外表面、相邻碳纳米管间的沟槽均被证明可作为吸附位点[13],已有研究证明碳纳米管可去除重金属离子的能力[14-15],其中多壁碳纳米管(MWCNTs)在经济上及改性方法上比单壁碳纳米管具有更好的优势[16]。然而,碳纳米管由于材料本身的易团聚性使材料的吸附性能大大降低[17],因此在应用中碳纳米管在作为吸附材料时往往会进行改性[18-20]。
羟基磷灰石(Ca10(PO4)6(OH)2,HAP)大量存在于动物骨骼和牙齿中,对生物和环境危险极小,是一种环境友好型材料,且合成工艺简单、原材料价格低廉。在碱性条件下,HAP稳定存在,但在酸性条件会生成Ca2+和H2PO4-,其晶体中的Ca2+可与不同半径的二价阳离子发生离子交换[21],同时OH-和PO43-也可以被其他阴离子取代[22]。因此,HAP常被作为改性材料,通过掺杂离子、接枝表面活性剂或高分子等方式来提升基体材料的分散性和吸附性能等[23-24],亦有研究表明,由纳米材料与羟基磷灰石制备的复合材料对许多金属如Pb(II)、Cd(II)、Cu(II)、Co(II)、Cr(VI)及非金属F-等具有良好的去除效果[25-27]。
基于此,本文以混酸氧化的多壁碳纳米管(AO-MWCNTs)为基体,通过微波/光波辅助化学沉淀法分步制备氟碳掺杂的羟基磷灰石(FCHAP),并将其负载到AO-MWCNTs上,合成氟碳掺杂羟基磷灰石/混酸氧化多壁碳纳米管(FCH/AOMWCNTs)复合材料。据此赋予FCH/AO-MWCNTs高分散性及多位点吸附性能,实现新材料对水体重金属Mn(II)去除性能的提升。
1 实验材料与方法
1.1 原材料
多壁碳纳米管(MWCNTs)为工业级(>95%),购于中国科学院成都有机化学有限公司;浓硫酸(H2SO4,98%,AR)、浓硝酸(HNO3,68%,AR),购于西安三浦化学试剂有限公司;无水乙醇(CH3CH2OH,AR),购于天津富宇精细化工有限公司;浓氨水(NH3·H2O,AR),购于郑州派尼化学试剂厂;氢氧化钠(NaOH,AR),购于天津市百世化工有限公司;盐酸(HCl,AR)、四水合硝酸钙(Ca(NO3)2·4H2O,AR)、磷酸氢二铵((NH4)2HPO4,AR)、氟化铵(NH4F,AR)、碳酸铵((NH4)2CO3,AR)、四水合氯化锰(MnCl2·4H2O,GR),购于天津市大茂化学试剂厂。
1.2 材料制备
1.2.1 AO-MWCNTs的制备
将购买的原始MWCNTs参考文献[28]来制备AO-MWCNTs。
1.2.2 HAP的制备
HAP的制备按照文献[29]来制备。分别配制0.025 mol/L的Ca(NO3)2·4H2O溶液和0.03 mol/L的(NH4)2HPO4溶液。在30℃转速恒定的搅拌条件下,将55.6 mL的(NH4)2HPO4以4 mL/min的流速滴入100 mL的Ca(NO3)2·4H2O溶液中(摩尔比n(Ca∶P)=1.5∶1),滴加浓氨水调节pH至10,使用保鲜膜包裹以阻止氨水的蒸发,将混合溶液迅速转移至微波炉中使用微波/光波组合间隔加热20 min并趁热离心分离,使用纯水清洗至接近中性,使用乙醇洗去多余的水分,80℃干燥24 h得到白色粉末HAP-1,使用玛瑙研钵研磨后封装并置于干燥器中备用。
作为对照,采用不同方法辅助化学沉淀法合成HAP,包括仅使用微波辅助合成HAP-2、仅使用加热辅助合成HAP-3、传统化学沉淀法合成HAP-4、超声法辅助合成HAP-5,如表1所示。上述HAP合成过程中的钙磷摩尔比、陈化时间、反应pH、反应温度均由单因素实验获得。合成条件优化效果均按照Mn(II)初始浓度为20 mg/L、pH为6.4、温度为296 K、吸附剂质量为20 mg、搅拌速度180 r/min的条件下的锰吸附率来比较。

表1 羟基磷灰石(HAP)的合成方法及名称Table 1 Synthesis methods and names of hydroxyapatite(HAP)
1.2.3 FCHAP的制备
按照F-取代OHF-含量20%、40%、60%、80%、100%的理论值将一定体积的NH4F (0.03 mol/L)与(NH4)2HPO4(0.03 mol/L)混合均匀并滴入Ca(NO3)2·4H2O溶液,后续操作按照1.2.2的方法合成氟掺杂羟基磷灰石(FHAP)。按照CO23-取代PO34-含量10%、20%、30%、40%、50%、60%的理论值将一定体积的(NH4)2CO3(0.03 mol/L)与(NH4)2HPO4(0.03 mol/L)混合均匀并滴入Ca(NO3)2·4H2O溶液,后续操作按照1.2.2的方法合成碳羟基磷灰石(CHAP)。依据最佳比例制备双相掺杂的FCHAP。
1.2.4 FCH/AO-MWCNTs的制备
将质量分数为0wt%、0.25wt%、0.5wt%、1wt%、2wt%、5wt% (总质量为制备过程中加入的所有固体试剂质量总和)的AO-MWCNTs加入Ca(NO3)2·4H2O溶液中,在30℃下超声40 min再搅拌10 min,加入9 mL NH4F、10 mL (NH4)2CO3与40 mL (NH4)2HPO4混合均匀以4 mL/min的流速滴入90 mL的Ca(NO3)2·4H2O溶液中(使摩尔比n(Ca∶P∶C∶F)=1.5∶0.8∶0.2∶0.18)。后续步骤依照1.2.2节的制备方法得到FCH/AO-MWCNTs,其制备过程如图1所示。

图1 氟碳掺杂羟基磷灰石/混酸氧化多壁碳纳米管(FCH/AO-MWCNTs)的制备Fig.1 Schematic diagram of the preparation of fluorine/carbon-doped hydroxyapatite/mixed-acid oxidized multi-walled carbon nanotubes(FCH/AO-MWCNTs)
1.3 材料表征
SEM-EDS:场发射扫描电子显微镜(JSM-7610Fplus,Jeol)可以对HAP、FCHAP和FCH/AOMWCNTs的形貌进行分析。仪器放大倍数范围为50~1 000 000x。此外,还可联用Oxford X-MAX (EDS)来测定材料表面的元素组成。
FTIR:样品经80℃烘干后采用溴化钾压片法检测样品的红外光吸收情况。扫描波长范围为400~4 000 cm-1。仪器型号为傅里叶红外光谱仪(IR Tracer 100,岛津)。
XPS:通过X 射线光电子能谱仪(Thermo SCIENTIFIC ESCALAB Xi+,Thermo)来分析复合材料在改性过程中的表面元素含量。仪器使用单色化Al靶(E=1 486.68 eV,E为光子能量),通能为100 eV。
XRD:将制备得的材料干燥处理之后使用X射线衍射仪(D8 ADVANCE,德国布鲁克AXS有限公司)来确定物相。扫描速度5°/min。
Zeta:将样品以1∶100 000的比例分散至一定pH的纯水中并在检测前超声10~15 min。使用纳米粒度电位分析仪(ZEN3700,Malvern)来分析样品的Zeta电位及粒径。Zeta电位采用电泳光散射法测量,粒径采用动态测量法测量。仪器默认对每一个样进行3次检测,Zeta电位取3次检测结果的平均值。
BET:将材料干燥处理后,在真空100℃条件下对样品预处理6 h,使用比表面吸附仪(日本-麦奇克拜尔-BELSORP MaxII,麦克2460),77 K液氮条件下,对样品进行氮气吸附脱附测试,得到比表面积、孔容和孔径等数据。
1.4 材料对Mn(II)的吸附实验
1.4.1 动力学实验
称取20 mg FCH/AO-MWCNTs吸附剂放于装有20 mL 30 mg/L的锰溶液,在室温下(293 K)分别振荡5、10、30、60、180、360、600、1 440 min。实验中Mn(II)的测定使用火焰原子吸收光谱仪测定残余Mn(II)含量,样品测试前使用0.22 µm亲水性滤头过滤。为减小误差,做3组平行实验。采用文献[28]中的准一级动力学和准二级动力学模型公式进行拟合。
1.4.2 热力学实验
量取20 mL、30 mg/L的Mn(II)溶液放于离心管内,精确称取20 mg FCH/AO-MWCNTs吸附剂放入离心管内,之后置于180 r/min的摇床。在不同温度下(293 K、303 K、313 K、323 K)分别振荡1 440 min。后续操作及模型拟合同1.4.1节。采用文献[28]中的热力学公式来进行计算拟合。
1.4.3 等温吸附实验
精确称取20 mg FCH/AO-MWCNTs吸附剂放于离心管内,加入20 mL、不同浓度的锰溶液后置于180 r/min的摇床。在室温下(293 K)分别振荡1 440 min。后续操作及模型拟合同1.4.1节。采用文献[28]中的Langmuir模型、Freundlich模型和Dubini-Radushkevich (D-R)模型公式来进行拟合计算。
1.4.4 竞争吸附实验
将Pb(NO3)2、CdCl2、MnCl2同时加入含有20 mg FCH/AO-MWCNTs的溶液中,溶液中各金属离子浓度[30]分别为20、20、30 mg/L,并于室温(293 K)下置于180 r/min的摇床振荡480 min。溶液中残余Pb(II)、Cd(II)、Mn(II)浓度使用火焰原子吸收光谱仪测定,后续操作同1.4.1节。
1.4.5 再生循环实验
在50 mL的离心管中加入20 mg FCH/AOMWCNTs及20 mL 30 mg/L的Mn(II)溶液,在室温(293 K)下置于180 r/min的摇床振荡600 min,测定溶液中残余锰浓度(同1.4.1节处理)。将吸附饱和的FCH/AO-MWCNTs干燥处理再加入到40 mL 0.025 mol/L的Ca(NO3)2·4H2O[30]溶液中振荡脱附300 min,使用纯水多次洗涤之后干燥。重复循环实验4次。
2 结果与讨论
2.1 FCH/AO-MWCNTs的形成
在进行纳米复合材料合成的过程中,由于需要获取最优去除效果的材料,因此,统一采取对Mn(II)的去除效果作为材料优化的筛选条件。
首先,采用不同辅助方法合成HAP,并对比在Mn(II)去除方面的效果,如图2所示,吸附率由大到小的顺序为微波/光波组合法>超声>仅微波>传统化学沉淀法>仅光波,相关研究[31]表明,使用微波/光波处理得到的羟基磷灰石表面具有更加丰富的活性吸附位点。故后续选择微波/光波组合辅助化学沉淀法作为后续研究的合成方法。
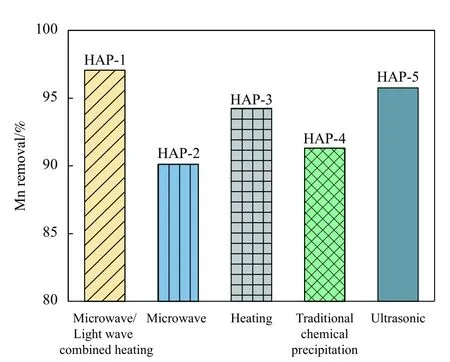
图2 辅助方法对HAP吸附性能的影响Fig.2 Influence of auxiliary methods on the adsorption performance of HAP
其次,分步制备氟掺杂和碳掺杂的HAP,并通过条件优化获取最佳氟碳比例(60%F和20%C)合成双相掺杂羟基磷灰石(FCHAP)。
最后,将FCHAP与不同质量比(AO-MWCNTs的质量占加入的所有药品质量比例)的AO-MWCNTs按照以1.2.4的方法进行负载实验,获取复合材料FCH/AO-MWCNTs。结果如表2所示,AO-MWCNTs的最佳掺杂量为0.5wt%。表2中使用锰溶液初始浓度为30 mg/L,确定最佳掺杂比例之后又进行了100 mg/L的高浓度锰溶液的吸附实验,结果表明AO-MWCNTs与FCH/AO-MWCNTs的吸附率分别为30.2%、98.75%,复合材料的锰吸附能力大大提高。
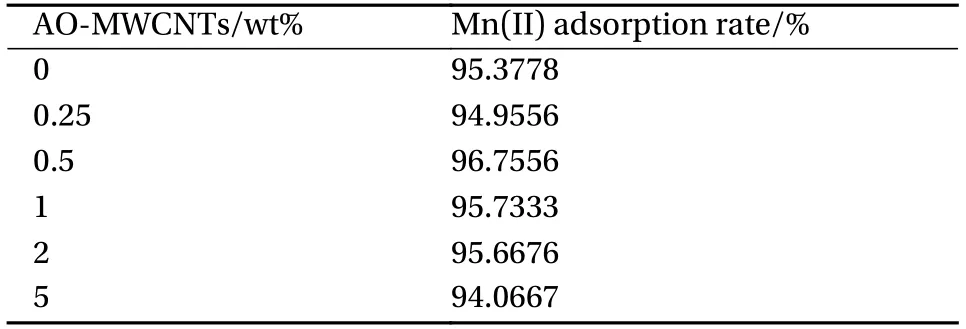
表2 不同质量比AO-MWCNTs制备的FCH/AO-MWCNTs对Mn(II)的吸附率Table 2 Adsorption rates of Mn(II) on FCH/AO-MWCNTs prepared with different mass ratios of AO-MWCNTs
2.2 FCH/AO-MWCNTs表征分析
2.2.1 FCH/AO-MWCNTs的微观形貌
材料的EDS元素检测结果见图3,SEM表征结果见图4。从图3可以看到,相对于HAP,FCHAP、FCH/AO-MWCNTs都存在氟的出现及材料中碳含量的增加和氧含量的减少的现象,这一结果可以认为CO32-和F-被成功地固定在新材料中。从SEM图像中可观察到,图4(a)、图4(b)中HAP是由长度为60 nm左右、直径为8 nm左右的棒状晶粒团聚而成的颗粒,部分HAP板结形成微米级的块状颗粒。图4(c)、图4(d)中FCHAP是由20~50 nm左右的球状晶粒组成的具有疏松多孔结构的泡沫状团聚体,这种结构极大的提高FCHAP的比表面积,有利于离子交换和络合反应的进行。图4(e)、图4(f)显示大量球状FCHAP颗粒包裹管状的AO-MWCNTs,且在高倍镜下观察到FCHAP主要生长在AO-MWCNTs的端口处和弯折处。参考文献[28]中可以知道AO-MWCNTs更可能发生团聚,而新材料AO-MWCNTs与FCHAP相互支撑,形成更丰富的孔隙结构。
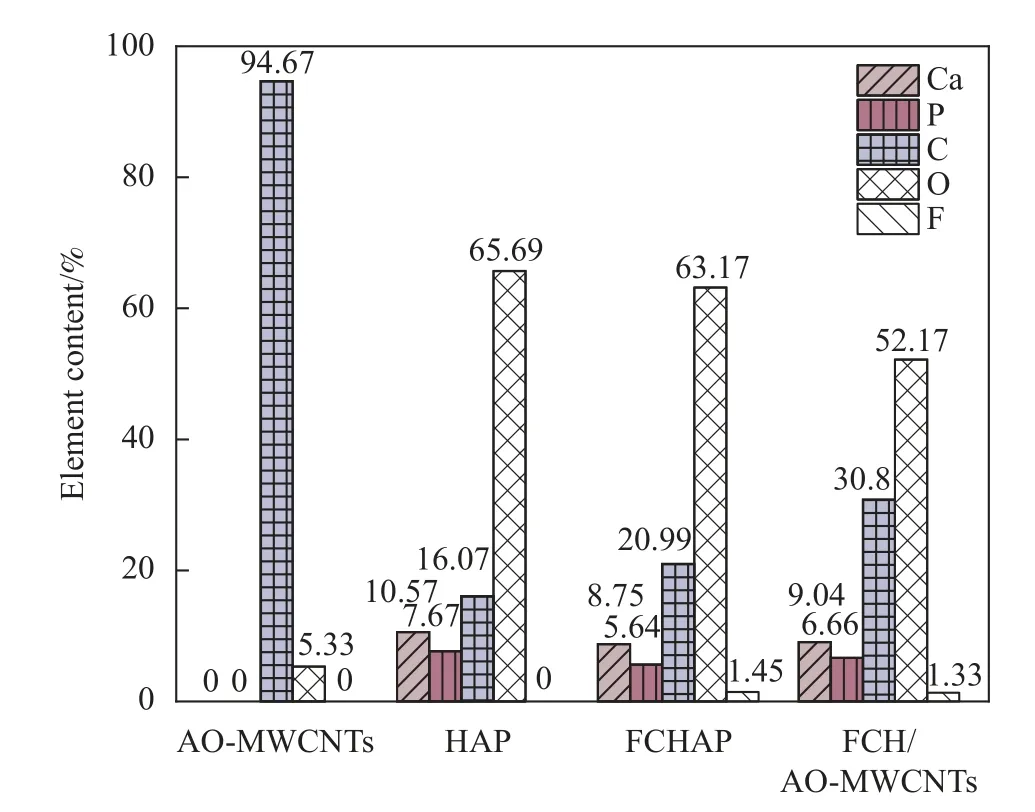
图3 AO-MWCNTs、HAP、氟碳掺杂的羟基磷灰石(FCHAP)、FCH/AOMWCNTs的EDS结果Fig.3 EDS results of AO-MWCNTs,HAP,fluorine/carbon-doped hydroxyapatite (FCHAP),FCH/AO-MWCNTs

图4 HAP ((a),(b))、FCHAP ((c),(d))及FCH/AO-MWCNTs ((e),(f))的SEM图像Fig.4 SEM images of HAP ((a),(b)),FCHAP ((c),(d)) and FCH/AO-MWCNTs ((e),(f))
2.2.2 FCH/AO-MWCNTs的微观结构
HAP、FCHAP、FCH/AO-MWCNTs的FTIR图谱如图5所示。结果显示在565 cm-1、603 cm-1处观察双峰,这归因于PO43-中O-P-O拉伸和振动吸收,1 037 cm-1和1 099 cm-1处则为P-O不对称伸缩吸收峰;866 cm-1和1 472 cm-1处为CO32-面外弯曲振动和非对称伸缩振动吸收峰;3 400、635 cm-1左右对应-OH的伸缩振动吸收。FCH/AO-MWCNTs的FTIR图谱中866、1 472 cm-1处CO32-的吸收峰增强,635 cm-1处OH-吸收峰的减弱,说明CO32-和F-可能分别取代PO43-和OH-进入HAP晶格[32]。FCH/AO-MWCNTs的FTIR图谱并未显示出AO-MWCNTS的特征峰[28],可能原因是AOMWCNTS表面的-COOH和-OH被包裹,其吸收峰被掩蔽。
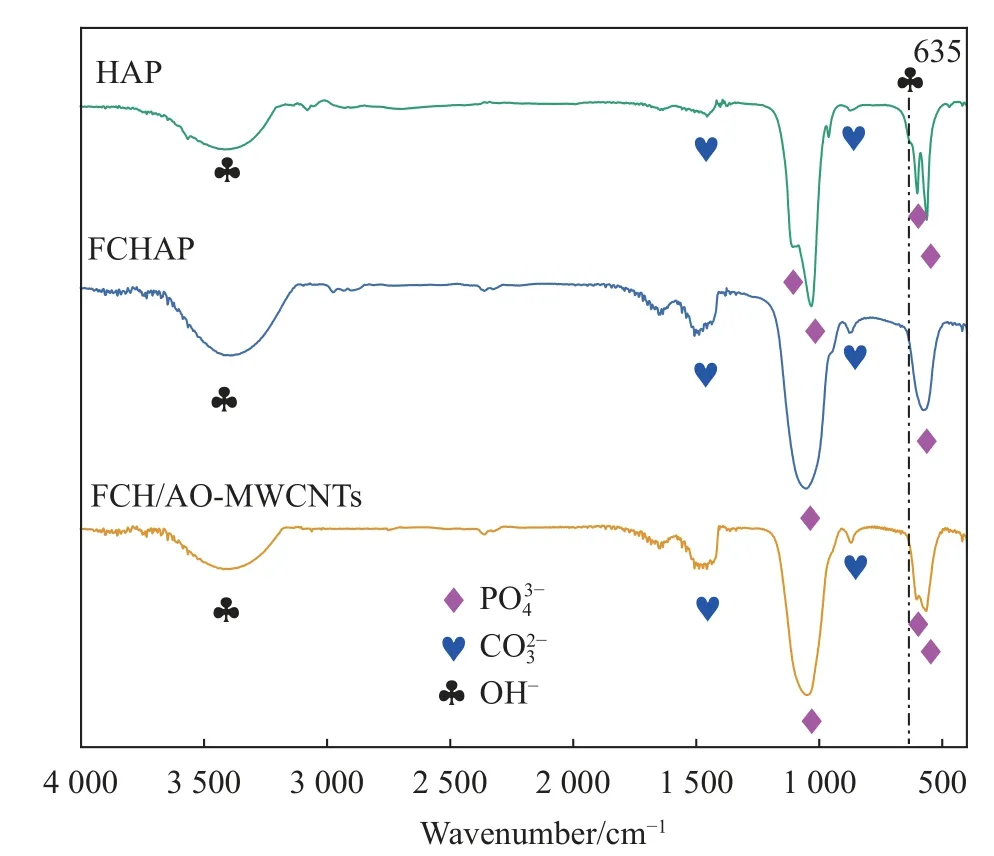
图5 HAP、FCHAP和FCH/AO-MWCNTs的FTIR图谱Fig.5 FTIR spectra of HAP,FCHAP and FCH/AO-MWCNTs
2.2.3 FCH/AO-MWCNTs的表面元素
HAP、FCHAP、FCH/AO-MWCNTs的XPS全谱图如图6所示。对于HAP来说,FCHAP和FCH/AO-MWCNTs的C1s (284.40 eV)峰强度有略微增加和O1s (531.05 eV)峰略微减弱,并且在684.05 eV处观察到F1s峰的出现。这一现象印证SEM和FTIR的结论,即合成过程中加入的CO32-和F-被成功地固定在合成的材料中。XPS的分析深度仅为表面10 nm左右,而FCHAP的SEM测量结果显示FCHAP粒径的直径在20~50 nm,因此当AO-MWCNTs被完全包裹时,XPS无法检测到被包裹的AO-MWCNTs的元素。
2.2.4 FCH/AO-MWCNTs的物相分析
XRD数据使用Jade 5.0软件[33]来进行计算处理,计算结果如图7所示。HAP的主要衍射峰与XRD标准卡片(JCPDS 09-0432)匹配,未观察到其他相的衍射峰,但衍射峰较宽,说明产物为纯的HAP,但结晶度较低。FCH/AO-MWCNTs重新出现HAP的特征峰,但衍射强度明显低于HAP,峰宽增加,部分特征峰消失。结合FTIR和XPS的结论可以证实CO32-和F-完全进入HAP的晶格,而非生成其他物质。XRD图谱未观察到AO-MWCNTs的特征峰[28],可能原因是AO-MWCNTs的衍射峰强度相对较低,因此无法被明显的分辨。
2.2.5 FCH/AO-MWCNTs的表面电荷与粒径分析
Zeta电位是一个表征分散体系稳定性的重要指标,当pH<零点电荷(pHPZC)时,材料表面带有正电荷,当pH>pHPZC时,材料表面带有负电荷[34]。Zeta电位测量结果如图8所示,当pH在2~10范围内,HAP、FCHAP、FCH/AO-MWCNTs的Zeta电位随pH的增加而逐渐减小,并在2.40、2.23、2.33处具有零电势。当pH低于3.67时,FCH/AOMWCNTs表面所带电荷的数量少于FCHAP和HAP;当pH>3.67,FCH/AO-MWCNTs的Zeta电位均小于HAP和FCHAP。参考文献[28]中AOMWCNTs在所测试pH范围内都为负值,其表面负电荷数量高于FCH/AO-MWCNTs。
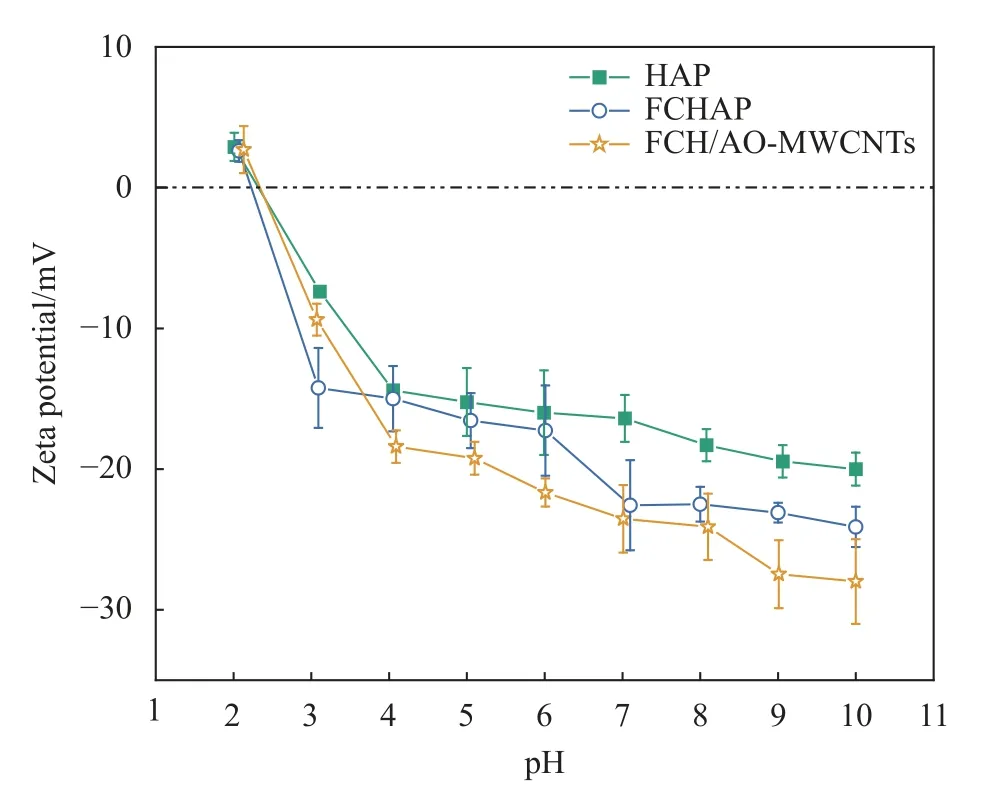
图8 HAP、FCHAP和FCH/AO-MWCNTs的Zeta电位Fig.8 Zeta potential test results of HAP,FCHAP and FCH/AO-MWCNTs
从文献[28]中了解到AO-MWCNTs平均粒径为194 nm,均匀性差,稳定性高。图9为pH=7.01时材料的粒径分布。图9(a)显示HAP的粒径分布较对称,但随着测量的进行,粒径分布变宽、峰右移,说明HAP颗粒均匀性较好,在水溶液中的分散性和稳定性较差,这是由于化学沉淀法合成的HAP极易团聚[35]。图9(b)显示FCHAP的粒径分布情况与HAP相似,但粒径分布范围较HAP更窄、平均粒径变化更小,说明FCHAP在水溶液中的团聚情况较HAP有较大改善。图9(c) 可以观察到FCH/AO-MWCNTs的粒径分布对称且在测量过程中基本不发生变化,粒径集中在351 nm左右,说明FCH/AO-MWCNTs颗粒均匀且稳定性较高,与Zeta电位测试结果一致。另外,在图9(c)的粒径分布图中并未出现AO-MWCNTs在194 nm处的粒径分布,说明AO-MWCNTs被均匀地包裹在表面,且并未由于研磨和超声的作用而发生分离。结合SEM结果,可以认为所合成FCH/AO-MWCNTs是能够稳定存在的纳米材料。

图9 HAP (a)、FCHAP (b)、FCH/AO-MWCNTs (c)的粒径测试结果Fig.9 Particle size test results of HAP (a),FCHAP (b),FCH/AO-MWCNTs (c)
2.2.6 FCH/AO-MWCNTs的比表面积和孔径分布
HAP、FCHAP和FCH/AO-MWCNTs的N2吸附-脱附等温线及孔径分布如图10所示,在相对压力0<p/p0<0.1低压区域出现拐点,说明材料表面有少量微孔,进行单层吸附;在0.1<p/p0< 0.6中压区域等温线较平缓,为多层吸附;当p/p0在0.6~1.0范围内时,氮气的吸附和脱附曲线呈闭环,说明合成的纳米结构样品中存在不规则的介孔[36]。
通过表3可知,HAP的比表面积为101.20 m²/g,孔径为24.4186 nm,FCHAP由于离子的掺杂使晶体结构发生改变,对孔隙度及结晶度产生了影响,其比表面积下降为54.44 m²/g,数据表明掺杂离子之后其孔径变大为28.2206 nm。FCH/AO-MWCNTs为纳米材料基体和掺杂材料形成的块条状复合材料,因此新材料的比表面积与孔径分布异于HAP和FCHAP。根据以上结果推测新材料对Mn(II)的强吸附能力可能不仅依靠物理吸附,还会与化学吸附相关联。
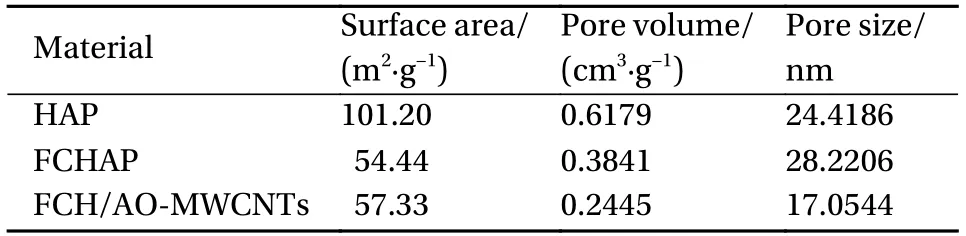
表3 HAP、FCHAP和FCH/AO-MWCNTs的比表面积、孔容及孔径Table 3 BET surface area,pore volume and pore size of HAP,FCHAP and FCH/AO-MWCNTs
2.3 FCH/AO-MWCNTs对Mn(II)的吸附模型
2.3.1 动力学拟合
准一级和准二级动力学拟合参数见表4。准二级动力学模型拟合的相关系数R2值高于准一级动力学模型,由准二级动力学拟合得到的qe.cal与实验值接近,这表明化学吸附在FCH/AOMWCNTs吸附Mn(II)的过程中起到主要作用,该结果与BET的测试结果一致。

表4 FCH/AO-MWCNTs吸附Mn(II)的准一级和准二级动力学模型参数Table 4 Pseudo-first-order and pseudo-second-order kinetic parameters for the adsorption of Mn(II) by FCH/AO-MWCNTs
2.3.2 热力学拟合
热力学数据拟合结果见图11,计算结果见表5。Mn(II)在FCH/AO-MWCNTs上吸附的吉布斯自由能(ΔG)在不同温度下均小于0,说明吸附是自发进行的;焓变ΔH<0,说明吸附反应为放热反应;熵变ΔS>0,说明吸附过程中体系混乱度增加。

图11 FCH/AO-MWCNTs吸附Mn(II)的热力学模型拟合结果Fig.11 Thermodynamic model fitting results for the adsorption of Mn(II) by FCH/AO-MWCNTs
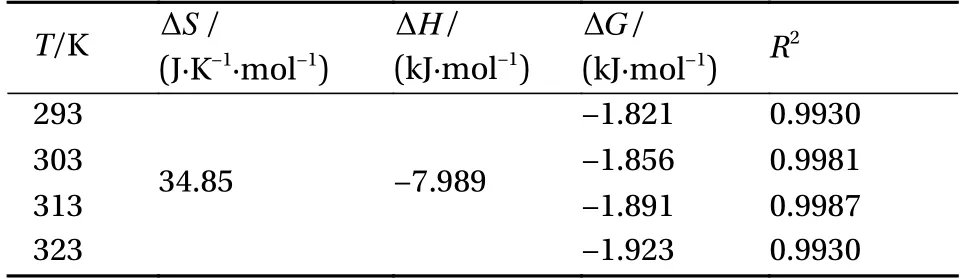
表5 FCH/AO-MWCNTs吸附Mn(II)的热力学模型参数Table 5 Thermodynamic model parameters for the adsorption of Mn(II) by FCH/AO-MWCNTs
2.3.3 等温吸附拟合
使用Langmuir模型、Freundlich模型、D-R模型对FCH/AO-MWCNTs等温吸附数据进行拟合。拟合参数统计结果见表6。
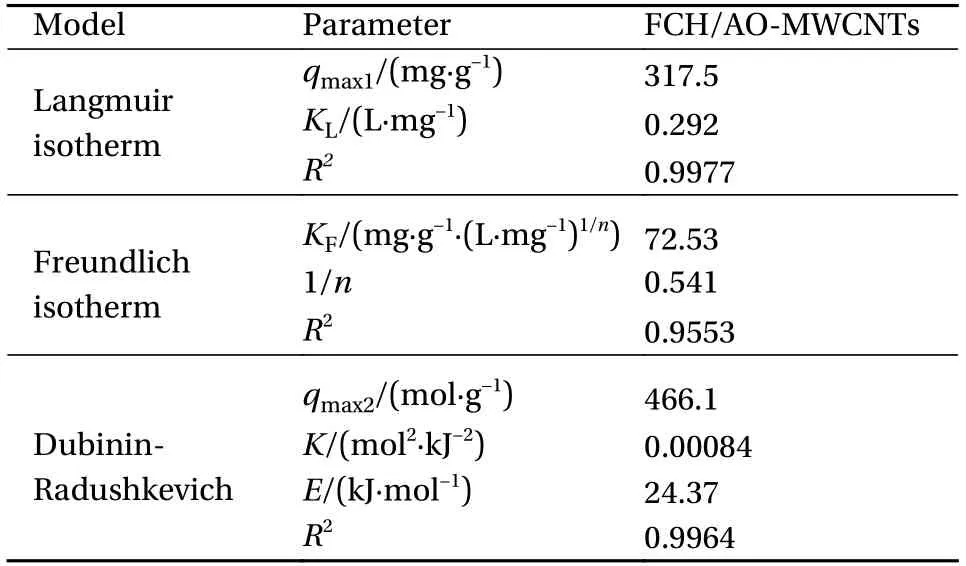
表6 FCH/AO-MWCNTs吸附Mn(II)的等温吸附模型参数Table 6 Isothermal adsorption model parameters for Mn(II) adsorption by FCH/AO-MWCNTs
结果显示Langmuir模型拟合的相关系数为0.9977,略高于Freundlich模型的0.9553。说明单分子吸附是FCH/AO-MWCNTs吸附Mn(II)的主要方式,同时也存在多层吸附,由Langmuir模型计算得到FCH/AO-MWCNTs对Mn(II)的理论最大吸附量qmax1为317.5 mg/g。D-R模型相关系数为0.9964,计算得到吸附反应的平均吸附自由能E=24.37 kJ/mol,说明FCH/AO-MWCNTs对Mn(II)的吸附存在化学作用。
2.3.4 FCH/AO-MWCNTs的竞争吸附
在Mn2+、Pb2+、Cd2+、Cl-、NO3-同时存在的情况下,FCH/AO-MWCNTs对重金属的吸附情况见图12。FCH/AO-MWCNTs复合材料对重金属离子Pb2+、Cd2+、Mn2+的吸附率分别为100%、98.47%、91.23%。加入竞争离子之后材料对Mn2+的吸附率为91.23%,这可能是由于离子半径较大的金属如Pb、Cd与Mn之间存在强烈竞争,在吸附过程中更加容易占据吸附位点。从实验结果发现,新材料对其他重金属离子也有较高的去除率。

图12 多离子共存情况下FCH/AO-MWCNTs的去除效率Fig.12 Removal efficiency of FCH/AO-MWCNTs in case of multiple ion coexistence
2.3.5 FCH/AO-MWCNTs的再生循环
采用0.025 mol/L Ca(NO3)2·4H2O溶液作为FCH/AO-MWCNTs的解吸剂,经过4次循环再生实验后,其对Mn2+的吸附率如图13所示。可知,随着循环次数的增加,复合材料对锰的吸附性能也随之降低,但仍高于50%,再生性能良好。吸附率降低的主要原因推测为,在洗涤过程中不可避免会造成材料质量的减少及复合材料对Mn(II)的化学吸附占主要部分,导致解析过程中Mn2+未被解吸完全而堵塞表面介孔结构和吸附位点,降低材料的吸附能力[37]。
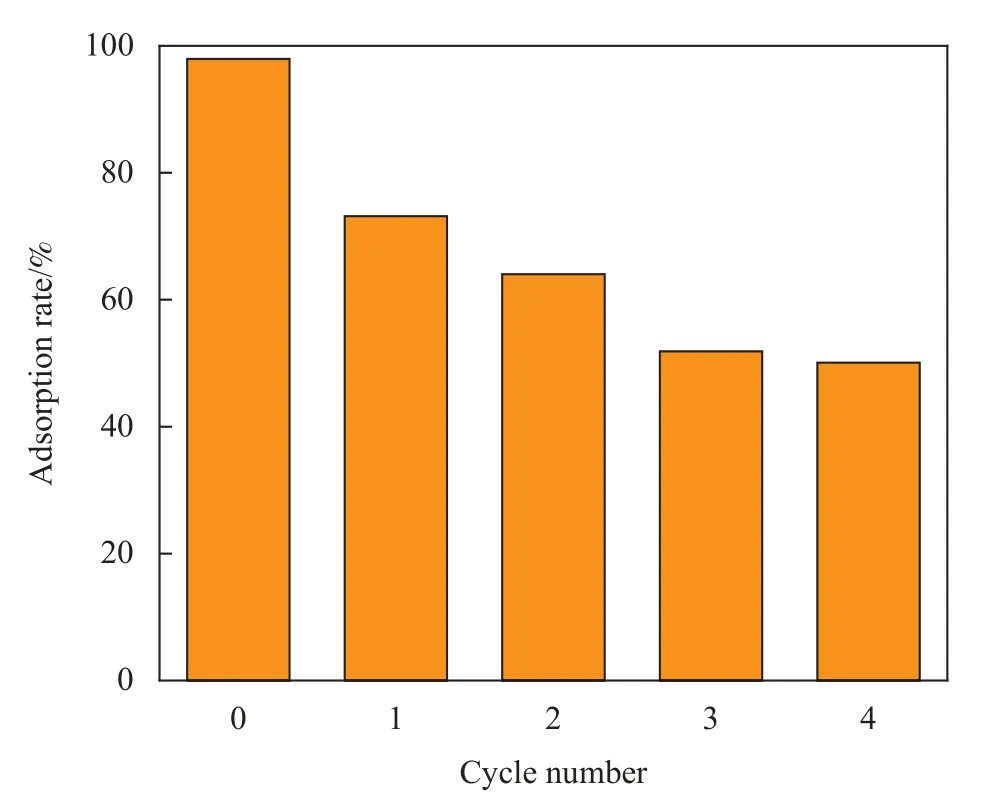
图13 FCH/AO-MWCNTs的再生循环实验Fig.13 Regeneration cycle experiment of FCH/AO-MWCNTs
2.3.6 MWCNTs、AO-MWCNTs、HAP、FCHAP、FCH/AO-MWCNTs吸附性能对比结果
此外,为了进一步对比材料的性能,研究还对中间材料的吸附性能进行了实验及相关讨论。图14为MWCNTs、AO-MWCNTs、HAP、FCHAP、FCH/AO-MWCNTs的吸附实验结果的Langmuir等温吸附拟合;还通过计算得到5种材料的理论最大Mn(II)吸附量及单位面积吸附的金属原子个数,计算结果见表7。从图14和表7中可知,复合得到的新材料FCH/AO-MWCNTs的线性拟合斜率最小,计算得到的理论最大Mn(II)吸附量最高,为317.50 mg/g,单位面积吸附的金属原子个数为60.68个/nm2。同时,将新材料的吸附性能与已报道过的材料进行对比,如表8所示,新材料的吸附性能明显优于其他材料。

图14 MWCNTs、AO-MWCNTs、HAP、FCHAP、FCH/AO-MWCNTs的Langmuir模型拟合Fig.14 Langmuir model fitting for MWCNTs,AO-MWCNTs,HAP,FCHAP,FCH/AO-MWCNTs
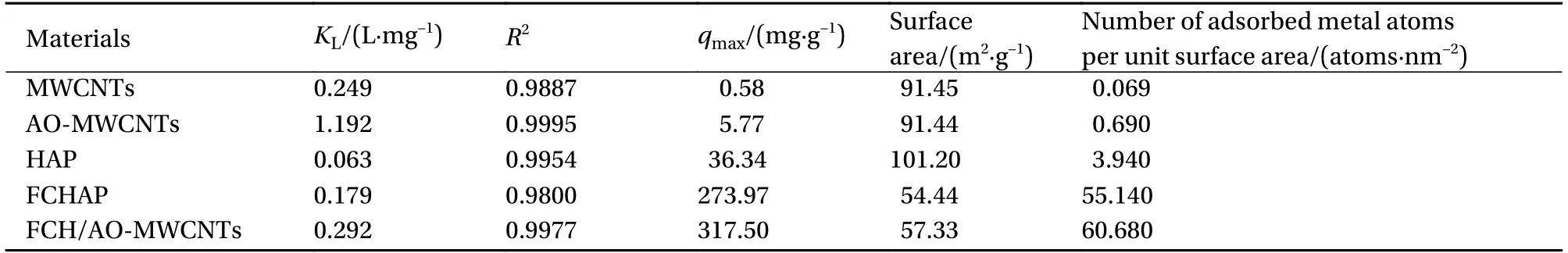
表7 材料的理论最大Mn(II)吸附量计算结果Table 7 Calculation of the theoretical maximum Mn(II) adsorption amount of the material

表8 FCH/AO-MWCNTs与其他材料锰吸附性能对比Table 8 Comparison of Mn(II) adsorption performance of FCH/AO-MWCNTs and other materials
2.3.7 FCH/AO-MWCNTs的吸附机制
AO-MWCNTs是新材料的载体,为FCHAP提供位点,增加吸附接触面,另外,该材料本身的羟基和羧基也具有吸附Mn(II)的特征。其次,氟碳掺杂的羟基磷灰石,由于两种离子的引入,改变了羟基磷灰石的表面结构、表面电荷及结晶度。同时,FCHAP上的丰富离子结构,如Ca2+、OH-、CO32-、PO43-离子,都为溶液中Mn(II)的去除(离子交换、络合、沉淀等)提供了有效途径。
由AO-MWCNTs (0.5wt%)和FCHAP复合而成的新材料FCH/AO-MWCNTs,其表面负电荷含量增加,再结合吸附Mn(II)前后新材料的表征结果,吸附后复合材料的OH-、CO32-、PO43-的吸收峰均有所减弱(图15(a)),表面的Mn峰强度增加Ca峰强度减弱(图15(b))。结合以上研究结果推测,FCH/AO-MWCNTs吸附Mn(II)的过程(图16)主要包括离子交换、表面络合、静电吸附、溶解-沉淀等方式。

图15 吸附Mn(II)前后的FCH/AO-MWCNTs的表征结果:(a) FTIR图谱;(b) XPS全谱Fig.15 Characterization results of FCH/AO-MWCNTs before and after adsorption of Mn(II): (a) FTIR spectra; (b) XPS full spectra
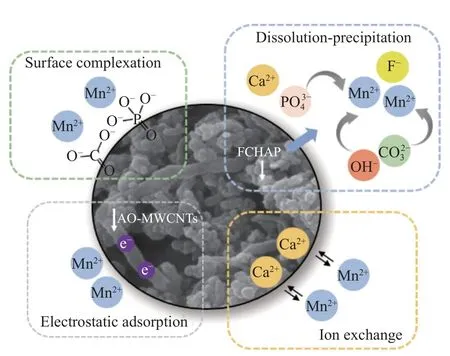
图16 FCH/AO-MWCNTs对Mn(II)的吸附原理图Fig.16 Schematic diagram of adsorption of Mn(II) by FCH/AO-MWCNTs
3 结 论
(1) 氟碳掺杂羟基磷灰石/混酸氧化多壁碳纳米管(FCH/AO-MWCNTs)拥有丰富的孔隙结构,同时稳定性和分散性能大大提升。新材料的活性吸附位点增加,在一定pH范围内材料表面布满负电荷。
(2) 动力学拟合结果说明,吸附过程以单分子层吸附为主,也存在多层吸附;热力学模型表明吸附行为主要受化学过程控制。由Langmuir模型计算得到复合材料对Mn(II)的理论最大吸附量为317.50 mg/g,优于已报道的材料。竞争吸附实验和再生循环实验表明该材料在重金属吸附方面具有广阔的应用前景及再生使用的能力。
(3) FCH/AO-MWCNTs对Mn(II)的吸附机制包括离子交换、表面络合、静电吸附、溶解-沉淀等,其中离子交换和表面络合的化学吸附占主导地位。
