猪细小病毒TaqMan荧光定量PCR检测方法的建立及应用
2024-03-08吴发兴康京丽孙洪涛王志亮许信刚
杨 奕,吴发兴,康京丽,孙洪涛,王志亮,许信刚,张 琪*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.中国动物卫生与流行病学中心,山东青岛 266032)
猪细小病毒(Porcine parvovirus,PPV)是一种单股线状负链DNA病毒。PPV感染可引起母猪不孕、流产、产畸形胎、木乃伊胎甚至死胎等,阻碍了养猪业的发展[1]。在所有的养猪国几乎都发现有PPV,国内各地猪群感染程度各有不同[2]。PPV可感染不同日龄猪,仅成年猪表现繁殖障碍症状,其他日龄猪均为隐性感染,PPV易与其他猪繁殖障碍病混淆,影响了临床诊断[3]。快速准确检测PPV是防控的首要条件[2]。猪细小病毒的检测有许多报道,但如何选择更为合适的靶基因尚无报道[4]。本研究针对猪细小病毒VP2基因的高度保守区域,设计1对特异性引物以及1条特异性探针,并优化反应时间和反应温度,对敏感性、重复性与特异性进行评价。结果表明这种方法更为快速准确,对临床PPV检测及预防有良好的实用价值。
1 材料与方法
1.1 材料
1.1.1 参考病毒株与临床样品 PPV1、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪圆环病毒2型(Porcine circovirus type 2,PCV2) 、伪狂犬病病毒(Pseudorabies virus,PRV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)由中国动物卫生与流行病学中心提供。临床待检样品来自于不同省份的发病猪场。
1.1.2 主要试剂 病毒DNA提取试剂盒、胶回收试剂盒、pGM-T载体试剂盒、质粒快速小提试剂盒,均为天根生化科技有限公司产品;PremixTaq(Ex Taq Version 2.0 plus dye)、ddH2O,均为宝日医生物技术(北京)有限公司产品;2×AccurateTaqMaster Mix、DNA Marker,均为艾科瑞生物工程有限公司产品;感受态细胞DH5α、Premix ExTaq(Probe qPCR),均为北京擎科生物科技有限公司产品。
1.1.3 主要仪器 实时荧光定量PCR仪、96孔热循环PCR仪,西安天隆生物仪器有限公司产品;凝胶成像分析仪,天根生化科技有限公司产品。
1.2 方法
1.2.1 引物及探针设计与合成 按照GenBank库中PPV的标准参考毒株序列(OG155649.1),针对VP2基因的保守区域设计1对特异性引物以及1条特异性TaqMan探针。引物和探针均由北京擎科生物科技合成,用ddH2O稀释引物浓度至20 μmol/L,并置于-20℃冰箱保存备用(表1)。
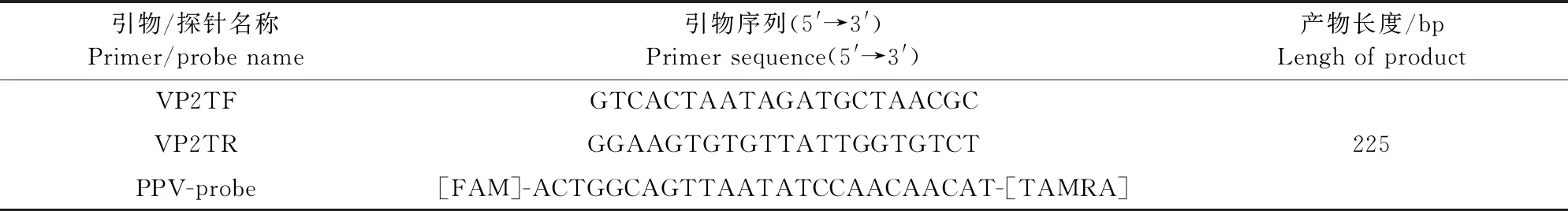
表1 引物及探针序列
1.2.2 重组质粒构建 按照核酸提取试剂盒的步骤提取PPV血清DNA并作为模板,用合成的特异性引物进行PCR扩增,将PCR产物进行凝胶电泳鉴定,用胶回收试剂盒对产物进行回收,将回收产物连接载体pMD18-T,构建重组质粒。对重组质粒进行测序鉴定,鉴定为阳性的质粒作为质粒标准品,测定质粒浓度,计算质粒拷贝数:拷贝数=质粒浓度(ng/μL)×10-9×6.02×1023/(660×质粒总长度)[5]。
1.2.3TaqMan荧光定量PCR反应体系及条件优化 对引物浓度进行优化,从0.1 μmol/L开始,按照0.1 μmol/L逐次增加直至0.8 μmol/L。对探针浓度进行优化,从0.1 μmol/L开始,按照0.1 μmol/L逐次增加直至0.4 μmol/L。对退火温度进行优化,从54℃开始,按照2℃逐次增加直至64℃。在该反应条件下阳性标准品10倍系列稀释(101~109)的质粒作为模板。
1.2.4 标准曲线建立 对以上反应条件进行优化后,即可获得TaqMan荧光定量PCR检测方法的最佳反应条件。将重组质粒标准品按照10倍倍比稀释,从107copies/μL稀释至100copies/μL,依次作为模板,建立PPV的TaqMan荧光定量PCR检测方法的标准曲线。
1.2.5 特异性试验 用优化后的反应条件和反应体系分别对PPV、PEDV、PCV2、PRRSV、PRV的核酸样品进行扩增,评估该方法的特异性。
1.2.6 敏感性试验 将8.76×107~8.76×100copies/μL的标准质粒作为模板,用本研究建立的TaqMan荧光定量PCR方法进行扩增,得到该方法能检出的最低标准品浓度。
1.2.7 重复性试验 分别取107、106、105copies/μL稀释度的质粒标准品作为模板,进行3次批内和批间重复性试验。对所得Ct值的变异系数和平均值进行计算,分析该方法的重复性。
1.2.8 临床样品检测 将临床采集的102份PPV血清样品处理后提取核酸,用本研究所建立的TaqMan荧光定量PCR方法以及普通PCR方法同时进行检测,以评估该方法临床应用效果。
2 结果
2.1 重组质粒构建
将鉴定为阳性的质粒送至北京擎科生物科技有限公司进行测序,通过Blast比对,测序结果显示插入片段与目的片段同源性为100%,表明重组质粒构建成功。计算重组质粒拷贝数为8.76×1010copies/μL。
2.2 TaqMan荧光定量PCR反应体系及条件优化结果
优化后的TaqMan荧光定量PCR反应体系为20 μL,包括Premix ExTaq(Probe qPCR)10 μL、探针0.3 μL(20 μmol/L)、上游和下游引物各0.3 μL(20 μmol/L)、模板1 μL,ddH2O补足到20 μL。反应条件为:95℃ 30 s;95℃ 5 s、58℃ 30 s,40个循环。
2.3 标准曲线建立
将PPV重组质粒用ddH2O 10倍倍比稀释,分别以8.76×107~8.76×100copies/μL为模板进行扩增。结果显示,PPV重组质粒标准品在8.76×107~8.76×100copies/μL时与Ct值呈良好的线性关系,回归方程式为y=-2.327x+40.950,相关系数为0.971。

图2 PPV TaqMan荧光定量PCR检测方法标准曲线
2.4 特异性试验结果
用本研究建立的TaqMan荧光定量PCR检测方法对PPV、CSFV、JEV、PRV、PCV2,PRRSV样品进行检测,同时设置阴性对照(ddH2O)(图3),只有PPV出现特异性扩增曲线。
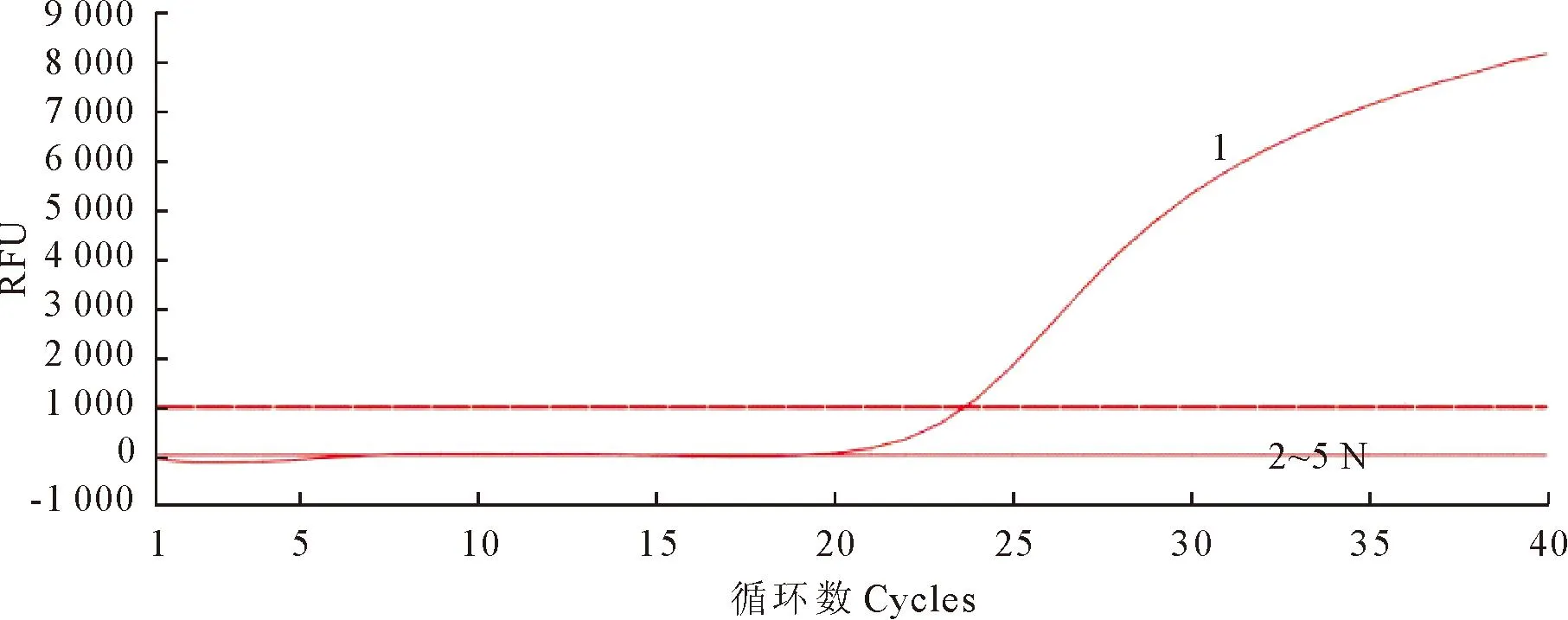
1.PPV扩增曲线;2~5.PEDV、PCV2、PRV、PRRSV扩增曲线;N.阴性对照
2.5 敏感性试验结果
取8.76×107~8.76×100copies/μL的标准质粒作为模板,ddH2O作为阴性照,依照研究所建立的TaqMan荧光定量PCR方法来进行扩增。结果显示,PPV重组质粒标准品最低检测限为8.76×101copies/μL(图4)。而常规PCR对PPV重组质粒标准品最低检测限为8.76×102copies/μL(图5)。表明该方法敏感性较常规PCR高,敏感性良好。

1~8.8.76×107~8.76×100 copies/μL标准模板TaqMan 荧光定量PCR扩增曲线;N.阴性对照

M.DNA标准DL 2 000;1~8.8.76×107~8.76×100 copies/μL标准模板常规PCR扩增
2.6 重复性试验结果
取8.76×106、8.76×105、8.76×104copies/μL浓度的质粒标准品作模板,依照本研究建立的TaqMan荧光定量PCR检测方法进行组内及组间重复性试验,重复3次(表2),组内重复试验变异系数均小于1%,组间重复试验变异系数小于2%。
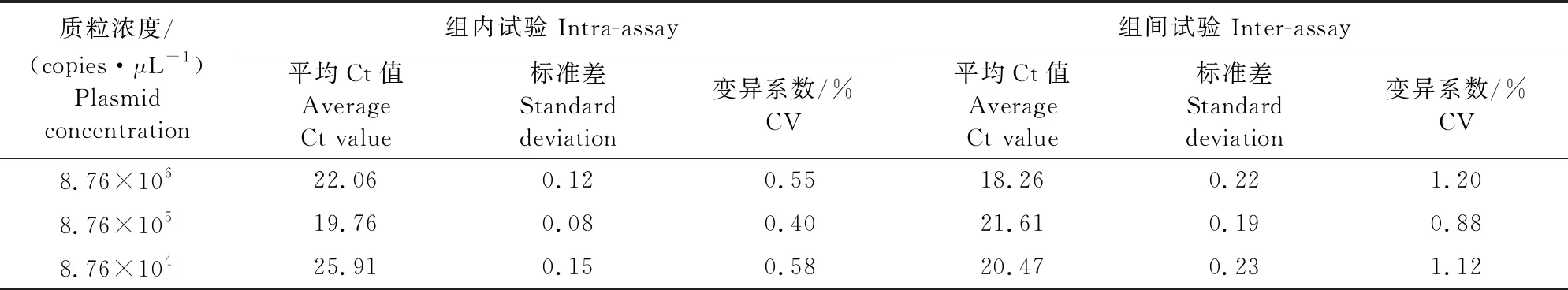
表2 组内与组间重复性试验结果
2.7 临床样品检测结果
用本研究建立的TaqMan荧光定量PCR检测方法和普通PCR方法同时检测102份疑似猪细小病毒猪血清样品,结果显示TaqMan荧光定量 PCR检测方法共检出16份阳性样品,阳性检出率为15.69%(16/102),而普通PCR阳性检出11份阳性样品且包含在TaqMan荧光定量 PCR检测方法所检出来的16份阳性样品中,阳性检出率为10.79%(11/102)。将TaqMan荧光定量 PCR检测方法的阳性样品扩增进行菌液PCR鉴定并测序,结果显示所检出的阳性样本含有PPV。因此该荧光定量PCR方法可用于PPV的检测,并且灵敏度高于普通 PCR检测方法。
3 讨论
PPV感染猪数周后才表现出典型临床症状,且常与其他病毒性疾病混合感染,带毒猪排毒后在猪群中普遍存在有PPV抗体,所以仅凭PPV抗体呈阳性或有疑似猪细小病毒病临床症状,无法判断是否感染PPV。只有精确检测病毒抗原或抗体或核酸才能确定是否存在PPV感染[6]。TaqMan探针是荧光定量PCR探针的一种,与目标片段产生荧光信号,相较于其他荧光定量PCR可通过探针增强检测特异性[7]。
彭泽琴等[8]对临沧地区部分猪场和散养户的190份血清样品进行PPV抗体检测,抗体平均阳性率为66.32%;陈文贤等[9]用乳胶凝集试验对甘肃11个种猪场的150份血清样本进行PPV检测,阳性率为16%;孙泉云等[10]对上海某养猪场2015-2017年的129份种猪扁桃体样本进行检测,检出阳性样本110份,阳性率为8.74%;唐小明等[11]对湖南5个原种猪场的血清以及对应扁桃体样品各1 000份进行抗体检测,样本阳性率为28.9%。张振仓等[12]从陕西省11个规模化养猪场采集仔猪血样320份,应用PCR方法对样本中的PPV进行检测,样本阳性率为3.64%,且为混合感染。PPV在不同地区或用不同检测方法的检出率存在差异,样本批次不同或检测方法的敏感性不同都可能导致这种差异,且抗体检出率明显高于抗原检出率,可能由于受到野毒感染或接种PPV疫苗致使猪群体内抗体水平上升。
本研究基于PPVVP2基因建立了PPVTaqMan荧光定量PCR检测方法,该方法特异性强,用于检测实验室猪常见病原如PEDV、PRRSV、PRV、PCV2等结果均呈阴性;重复性高,批间与批内变异系数均小于2%;灵敏度高,对阳性标准质粒检测下限为87.6 copies/μL,完全可以用于临床样本检测。
