微管结合蛋白tau互作蛋白的筛选
2024-03-07王雄雄张圣权孙静毛传樨
王雄雄,张圣权,孙静,毛传樨
(湖北大学生命科学学院, 湖北 武汉 430062)
0 引言
微管是一种具有极性的细胞骨架,由α,β蛋白亚基组成的微管蛋白二聚体,微管蛋白二聚体头尾相接形成微管原纤维,由13根这样的原纤维纵向排列形成微管的壁。并且微管参与细胞分裂、细胞运动、胞内运输、分泌、形态构成、组织器官发育等多种重要的生物学过程[1]。在微管的动态调节过程中,有两类蛋白参与其调节过程[2]。一类是微管结合蛋白(microtubule associated protein, MAP)(如tau、MAP1和MAP4)和微管末端协助微管聚合的因子(如EB1和CLIP170)等;另一类是参与微管剪切的蛋白,包括Spastin、Katanin、Fidgetin等。
Tau作为重要的微管结合蛋白,促进微管的稳定,主要在中枢和周围神经系统中表达,并富集于神经元轴突中[3]。Tau蛋白在结构上可以分为4个区域:N端投射区、脯氨酸富集区、微管结合结构域、C端域。Tau对于微管的稳定性就是通过微管结合结构域来实现的,对于神经元的发育和轴突的正常运输发挥着重要作用[4-5]。
早在20世纪80年代就有研究报道,不可溶和过度磷酸化的tau是神经纤维缠结的主要成分,是阿尔兹海默症的病理特征之一[6-9]。体外生化研究表明,过度磷酸化的tau不与微管结合,导致微管稳定性降低[10-11]。此外,tau突变导致17号染色体相关的帕金森综合征的额颞叶痴呆中,其中一些突变已经被报道降低微管和tau结合亲和力[12-13],强调了tau的正常微管稳定性动能丧失在神经退行性tau蛋白病的发病机制中的重要性。除了阿尔兹海默症外,还有一些退行性疾病有tau的包涵体,这类tau相关的疾病统称为Tauopathies[14], 如额颞叶变性症、嗜银颗粒病、肌萎缩性脊髓侧索硬化症和慢性创伤性脑病等[15-17]。由于tau与很多神经退行性疾病相关,研究tau的致病机制为治疗相关的神经退行性疾病提供重要依据。
之前的报道显示,在GMR-Gal4驱动下人的野生型tau(UAS-tau0N4R)表达可导致粗糙眼(rough eye)表型[18-20]。本研究通过该模型筛选微管异常的RNAi表达品系[21],并进一步通过成虫盘凋亡细胞和行为学实验验证,寻找与tau共同调控视神经发育的基因,进而找到直接或间接与tau互作的蛋白。从而能够为治疗阿尔兹海默症等和tau相关的神经退行性疾病提供潜在的药物靶点。
1 材料和方法
1.1 果蝇品系
见表1。

表1 实验所用果蝇品系
1.2 实验所用仪器

表2 实验所用仪器
1.3 实验所用抗体
见表3。

表3 实验所用抗体
1.4 实验所用试剂
实验所用试剂见表4。试剂配方分别见表5~7。

表4 实验所用试剂

表5 解剖液HL 3.1

表6 4%多聚甲醛固定液(PFA)

表7 1×PBS缓冲液
1.5 实验方法
1.5.1 果蝇粗糙眼观察
将羽化后的果蝇成虫在25 ℃,12 h光照:12 h黑暗的培养箱中饲养3 d,之后在-20 ℃冰箱分别将雌雄果蝇麻醉10 min,使用LEICA M205C显微镜观察并拍摄果蝇眼睛。
1.5.2 果蝇幼虫解剖
1)用实验室公用镊子从果蝇管中取出幼虫(长镊子方便取出幼虫,解剖的短镊子难以伸到管底),用解剖液洗去附着在幼虫身体上的培养基,并将幼虫放置在纸巾上蘸干。
2)将幼虫放到树脂解剖盘上,用解剖针分别固定幼虫的头部和尾部,然后调整针的位置,避免幼虫拉太长,后续伸展不开。
1.4 统计学方法 采用SPSS 13.0统计学软件进行数据分析,计量资料以表示,治疗前后自身对照均数比较采用配对t检验,2组间均数比较采用独立样本t检验,检验水平α=0.05。
3)用移液枪吸取解剖液,加入到幼虫表面,使其完全浸没。用解剖剪刀在幼虫尾部剪开一个口子,然后用解剖剪刀沿着中线剪至头部。
4)用镊子轻轻挑去幼虫的内脏,注意不要碰到eye disc,以免破坏组织完整性。
5)用4根解剖针分别固定头尾两边的位置,使幼虫平铺开,呈现出片状。
1.5.3 eye disc免疫染色
1)在解剖好的幼虫(保存完整的eye disc)中加入4% PFA固定液覆盖表面,室温固定40 min。
2)固定完后,吸去固定液,取下幼虫放入2 mL EP管中,加入0.2%的PBST溶液(1×PBS+0.2% TritonX-100),然后将样品放在侧摆洗脱固定液1 h,每10~15 min换一次EP中PBST溶液。
3)洗完固定液后,吸去EP管中的PBST溶液,加入200 μL 0.2% PBST+5% 山羊血清,在侧摆摇床上室温封闭40 min;封闭完后加入1∶200 Dcp1和1∶100 elav抗体(用0.2% PBST溶液配制 抗体),将样品放入4 ℃冰箱的侧摆中,对样品进行低温孵育过夜。
4)待一抗孵育完成后,吸去抗体,将样品放入室温摇床下,用0.2% PBST溶液洗脱,在此期间洗脱1 h,每10~15 min换一次EP管中PBST溶液;洗完抗体后,吸去抗体,加入1∶800 Goat anti rabbit 555和1∶800 Goat anti mouse 488二抗(用0.2% PBST溶液配制 二抗),将样品放入4 ℃冰箱的侧摆中,对样品进行低温孵育过夜;并做避光处理。
5)待二抗孵育完成后,吸去二抗,将样品放入室温摇床下,用0.2% PBST溶液洗脱二抗,在此期间洗脱1 h,每10~15 min换一次EP管中PBST溶液。
6)二抗洗脱完后,取出幼虫,用镊子小心地将解剖好幼虫上的eye disc取出,然后放在载玻片,摆放完成后,用纸巾吸去残留在组织的PBST,小心在组织旁边滴一滴封片油,轻轻地盖上盖玻片,避免有气泡影响后续的观察,并在盖玻片周围涂上指甲油,避免盖玻片滑动破坏组织,封片完后写上对应的基因型,放入4 ℃冰箱保存,后续用共聚焦显微镜拍摄。
1.5.4 果蝇的睡眠监测
本实验所用的睡眠监测采用的是pySolo v2.0系统[22]。pySolo系统的工作原理是采用高分辨摄像头来记录每分钟果蝇的移动距离,以此来判定果蝇是否处于睡眠状态。系统中,我们定义果蝇在静止超过5 min时判定为睡眠状态,系统每次采样16只雄果蝇,pySolo系统的优势就在于其高效、准确、灵敏,能准确反映果蝇每分钟的活动状态。
1.5.5 果蝇eye disc凋亡细胞平均荧光面积比的统计
本实验利用ImageJ进行荧光定量分析,统计elav抗体标记区域内的凋亡信号(death caspase-1,Dcp1)分布面积,并用对照组对所有组别进行标准化。同时,通过t检验比较实验组与对照组之间的差异。
2 结果
2.1 以rough eye系统为模型进行微管互作蛋白的筛选
我们在早期的实验中使用C57-Gal4(在肌肉中特异性表达的Gal4)与清华大学果蝇库中的541株RNAi基因进行杂交,最终筛选出了45株有表型的RNAi[21]。在果蝇视网膜中表达人的野生型tau会导致中度的粗糙眼表型,其特征是果蝇单眼阵列的紊乱和眼睛大小的减小[23]。Tau诱导的粗糙眼表型是筛选可能增强或抑制tau蛋白的相关互作蛋白和和药理学试剂的优良系统[24]。有研究利用该模型筛选出了可能与tau互作的候选基因,其中与细胞骨架相关的包括微丝结合蛋白和沿微管运输的马达蛋白[24-26]。我们在GMR-Gal4驱动下表达人的野生型tau(UAS-tau0N4R)可导致rough eye表型,与之前的报道一致[18-20]。为了筛选出与tau蛋白相互作用的蛋白,我们在高表达tau0N4R的背景下表达之前筛选出的45株具有表型的RNAi。在进一步的筛选中,我们筛选出了6株RNAi,这些RNAi能够在雌性和雄性果蝇的粗糙眼表型中增强,相关基因分别是CG32068、CG9886、CG5588、CG3298、CG7834、CG18001,如图1所示。筛选出雌性和雄性都粗糙眼表型减弱的5株RNAi,相关基因分别是CG33102、CG16827、CG8171、CG3697、CG3325,如图2所示。说明CG32068、CG9886、CG5588、CG3298、CG7834、CG18001这些RNAi可能诱导tau毒性,导致感光神经元丧失增多,粗糙眼表型增强,而CG33102、CG16827、CG8171、CG3697、CG3325则相反。

图1 6个基因在tau高表达背景下敲降后果蝇粗糙眼表型增强敲降后果蝇粗糙眼增强。从图中可以看出,敲降CG32068、CG9886、CG5588、CG3298、CG7834、CG18001后粗糙眼表型增强。图中对照组基因型为GMR-Gal4/+;UAS-tau0N4R/+,实验组为GMR-Gal4/CyO;UAS-tau0N4R背景下敲降基因

图2 5个基因在tau高表达背景下敲降后果蝇粗糙眼表型减弱敲降后果蝇粗糙眼减弱。从图中可以看出,敲降CG33102、CG16827、CG8171、CG3697、CG3325后粗糙眼表型减弱。图中对照组基因型为GMR-Gal4/+;UAS-tau0N4R/+,实验组为GMR-Gal4/CyO;UAS-tau0N4R背景下敲降基因
2.2 敲降后影响eye disc的凋亡
发育中的果蝇眼组织,即果蝇眼睛成虫盘,是研究不同细胞凋亡反应的理想系统,因为每种细胞类型的命运是已知的,并且已有丰富的细胞标记来跟踪它们[27]。在早期幼虫阶段,眼睛成虫盘中的细胞不断增殖,以产生眼睛所需的细胞团[27]。为了验证粗糙眼的表型是否会体现在eye disc凋亡,我们在UAS-tau0N4R背景下使用GMR-Gal4和rough eye表型增强的RNAi果蝇杂交,通过果蝇凋亡信号通路中的效应caspase(Dcp1)的免疫荧光染色来检测神经元凋亡的程度。以elav标记的神经元区域为范围(图3A),统计Dcp1信号覆盖面积(图3B和3C)。结果显示,敲降CG32068、CG3298、CG7834,凋亡细胞数量增加,而敲降CG9886、CG5588、CG18001凋亡细胞数量无变化。而在另外rough eye表型减弱的RNAi中,发现敲降CG16827、CG8171凋亡细胞数量增加,敲降CG3697凋亡细胞数量减少,而敲降CG33102、CG3325凋亡细胞数量无变化。以上结果说明CG32068、CG3298、CG7834、CG16827、CG8171和CG3697可能与tau有互作。
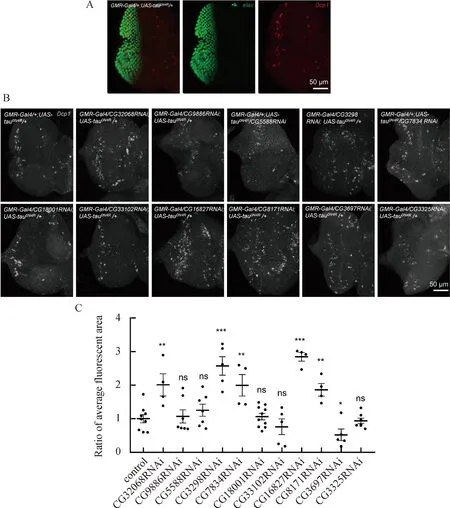
图3 敲降后果蝇eye disc凋亡细胞染色和平均荧光面积比A)对照组果蝇的eye disc免疫染色。elav标记所有神经元,用红色表示;Dcp1标记凋亡细胞,用绿色表示。B)敲降后果蝇eye disc凋亡细胞数量呈现增加或无变化的免疫染色图。由图可以看出,敲降CG32068、CG3298、CG7834 、CG16827、CG8171凋亡细胞数量增加,敲降CG9886、CG5588、CG18001、CG33102、CG3325无变化,而敲降CG3697凋亡细胞数量减少。图中凋亡细胞是用抗体Dcp1标记。C)敲降后果蝇eye disc凋亡细胞平均荧光面积比的统计,以elav为范围统计该区域的平均荧光面积,并利用t检验比较实验组与对照组之间的差异。图中对照组基因型为GMR-Gal4/+;UAS-tau0N4R/+,实验组为GMR-Gal4/CyO;UAS-tau0N4R背景下敲降基因
2.3 敲降后对昼夜睡眠节律的影响
昼夜振荡在细胞水平上由生物钟表示,生物钟是由环境光形成的分子程序-关键时钟蛋白对光敏感,因此在光振荡条件下,它们的水平有节奏地上升和下降[28]。由于具有粗糙眼表型增强的RNAi果蝇可能会导致感光神经元丧失增加,因此它们的光敏感性可能会受到影响,从而进一步影响其昼夜节律。本实验在25 ℃ 12 h光照:12 h黑暗条件下,利用睡眠监测系统pySolo v2.0系统,对敲降CG32068、CG9886、CG5588、CG3298、CG7834、CG18001成虫果蝇进行了昼夜睡眠监测,在监测4日后,将监测数据导入高通量数据分析软件RStudio对果蝇的活动及睡眠进行分析,分析结果如图4所示。从果蝇睡眠曲线图可以看出,与对照相比,在关灯后,敲降CG32068,果蝇对于光线改变不敏感,而敲降CG9886、CG5588、CG3298、CG7834、CG18001无明显变化。综合以上结果,说明CG32068RNAi可能与tau互作,导致粗糙眼表型增强和eye disc凋亡细胞增加,从而导致感光神经元丧失和眼睛发育缺陷,进而导致对光线改变不敏感,影响果蝇的昼夜节律。
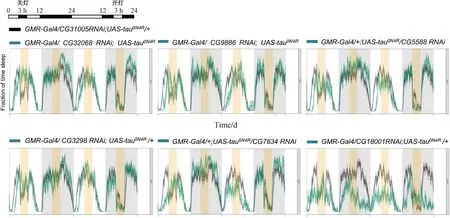
图4 睡眠监测模式和敲降后睡眠监测图在25 ℃ LD条件下,果蝇适应2天,在第3天12 L关灯3 h, 以及在第4天的12 D开灯3 h, 观察突然关灯或开灯,果蝇对光是否敏感。与对照相比,在关灯后,敲降CG32068后,果蝇对于光线改变不敏感,果蝇没有被唤醒,而敲降CG9886、CG5588、CG3298、CG7834、CG18001明显变化。图中对照组基因型为GMR-Gal4/ CG31005RNAi;UAS-tau0N4R/+,实验组为GMR-Gal4/CyO;UAS-tau0N4R背景下敲降基因
3 讨论
据研究显示,粗糙眼表型增强会引发感光神经元的丧失[29]。在本次实验中,筛选出的11株具有粗糙眼表型增强或减弱的RNAi果蝇,可能是由于对这些基因进行敲降导致感光神经元数量的增加或减少引起的。
在果蝇的早期幼虫阶段,眼睛成虫盘中的细胞持续增殖,以形成眼睛所需的细胞集合[27]。在本实验中,筛选出5株 RNAi果蝇表现出凋亡细胞数量的增加,1株RNAi凋亡细胞数量减少,这可能是由于对这些基因进行敲降导致细胞增殖受限或促进所引起。
通过本实验的筛选,发现候选基因CG32068在果蝇的成虫盘细胞凋亡、粗糙眼表型及行为学方面表现出结构和功能的一致性。进一步查阅相关文献发现,该基因参与了果蝇甲硫氨酸挽救途径[30]。接下来我们计划进行以下实验工作:首先,通过对果蝇喂食甲硫氨酸的实验来验证其是否可以挽救粗糙眼和凋亡等表型,并购买其他的工具果蝇来验证前期得出的实验结果。其次,在C57-Gal4/CyO;UAS-tauV337 M背景下敲降该基因,观察微管表型和进行蛋白印迹实验,以检测该基因与微管结合蛋白tau之间的互作情况。后续的计划正在进行中,需要进一步深入研究该候选基因在果蝇发育过程中的其他作用及其调节机制。
