免疫组化技术在肿瘤病理诊断中的应用价值
2024-03-07席芳
席芳
(济源市妇幼保健院 病理科,河南 济源 459000 )
肿瘤呈占位性块状突起,也称为赘生物,发病率逐年升高,通常早期没有明显临床表现,患者在确诊时已处于中晚期,错过了最佳治疗时机。现阶段,临床诊断肿瘤多采用X 线、CT、磁共振成像(MRI)等影像学技术进行诊断,具有操作简单、价格低廉等优势,但存在较高的误诊、漏诊率。病理检查是诊断肿瘤的一种重要方法,可确定其组织来源、范围及性质,决定下步治疗方案及预后。病理检查包括常规技术及免疫组化技术等,而不同检查技术诊断结果不同[1-3]。本文研究免疫组化技术对肿瘤病理诊断中的诊断意义。
1 资料与方法
1.1 一般资料
选取2020 年6 月至2022 年6 月济源市妇幼保健院收治的100 例疑似肿瘤患者进行前瞻性研究。纳入标准:经影像学检查疑似肿瘤;临床资料完整;治疗依从性好,可配合诊疗。排除标准:合并心、肺、肝、肾等严重脏器疾病;合并血液系统疾病或凝血功能障碍;合并影响病理检查的相关疾病;意识不清,无法配合;拒绝参与或中途退出。其中男56 例,女44 例;年龄42~79 岁,平均(59.67±3.25)岁;病程1~12 个月,平均(6.21±1.34)个月;体重指数18.21~24.64 kg/m2,平均(21.23±0.41)kg/m2。
1.2 方法
所有患者均病理检查根据病灶大小、类型及位置实施穿刺活检,取样本。
常规技术:在活检过程中,需在超声条件下取出肿瘤组织,制备切片、苏木精-伊红染色,与标准组织进行对比,观察组织结构和细胞形态。
免疫组化技术:将准备好的样本切片依次放到染色架上,置于200 mL,2%的APES-丙酮溶液中1 min,立即放入烘箱中60 ℃,15 min,避免脱片,从烘箱中取出后依次进行如下步骤:脱蜡水化、过氧化氢(H2O2)封闭内源性过氧化物酶、高压抗原修复、10%非免疫山羊血清(封闭液)封闭、利用1%酪蛋白稀释后的液体进行一/二/三抗孵化、DAB 染色、苏木素染色、脱水、中性树胶封片,最后选取合适的视野进行拍照。
1.3 观察指标
以手术病理结果为金标准,比较两种技术诊断效能。敏感性=真阳性/(真阳性+假阴性)×100%;特异性=真阴性/(真阴性+假阳性)×100%;准确性=(真阳性+真阴性)/总例数×100%。
1.4 统计学方法
数据录入Excel,利用SPSS 22.0 软件进行统计学分析。计数资料以百分率(%)表示,用χ2检验;计量资料以均数±标准差()表示,用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 手术病理结果
100 例疑似患者中,72 例确诊为肿瘤,包括肺癌16 例,胃癌32 例,肝癌24 例。
2.2 两种技术诊断结果
100 例疑似患者中,常规技术检查出64 例肿瘤,误诊8 例,漏诊16 例;免疫组化技术检查出71 例,误诊1 例,漏诊2 例。见表1。

表1 常规技术、免疫组化技术的诊断结果(例)
2.3 常规技术、免疫组化技术的诊断效能比较
免疫组化技术检查的敏感性、特异性及准确性高于常规技术,差异有统计学意义(P<0.05)。见表2。
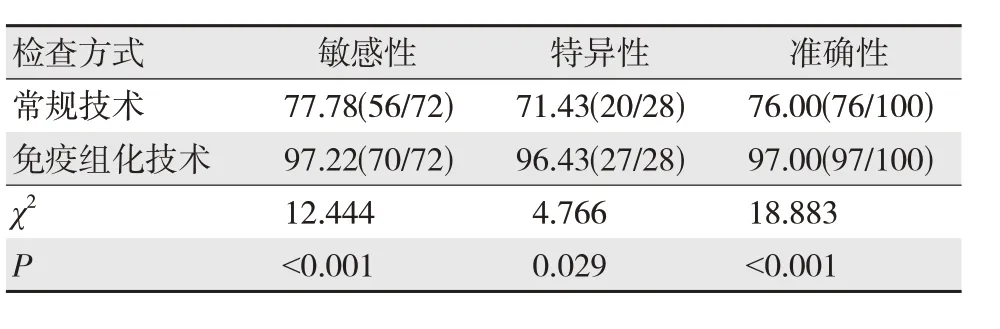
表2 常规技术、免疫组化技术的诊断效能比较 %
3 讨论
肿瘤在临床上可分为良、恶性肿瘤,良性病情较轻,但随着病情的进展,可转变为恶性,威胁患者生命安全。多数恶性肿瘤患者确诊时已为晚期,具有较高的死亡率,因此需增加诊断精准度,及时诊断疾病进展,延长患者生存时间。病理检查是检查机体器官、组织或细胞中的病理改变的病理形态学方法,以探讨器官、组织或细胞所发生的疾病过程,做出病理诊断,包括脱落细胞学、活体组织检查,其中活体组织检查是从身体病变部位取小块组织或手术切除标本制成病理切片,观察细胞、组织形态结构变化,确定病变性质,已成为肿瘤诊断较为常用且准确的方法,但灰尘、试剂污染及染色失效等因素会影响诊断准确率。免疫组化技术是利用抗原抗体特异性结合反应检测组织中的未知抗原或抗体,借以判断肿瘤的来源或分化程度,协助肿瘤及鉴别诊断[4-6]。
免疫组化技术是一种辅助检查方式,在进行病理诊断的过程中,通常需要选择20 多种抗体,以满足相应的诊断需求,选择抗体时需以节约成本为基础,根据实际需求来选择[7-9]。该技术具备以下优势:①免疫组化技术中可依据实际需要来选择合适的抗体(不同的肿瘤类型确定抗体种类),从而利用抗体进行鉴别诊断;②免疫组化技术中抗体的特异性可随着免疫组化使用范围的增大而增大;③免疫组化技术可依据肿瘤切片样本抗原数量在肿瘤分状态来对抗原抗体实施定量定性及定位研究工作;④在进行免疫组化技术病理诊断时,标本通常为组织标本,切片主要采用石蜡切片法,这种方法能够最大程度的保存组织样本的形态,延长样本保存时间,更好的帮助医生观察样本染色情况[10-12]。国内外有很多学者[13-15]将免疫组化应用于肺癌、乳腺癌、子宫内膜癌等恶性肿瘤的诊断中,均证实具有较好的诊断价值。本研究以疑似肿瘤患者为研究对象,以手术病理结果为金标准,常规技术为对照,分析免疫组化技术的诊断价值。
本结果显示,与免疫组化技术检查的敏感性、特异性及准确性均更高于常规技术,这一结果与文献报道相似[16]。笔者认为:常规技术可判定肿瘤细胞的形态、组织学和细胞学特征,准确性高,检查方便快捷,副作用小,但只可作为初步诊断,故而不可将其作为首选方案;而免疫组化技术可对抗原进行定量、定性、定位,观察抗原在组织中的分布情况,具有定位准确、定性灵敏度高的特点,可通过标记抗体显色确定组织细胞内抗原进行诊断,从而用来确定细胞来源及分化程度,是形态学的补充,却不能代替形态学检查。且在免疫组化技术中,脱蜡与水化可确保抗体能够充分与组织中抗原结合发生反应;封闭内源性过氧化物酶可降低内源性过氧化物酶活性;需要注意的是石蜡切片过程中需要使用甲醛溶液,其可使组织中部分抗原发生蛋白间的交联及醛基的封闭作用,致使抗原失去抗原性,故需对组织进行修复,确保了诊断的准确性;组织切片上部分剩余位点可非特异性结合抗体,造成假阳性的结果,因此需进行血清封闭;因抗原抗体形成的复合物本身没有颜色,无法直接观察,因此需借助染色,使复合物显色,便于显微镜下观察。为了提高免疫组化技术的诊断准确率,降低误诊、漏诊情况,需做好以下几点:①固定液是10%的中性缓冲甲醛固定液,具有固定时间长、不易脱落的优点;在使用烘箱时,温度设置为60℃,可避免温度过高破坏组织结构,影响诊断效果;高压锅进行抗原修复时,其修复时间为10 min,切片自然冷却后,应用了苏木精染色,可避免颜色过浓,影响诊断结果;孵育时需先将封闭液甩去,以避免封闭液体流入组织,从而确保抗体液体均匀,降低假阴性率[17-19]。②组织染色时切片需保持湿润状态,如玻片上的组织干化,需重新补充水分并在染色过程中保持组织被覆盖在缓冲液中,避免出现染色弱或无染色的情况。③在进行免疫组化诊断过程中如缺乏光镜,就需要通过HE 切片对肿瘤组织进行深入观察、明确诊断,就有可能出现误诊的情况,因此对于免疫组化阳性结果的标本,需要以细胞形态学作为认知基础,但不可将其来替代病理学家的临床经验;④在染色时如存在不均衡的背景染色,这可能意味着脱蜡不正常,此时需要使用新鲜的二甲苯并延长脱蜡时间。⑤洗涤不充分(固定剂残留)导致高背景值,因此需确保在步骤间用PBS 至少洗3 次;固定不充分,可能导致抗原在组织中扩散,出现高背景值的现象,需降低固定后时间;检测试剂的渗透不充分而导致的高背景值,可制备更薄的切片;固定剂的差异可影响组织抗原,因此在使用时需优化pH、孵育时间及温度。
综上所述,免疫组化技术在肿瘤病理诊断中,具有较高的诊断价值,但需结合形态学检查,以更好的明确诊断,为治疗提供指导,便于改善预后。
