基于形态学和宏基因组学的养殖蟹塘浮游植物群落分析
2024-03-06崔娜欣邹国燕赵志勇黄伟伟张亚雷
张 旭 ,周 丽,蔡 敏,崔娜欣,邹国燕,赵志勇,袁 泉,黄伟伟,张亚雷
1. 上海市农业科学院生态环境保护研究所/上海低碳农业工程技术研究中心,上海 201403
2. 同济大学环境科学与工程学院/污染控制与资源化研究国家重点实验室,上海 200092
3. 上海市农业科学院农产品质量标准与检测技术研究所,上海 201403
中华绒螯蟹 (Eriocheirsinensis) 俗称河蟹,是我国重要的淡水名特优养殖对象,目前池塘养殖是我国中华绒螯蟹的主要养殖模式[1]。养殖池塘作为一个相对封闭的生态系统,浮游植物的群落结构及演替规律在水产养殖中具有重要作用。浮游植物不仅可作为养殖产品的天然饵料,对水质控制也有重要作用,进而影响水产养殖的生产力[2]。因此,研究养殖期间浮游植物群落的时空变化规律可为养殖过程中的水质管理提供重要参考。
目前常用的浮游植物分类和鉴定技术主要有基于细胞形态的鉴定 (如:显微镜技术)、基于特征性化学物质的鉴定 (如:高效液相色谱法) 和基于分子生物学技术的鉴定 (如:特异性探针)[3]。现针对水产养殖水体中浮游植物群落结构的分析大多采用基于细胞形态的人工镜检方法[4-6]。传统的浮游植物群落结构分析方法的局限性在于受人工经验的影响较大,对研究者的鉴定技术水平有较高要求;而且人工镜检对一些形态相似、细胞较小或丰度较低的类群难以识别和鉴定[7]。近年来,随着分子生物学技术的快速发展和应用,国内外学者越来越多地利用高通量测序技术研究环境中存在的各种微生物,尤其是宏基因组学技术,其研究对象为特定环境中的总DNA,检测速度快、检出限低,可极大地拓展对水产养殖水体中浮游植物的鉴定和认识[8]。目前针对水产养殖水体,已有部分研究利用高通量测序技术研究养殖环境中的细菌多样性[9-10],而有关高通量测序技术应用于水产养殖水体中浮游植物群落结构特征及演替规律的研究还较少[11-12]。
本研究利用基于形态学的人工镜检方法和基于高通量测序技术的宏基因组组学方法,共同调查2022 年6—10 月中华绒螯蟹养殖池塘中水体浮游植物群落的组成及多样性,比较分析两种方法所得结果的差异,探讨浮游植物群落结构特征与环境因子的关系;以期为更全面、准确地研究养殖蟹塘浮游植物群落结构及其演替规律提供理论依据。
1 材料与方法
1.1 采样地点与养殖情况
采样地点位于上海市崇明区某中华绒螯蟹养殖基地 (121°24'E, 31°74'N),蟹塘长140 m、宽85 m,总面积1.19 hm2,回水通道2.8 m,水深0.7~1.0 m,底泥厚度30 cm。池塘内种植伊乐藻 (Elodeanuttallii)和苦草 (Vallisnerianatans),覆盖面积约70%。池塘内配备1 台5 kW 曝气机,每天曝气6 h;配备8 台3 kW 推流机,在夏季高温期 (8 月) 同时开启3 台,每天运行3~4 h,保证充足的溶解氧(DO)。2022 年3 月10 日放苗,放养密度为1.5万只·hm−2。4—6 月,每天投喂饵料7.5~15 kg·hm−2,6—10 月,每天投喂饵料30~45 kg·hm−2。养殖期结束时,蟹产量为1 200 kg·hm−2,成活率约50%。
1.2 样品采集与测定
2022 年6—10 月逐月采集养殖池塘的水样及浮游植物样品。池塘沿对角线设置3 个采样点,用5 L 有机玻璃采水器采集水面以下0.5 m 处各点水样及浮游植物样品。pH、水温 (Water temperature, WT)、DO 等指标通过多参数水质分析仪 (哈希,HQ 4300) 现场测定;叶绿素a(Chl-a)、总磷(TP)、磷酸盐 (PO4)、总氮 (TN)、氨氮 (NH3-N)、亚硝态氮 (NO2-N)、硝态氮 (NO3-N)、高锰酸盐指数 (IMn)、五日生化需要量 (BOD5) 测定方法均参考《水和废水监测分析方法》(第四版)[13]。现场取1 L 水样加入15 mL 鲁哥氏液和10 mL 40% (φ)的甲醛溶液固定,带回实验室静置48 h 后浓缩至50 mL,然后用光学显微镜进行物种鉴定和计数。浮游植物取样及计数具体方法参考中国环境监测总站发布的《水生态监测计数要求 淡水浮游植物》(试行),浮游植物种类鉴定参考《水生生物学》(第二版)[14]。
3 个取样点各取200 mL 水样后经0.22 μm 滤膜抽滤,过滤后的滤膜用液氮冷冻后放置于−80 ℃冰箱保存,样品最终送往上海美吉生物医药科技有限公司进行宏基因组测序。具体方法如下:抽提滤膜上截留物的DNA,并对其进行质量检测评估。DNA 样本检测合格后,将其随机片段化并筛选合适大小的插入片段进行文库构建。构建好的文库质检合格并精确定量后,上机进行Illumina NovaSeq 6000 宏基因组测序。
1.3 数据处理
1.3.1 浮游植物密度及生物量分析
浮游植物密度、生物量参照《水生生物学》(第二版)[14]中的浓缩计算法以及浮游植物细胞平均湿质量结合密度计算得到。
1.3.2 浮游植物优势种及多样性指数
针对人工观察计数浮游植物多样性参数的计算公式为[15]:
式中:ni为第i个种的数量;N为浮游植物总数量;fi为第i个种出现的频率;S为浮游植物总种数。将Y≥0.02 的浮游植物定义为优势种。
1.3.3 理化指标及人工镜检数据分析
通过SPSS 20.0 软件的单因素方差分析 (Oneway ANOVA) 对池塘水质理化指标进行分析,不同因素间的多重比较采用Duncan 检验,结果以“平均值±标准差”表示,显著性水平P=0.05;人工镜检所得的浮游植物结果,通过PRIMER 6.1.13软件[16]对浮游植物多样性指数进行分析,并利用R 语言 (version 4.3.0) Vegan 包 (https://CRAN.Rproject.org/package=vegan)对浮游植物和养殖池塘水环境因子进行典型关联分析 (Canoni-cal correlation analysis, CCA)。
1.3.4 宏基因组数据分析
对测序得到的原始数据进行过滤处理,去除污染及低质量数据、污染序列等,得到有效数据,将数据拼接组装并统计组装结果。对重叠群进行基因预测并去冗余,构建基因目录,与NR (nr_202109)数据库进行比对 (BLASTP),物种注释方法为Besthit,获得物种注释信息,并计算物种丰度。在基因集中筛选浮游植物蓝藻门、硅藻门、绿藻门、裸藻门 (仅包括植物界中的裸藻目)、金藻门、黄藻门、甲藻门基因构建新的浮游植物基因集,并获得不同物种的基因丰度表。通过Mothur 1.30[17]软件进行α 多样性指数分析;基于相应的分类学数据表,利用R 语言 (version 4.3.0) 工具作图绘制群落柱形图;利用R 语言Vegan 包进行冗余分析 (Redundancy analysis, RDA)。不同月份养殖水体中的所有微生物基因组原始数列已上传至NCBI (登录号:PRJNA983 952)。
2 结果
2.1 养殖蟹塘水质指标
养殖蟹塘在养殖中后期 (6—10 月) 的水质指标见表1。在此期间,不同月份间的水质指标均存在显著性差异 (P<0.05)。其中,6 月pH、DO、BOD5最高;7 月WT、Chl-a最高;6—8 月高温期,PO4、TN、NH3-N、NO2-N、IMn 均在8 月出现高值;8 月的DO 显著高于7 月(P<0.05);而9—10 月低温期,TP、PO4、NO3-N、IMn、BOD5出现高值。根据GB 11607《渔业水质标准》 和 GB 3838—2002《地表水环境质量标准》的III 类水标准,该养殖塘在养殖中后期主要超标指标为pH、IMn、TP 和TN。
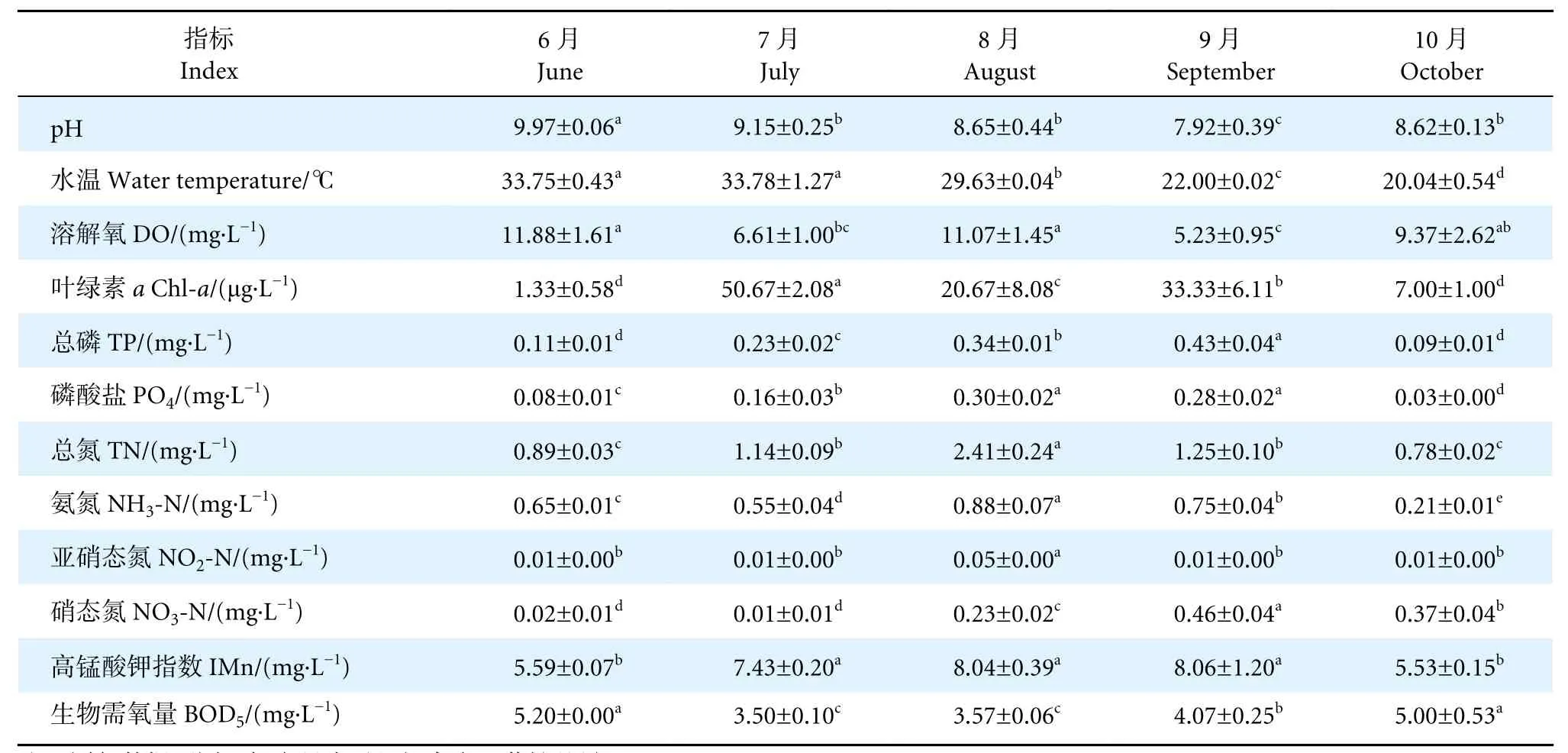
表1 中华绒螯蟹养殖池塘水体理化指标Table 1 Physicochemical parameters in water bodies of E. sinensis aquaculture ponds
2.2 人工镜检浮游植物的组成及与环境因子的关系
在养殖中后期通过人工镜检共鉴定出浮游植物4 门65 种。其中,蓝藻门9 种,绿藻门36 种,硅藻门11 种,裸藻门9 种。7 月浮游植物种类数量最多 (图1-a),优势类群主要为绿藻门。以优势度指数Y≥0.02 定为优势种,养殖中后期的优势种主要为蓝藻门的水华微囊藻 (Microcystisflos-aquae)、细小隐球藻(Aphanocapsaelachista)、挪氏微囊藻(M.novacekii)、绿藻门的水绵 (Spirogyrasp.)、方形十字藻 (Crucigeniarectangularis)、硅藻门的中肋骨条藻 (Skeletonemacostatum)和裸藻门的敏捷扁裸藻(Phacusagilis) (表2)。其中,6、7 和9 月以蓝藻门的水华微囊藻为主要优势藻,8 月以蓝藻门的细小隐球藻为主要优势藻,10 月以硅藻门的中肋骨条藻为主要优势藻。

图1 不同月份的浮游植物种类数量、密度、生物量和多样性指数Fig. 1 Species composition, density, biomass and diversity index of plankton in different months
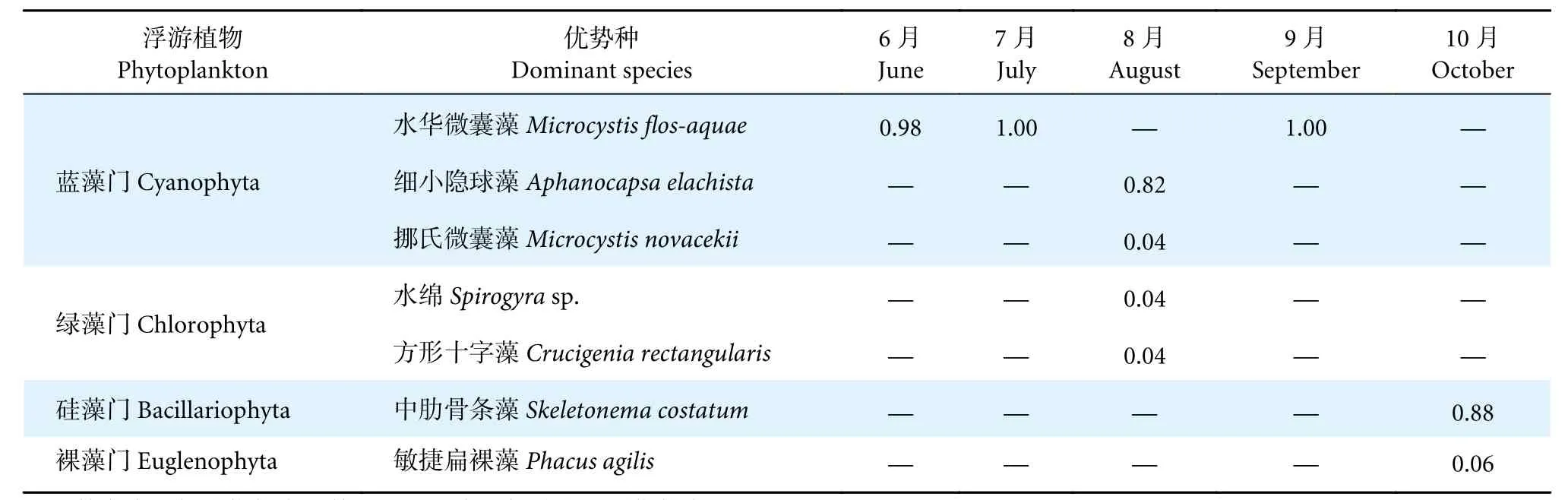
表2 中华绒螯蟹养殖池塘浮游植物优势种优势度Table 2 Dominance index of phytoplankton dominant species in aquaculture pond of E. sinensis
浮游植物密度和生物量变化见图1-b—1-c。养殖中后期浮游植物密度最高值出现在7 月 (2 656.38×107个·L−1),其次为9 月 (21.97×107个·L−1),均显著高于其他月份(P<0.05)且以蓝藻门为主。浮游植物生物量同样为7 月最高 (267.54 mg·L−1),其次为9 月 (3.51 mg·L−1),均显著高于其他月份 (P<0.05)且均以蓝藻门为主。8 月浮游植物的密度和生物量显著降低,其中蓝藻门的藻细胞密度最大(2.52×105个·L−1),绿藻门的藻细胞生物量最小(0.03 mg·L−1)。浮游植物的Shannon-Wiener 多样性指数 (0.03~0.53) 和Pielou 均匀度指数 (0.006~0.110) 具有较好的拟合度,最高值均出现在8 月,最低值均出现在9 月;Margalef 丰富度指数 (0.83~1.84) 最低值同样出现在9 月,最高值出现在10 月(图1-d)。
利用R 语言对人工镜检所得浮游植物群落结构进行去趋势对应分析 (Detrended correspondence analysis,DCA,图2),得出第一轴梯度长度为5.15(>4.0),因此选择对群落结构与水环境因子进行CCA 分析。利用方差膨胀因子分析,保留膨胀因子小于10 的环境因子 (pH、DO、Chl-a、TN、NH3-N、NO3-N、IMn、BOD5)。CCA1 和CCA2 轴的特征值分别为0.97 和0.96,两轴的约束解释量分别为49.54%和48.74%,共解释了98.28%的浮游植物群落变异程度。利用ANOVA 显著性分析,基于类方差排列检验 (ANOVA like permutation test, number of permutations=999),得出DO (F=58.45,P=0.001)、Chl-a(F=25.30,P=0.001)、TN (F=59.85,P=0.001)、NH3-N (F=53.60,P=0.001)是对浮游植物优势种影响最显著的环境因子,这些因子分别贡献了总解释量的4.00%、8.44%、40.28%和39.52%,贡献最大的环境因子是TN 和NH3-N。由图2 可知,主要驱动因子中DO、NO3-N 和TN 与CCA1轴呈正相关,相关系数分别为0.43、0.41 和0.34,蓝藻门中的细小隐球藻、挪氏微囊藻和绿藻门中的水绵、方形十字藻的丰度与DO、NO3-N 和TN 的浓度密切相关;而pH 和Chl-a与CCA1 轴呈负相关,相关系数分别为0.24 和0.39,随着pH 和Chl-a的增加,蓝藻中的水华微囊藻成为优势藻;而硅藻门中的中肋骨条藻和裸藻门中的敏捷扁裸藻的丰度与BOD5、NO3-N、DO 密切相关。

图2 养殖蟹塘浮游植物优势种与环境因子的CCA 排序分析Fig. 2 CCA ordination of phytoplankton dominant species and environmental factors in aquaculture pond of E. sinensis
2.3 宏 基因组测序浮游植物组成及与环境因子的关系
分析宏基因组测序数据可得,在养殖蟹塘的浮游植物中,共筛选出蓝藻门、绿藻门、硅藻门和裸藻门4 门 (图3-a),其中在种水平上分析可知蓝藻门共包含1 181 种,绿藻门183 种,硅藻门89 种,裸藻门10 种,优势种类为蓝藻门和绿藻门。图3-a显示,除9 月以绿藻门 (占64.62%) 为主外,6、7、8 和10 月均以蓝藻门为主,分别占比92.77%、99.48%、88.17%和67.13%。10 月绿藻门和硅藻门占比分别为4.20%和28.49%。浮游植物基因丰富度、均匀度和多样性分别用Chao、Shannoneven 和Shannon 表示 (图3-b)。6—10 月浮游植物基因丰富度指数介于226~294,最高值出现在7 月,最低值出现在9 月;群落均匀度指数介于0.19~0.62,最高值出现在6 月,最低值出现在7 月;群落多样性指数介于1.08~3.34,最高值出现在6 月,最低值出现在7 月。
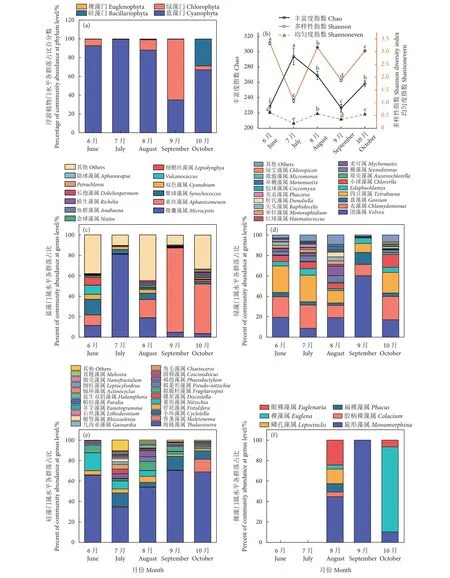
图3 浮游植物门水平各群落组成(a)、多样性指数(b)、蓝藻门、绿藻门、硅藻门和裸藻门属水平各群落组成(c—f)Fig. 3 Percent ages of community abundance at phylum level (a) and diversity indices of plankton (b), percent of community abundance at genus level of Cyanophyta, Chlorophyta, Bacillariophyta, and Euglenophyta (c—f) in different months
养殖蟹塘的浮游植物在属水平上共鉴定出蓝藻门180 属、绿藻门115 属、硅藻门52 属和裸藻门6 属(图3-c—3-f)。蓝藻门中微囊藻属在6、7、8、9 和10 月的占比分别为11.43%、81.00%、18.96%、4.73%和3.51%,可见微囊藻属在7 月为绝对优势属。6 月占比最多的为聚球藻属 (Synechococcus,15.17%);8 月除微囊藻属 (18.96%) 外,束丝藻属(Aphanizomenon)占比较多 (17.85%);9、10 月的绝对优势属均为束丝藻属,占比分别为82.36%、48.46%。绿藻门中6、7 月占比较多的均为四豆藻属 (Tetrabaena)和衣藻属 (Chlamydomonas),分别为25.96%、25.95%和20.16%、22.74%;8、9 月团藻属 (Volvox)占比最多,分别为19.15%、60.15%;10 月衣藻属和四豆藻属占比较多,分别为22.70%和20.15%。硅藻门中6、7、8、9 和10 月占比最多的均为海链藻属(Thalassiosira),分别为65.61%、34.29%、53.97%、70.24%和68.87%。裸藻门中6、7 月未注释到相关物种,8、9 月占比最多的均为旋形藻属 (Monomorphina),并且9 月只注释到此属;1 0 月占比最多的为裸藻属 (Euglena,83.03%)。从种水平上分析,6、8、9、10 月的优势种均为水华束丝藻 (A.flos-aquae),7 月为铜绿微囊藻 (表3)。
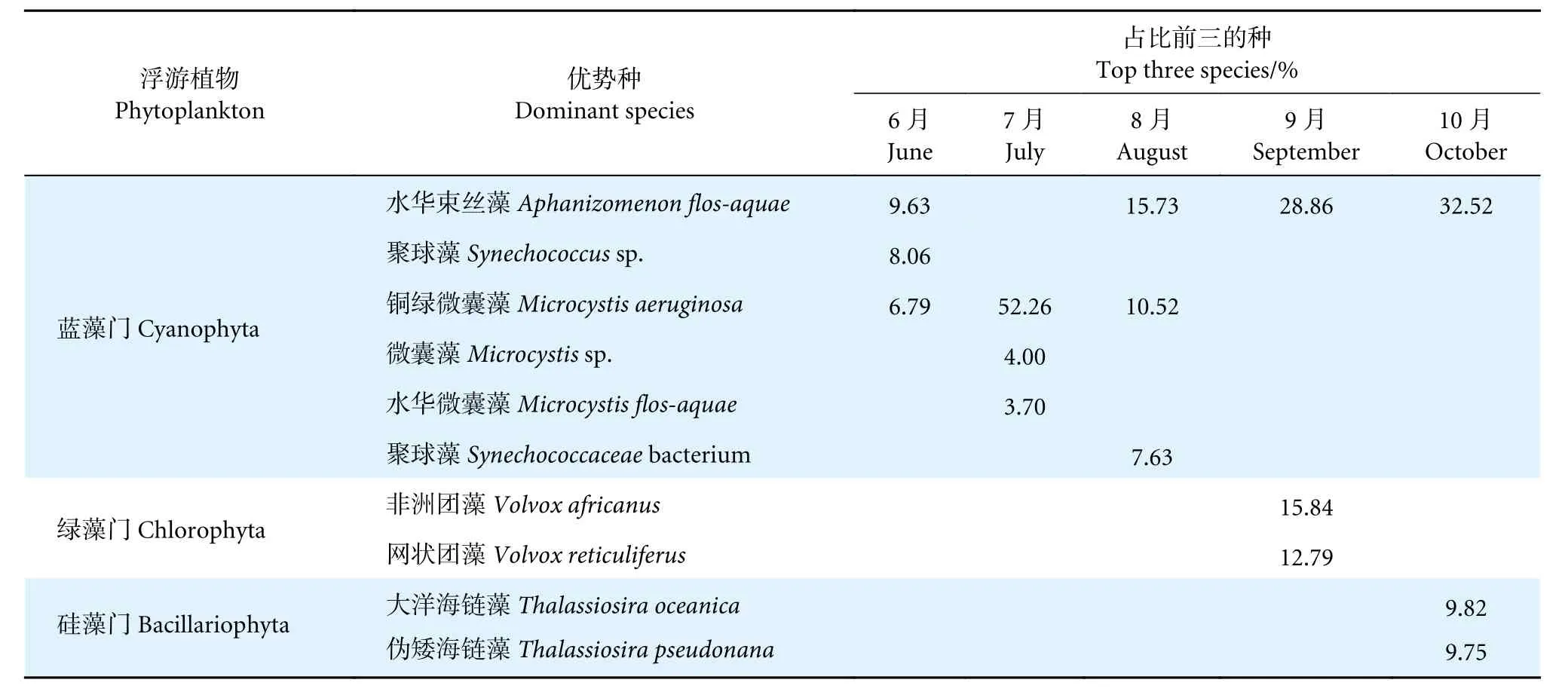
表3 中华绒螯蟹养殖池塘浮游植物优势种占比Table 3 Composition of phytoplankton dominant species in aquaculture pond of E. sinensis
利用R 语言对宏基因组数据构建的浮游植物优势物种进行去DCA 分析(图4),得出第一轴梯度长度为1.86 (<4.0),因此选择对群落结构与水环境因子进行RDA 分析。利用方差膨胀因子分析,保留膨胀因子小于10 的环境因子(pH、DO、Chl-a、TN、NH3-N、NO3-N、IMn、BOD5)。RDA1 和RDA2 轴的特征值分别为0.19 和0.07,两轴的约束解释量分别为59.15%和21.57%,共解释了80.72%的浮游植物群落变异程度。利用ANOVA 显著性分析,基于类方差排列检验,得出 pH (F=167.81,P=0.001)、DO (F=91.60,P=0.001)、Chl-a(F=169.49,P=0.001)、TN (F=42.54,P=0.001)、NH3-N(F=76.72,P=0.001)和NO3-N (F=58.12,P=0.001) 是影响浮游植物优势种最显著的环境因子,这些因子分别贡献了总解释量的37.12%、3.50%、19.29%、7.47%、16.26%和10.82%,贡献最大的环境因子为pH 和Chl-a。由图4 可知,主要驱动因子中NO3-N 与RDA1 呈显著正相关,相关系数为0.89,沿着第一排序轴RDA1 正方向,随着NO3-N 含量升高,蓝藻门中的水华束丝藻和绿藻门中的非洲团藻 (V.africanus)、网状团藻 (V.reticuliferus) 丰度增加;而pH 和Chl-a与第一排序轴RDA1 呈负相关,相关系数分别为0.58 和0.47,随着pH 和Chl-a的增加,蓝藻中的微囊藻属为优势藻;而硅藻门中海链藻属的丰度与BOD5和DO 密切相关。

图4 养殖蟹塘浮游植物优势种与环境因子的RDA 排序分析Fig. 4 RDA ordination of phytoplankton dominant species and environmental factors in aquaculture pond of E. sinensis
3 讨论
3.1 人工镜检与宏基因组测序结果对比
通过人工镜检和宏基因组学分析得出浮游植物种类的数量和类别存在显著性差异。通过宏基因组学所得的浮游植物种类远远大于人工镜检,在种水平上为人工镜检的22.51 倍;两种方法检出的每月的优势种完全不同,甚至10 月所鉴定出的优势种属于不同门。需要重点指出的是,人工镜检法所得10 月的优势藻为中肋骨条藻,被认为是一种广温、广盐的近岸型硅藻,最适增殖温度和盐度范围分别为24~28 ℃和20‰~30‰[18],是长江口及其邻近海域最常见的赤潮种[19]。本研究的取样点为位于长江口的上海市崇明区,盐度范围为0.1‰~0.3‰,显然不是中肋骨条藻的最适增殖条件。近年来相关研究报道,骨条藻在一些淡水环境中,如太湖、鄱阳湖、苏州河中被频繁检出,并在某一时期成为优势种,但关于淡水骨条藻的研究较少[20],因此不排除淡水养殖蟹塘中存在骨条藻成为优势种的可能性。而且,宏基因组测序数据分析所得的10 月的优势藻海链藻同样为近海咸淡水浮游种类,这充分说明10 月此养殖蟹塘具备咸淡水藻类成为优势种的条件。主要原因可能是上海市崇明区养殖蟹塘处于长江入海口的咸淡水交界处[21]。
从数值上比较,宏基因组学所得的多样性指数高于人工镜检所得结果,这与之前在海水池塘生态养殖系统中通过两种方法所得的浮游植物多样性的研究结果一致[12]。一般来说,浮游植物的多样性指数越高,其群落结构越复杂,稳定性越好,但多样性指数与水体环境质量之间的关系较为复杂,只适合用来从某些侧面进行分析[22]。通过人工镜检结果对影响浮游植物群落结构的关键环境因子进行分析,发现DO、Chl-a、TN、NH3-N 是与浮游植物优势种群落结构显著相关的环境因子;而通过宏基因组数据分析结果发现pH、DO、Chl-a、TN、NH3-N、NO3-N 是优势种群落结构变化的关键驱动环境因子,包含了人工镜检所得的关键环节因子。因此,虽然通过两种分析方法所得的优势物种有所不同,但所得的关键驱动环境因子存在一致性。
目前针对养殖水体中浮游植物的研究更多集中在基于细胞形态的传统镜检鉴定,可以同时实现定性和定量,但是对操作者的背景要求较高,且不易检测到超微以及低丰度的稀有类群。而高通量测序方法可以快速评估水体中浮游植物类群的DNA序列信息,快速检出一些形态相似、细胞较小或丰度较低的类群;除鉴定浮游植物种类外,还可对群落中潜在的生物学功能进行分析,但对数据库的依赖性较高,对不可培养的或真核浮游植物的覆盖度相对较低,同时高通量数据积累了测序错误率。本研究利用人工镜检和高通量测序两种方法进行浮游植物分析,从结果可知两种方法各有优劣,在某些优势种鉴定或者多样性分析方面存在明显差异,这与之前的研究结果一致[12]。建议在实际检测过程中可同时采用这两种方法,相互验证,以全面准确地评估养殖水体中的浮游植物群落结构变化情况,从总体上评判养殖环境的风险,及时实施调控措施。
3.2 养殖蟹塘浮游植物群落结构特征及动态变化
本研究通过人工镜检和宏基因组学研究检测出的浮游植物主要包括蓝藻门、绿藻门、硅藻门和裸藻门,且以蓝藻门、绿藻门和硅藻门为主。浮游植物群落结构会随着养殖产品及其养殖环境的不同而动态变化。已有研究均通过人工镜检鉴别养殖池塘内的浮游植物群落,在湖北省某生态养鱼池塘内鉴定出浮游植物112 种,其中绿藻门、裸藻门和硅藻门为优势门类[23];在浙江省某梭子蟹综合养殖池塘内共鉴定出浮游植物81 种,其中以硅藻门、蓝藻门和甲藻门为主[6];在东北地区盐碱养殖池塘内共鉴定出浮游植物65 种,以绿藻门、蓝藻门和硅藻门为主[24];而在上海地区芦苇稻幼蟹塘内共鉴定出126 种浮游植物,以绿藻门、硅藻门和蓝藻门为主[25]。总体上,养殖池塘内的蓝藻、绿藻和硅藻检出频率最高,在水质较好的养殖池塘内,绿藻和硅藻为主要优势藻[2],而蓝藻通常在水体营养物质丰富时出现[5,26]。总体来说,人工镜检和宏基因组测序所得的优势藻大部分为蓝藻门的微囊藻属和束丝藻属,证明此养殖蟹塘存在蓝藻水华爆发的风险,并且可能产生藻毒素,对水产养殖产品造成危害,需要养殖户调控水体营养物质,以防蓝藻过度生长。
从不同月份来看,7 月的浮游植物密度和生物量最高,且蓝藻的丰度占比也最高,这也与水体中较高的Chl-a和较低的生物多样性密切相关。值得注意的是,同样是在养殖中后期的高温期,8 月的浮游植物生物密度和生物量相较于7 月显著降低,且生物多样性显著提高,这和8 月开启的推水过程密不可分。水体的推流过程增加了水体的DO,改善了水质条件,减少了浮游植物过度生长,这和稻田推水增氧改善水质的原理类似[27-28]。而在9、10 月低温期,浮游植物种类增加,尤其在9 月,根据宏基因组数据分析,绿藻门藻丰度占比已经超过蓝藻,是其1.84 倍;同样,10 月浮游植物除了蓝藻和绿藻外,硅藻占比也达到了28.49%。可见,养殖末期的浮游植物不仅密度和生物量显著下降,多样性指数在10 月也有明显增加,水质指标明显改善,比如10 月的TN、TP 均处于养殖中后期的最低水平。
3.3 影响养殖蟹塘浮游植物优势种的环境因子
水产养殖过程中浮游植物群落结构动态变化与环境因子密切相关[29]。针对相对封闭的养殖小水体环境,一般认为,水体有机质含量和营养物质水平是影响浮游植物群落变化的主要环境因子[30-31]。本研究中,人工镜检和宏基因组数据分析共同认为DO、Chl-a、TN、NH3-N 是影响浮游植物优势种的重要环境因子,pH 和NO3-N 是宏基因组数据分析所得的关键环境因子。在自然水体中,浮游植物通过光合作用释放氧气 (O2) 增加水体DO,水中较低的DO 同样会抑制浮游植物生长[32]。可见自然水体中DO 与浮游植物生物量存在显著正相关性。但在本研究中,7 和9 月低DO 情况下测得的浮游植物生物量反而较高,一方面由于本研究中养殖池塘内配备了曝气机和推流机保证整个养殖中后期水体中DO 质量浓度大于5 mg·L−1,使得浮游植物的产O2量对水体DO 的含量作用效果不明显[24];另一方面养殖池塘内浮游植物生物量比如Chl-a含量还与水温、pH 等其他指标存在显著相关性[33],这解释了本研究中DO 与Chl-a并未呈现正相关的可能原因。氮、磷营养盐是浮游植物群落的重要影响因子,本研究中发现两种方法检出的蓝藻门中的优势微囊藻属均与NO3-N 呈负相关,而与NH3-N 呈正相关,这可能是由于蓝藻门微囊藻属浮游植物以利用NH3-N 为主[34]。
4 结论
综上所述,通过宏基因组学鉴定的浮游植物种类数量远远数高于人工镜检,在种水平上是其22.51 倍,并且两种方法鉴定得出的不同月份的优势种也存在差异。总体来说,6—8 月高温期的优势种主要以蓝藻为主,9—10 月逐渐过渡到蓝藻与绿藻、硅藻共存。同时根据浮游植物的多样性指数分析,宏基因组学所得的多样性指数高于人工镜检所得结果。人工镜检和宏基因组数据分析所得影响浮游植物优势种的关键环境因子均包括DO、Chl-a、TN、NH3-N,此外,宏基因组数据分析认为pH和NO3-N 也是影响浮游植物的关键环境因子。虽然通过人工镜检和宏基因组测序数据分析所得的浮游植物数量以及种类均存在差异,但是从整体上看两者各有优劣,在关键环境因子的分析上存在一致性。因此,建议将人工镜检与宏基因组测序方法相结合,共同分析水产养殖池塘内浮游植物群落变化及演替规律,从而全面、快速、准确地为水产养殖中的蓝藻水华防控及污染物去除等措施提供数据支撑。
