硝酸-喷雾热解法回收磷酸铁锂正极废料的研究
2024-03-05汪思琪桑子容韩培林姚家涛
汪思琪,桑子容,韩培林,姚家涛,张 勇
武汉工程大学材料科学与工程学院,湖北 武汉 430205
随着科技的发展,以及人们对于能源与环境的重视[1],全球新能源汽车行业得到迅速发展。由于原料成本低、稳定性好、环境友好[2-3]等优点,磷酸铁锂电池在新能源汽车行业得到广泛应用[4-6],且市场份额逐年提高,2021 年磷酸铁锂电池累计产量125.4 GW·h,累计同比增长262.9%[7]。巨大的市场份额与产量势必造成在电池寿命结束后产生的废弃物将持续增多,若不妥善处理,将对环境造成极大负担。此外,我国还是锂资源冶炼与使用大国,但中国的锂矿储量仅占全球总量的5.88%[8],锂原料供应高度依赖进口[9]。2020-2022 年,国内对锂资源的需求持续增长,碳酸锂价格飙升,至2022 年超过50 万元/t[10]。故回收磷酸铁锂废料,提高锂回收率,对于缓解锂资源压力具有重大意义。
国内回收废旧磷酸铁锂电池的方法主要为火法回收[11]和湿法回收[12-13]。因金属回收率高、产品纯度高、能耗低等优点[14-15],湿法回收成为磷酸铁锂废料的主要回收方式[16-17],通常利用硫酸、盐酸和硝酸等浸出回收。如周吉奎等[18]使用H2SO4-H2O2体系回收磷酸铁锂,锂浸出率达到97.8%;王轩等[19]使用盐酸浸出,锂回收率达到96%;王百年等[20]使用硝酸浸出,锂回收率达到91.25%。上述方法均能达到较高的金属回收率,但在进行锂元素回收时,通常运用沉淀结晶法,向含锂溶液中加入过量碳酸钠[20-21]沉淀回收碳酸锂。此过程向体系中引入新的杂质离子,后期金属沉淀分离需要大量的洗涤水,有价金属在洗涤过程中存在损失,同时含盐废水量大,污染治理成本偏高。有鉴于此,本文采用硝酸-喷雾热解法回收磷酸铁锂废料制备高纯度碳酸锂,该方法不引入其他杂质离子,减少了洗涤分离杂质的过程,由硝酸锂溶液一步喷雾热解制备出碳酸锂,有效提高了锂的回收率,对磷酸铁锂回收锂元素的工业化生产具有一定的参考价值。
1 实验部分
1.1 原料和试剂
硝酸、甲醇等试剂均为分析纯。磷酸铁锂正极废料(湖北某新能源公司提供),其主要元素含量如表1 所示。

表1 磷酸铁锂正极废料主要元素含量Tab.1 Main element content of lithium iron phosphate cathode waste%
1.2 实验方法
称取适量磷酸铁锂废料165 g(记磷酸铁锂1 mol),加入一定量硝酸溶液,控制硝酸浓度、反应时间与反应温度,加热搅拌持续反应一定时间;过滤,向滤液中加入碳酸锂和双氧水调节pH 值,使铁离子沉淀;过滤,获得硝酸锂溶液。
向硝酸锂溶液中加入甲醇,配制成所需浓度的前驱体溶液,溶液中n(硝酸锂)∶n(甲醇)=1.0∶(0~2);溶液由蠕动泵送至喷头,雾化为超细雾滴;随载气(二氧化碳)进入放置于管式加热炉内的石英玻璃管内,热分解反应生成碳酸锂粉末;干燥的粉体经旋风分离器收集,经洗涤干燥为碳酸锂样品。流程图如图1 所示。

图1 硝酸-喷雾热解回收磷酸铁锂正极废料流程图Fig.1 Flow chart of lithium iron phosphate cathode waste recovery by nitric acid-spray pyrolysis method
1.3 表征方法
采用X 射线衍射仪(X-ray diffraction,XRD)(X'Pert PRO MPD)表征样品结构;采用SU3500扫描电子显微镜(scanning electron microscope,SEM)表征样品形貌;采用电感耦合等离子体发射光谱仪(ICP-OES,Optima 8000)分析元素含量;采用喷雾热解系统(USP20,北京东方金荣)对硝酸锂溶液进行处理,采用Netzsch STA-449C 同步热分析仪对硝酸锂原料进行热重-差示扫描量热(thermogravimetry and differential scanning calorimetry,TG-DSC)分析。
2 结果与讨论
2.1 酸浸条件对磷酸铁锂废料浸出效果的影响
图2 为不同浸出条件对磷酸铁锂废料中锂离子浸出率的影响。
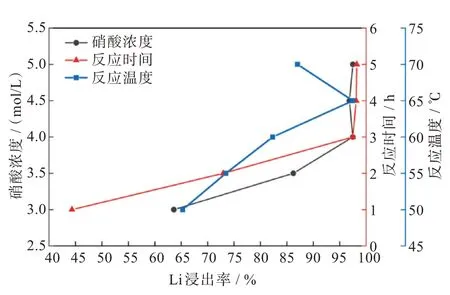
图2 不同浸出条件对锂离子浸出率的影响Fig.2 Influences of different leaching conditions on leaching rates of lithium ions
其他条件不变,改变硝酸浓度进行实验,结果如图2 所示。随体系内硝酸浓度增大,Li浸出率呈上升趋势。但当硝酸浓度大于4 mol/L,浸出率无明显变化。分析认为,当体系内H+浓度上升,LiFePO4与H+接触频率提高,反应更加剧烈迅速,LiFePO4充分反应,Li浸出率大幅提升。但当H+浓度到达一定程度,LiFePO4反应完全,浸出率变化平缓。综合考虑酸浸成本及浸出效率,选择4 mol/L为反应浓度。
其他条件不变,改变反应温度进行实验,结果如图2 所示。反应温度对Li 浸出率影响较大,锂浸出率呈现先上升后下降的趋势。分析认为,温度升高促使体系中离子运动更为剧烈,使其与LiFePO4充分接触反应,促进反应的进行。当反应温度较高时,硝酸的挥发会使硝酸浓度降低,导致Li浸出率下降,因此选择反应温度为65 ℃。
其他条件不变,改变反应时间进行实验,结果如图2 所示。延长反应时间可提高锂的浸出率,但反应时间超过3 h,浸出率增幅较小。分析认为,硝酸与磷酸铁锂在3 h 内已充分反应,反应时间继续增加不会对浸出率造成较大影响。从时间成本考虑,选择反应时间为3 h。
最佳条件下,锂浸出率达到97.47%,与王百年等[20]硝酸浸出率接近,其差异主要由不同厂家提供的磷酸铁锂原料中锂元素被包裹的程度不同引起。
2.2 浸出液净化除杂
为获得高纯度的硝酸锂溶液,必须除去溶液中的杂质。浸出液中的杂质主要为Fe2+,向溶液中加入碳酸锂与过氧化氢,调节pH=5,充分反应,使Fe2+被氧化为Fe3+,并与PO43-结合形成沉淀,去除浸出液中的铁杂质。表2 为浸出液除杂前后主要元素质量浓度变化情况,可以看出除杂前后溶液中铁元素含量明显降低,说明绝大部分铁杂质被除去。溶液中Li+浓度变化由净化除杂后溶液体积导致。

表2 浸出液除杂前后主要元素质量浓度变化情况Tab.2 Mass concentration changes of main elements in leaching solution before and after impurity removal
将沉淀物洗涤干燥后经XRD 分析,如图3 所示,沉淀物的衍射峰与FePO4·2H2O 标准XRD 图谱(JCPDF No.33-0666)特征峰一致,因此可确定浸出液中的杂质Fe3+转化为FePO4·2H2O中并被除去。
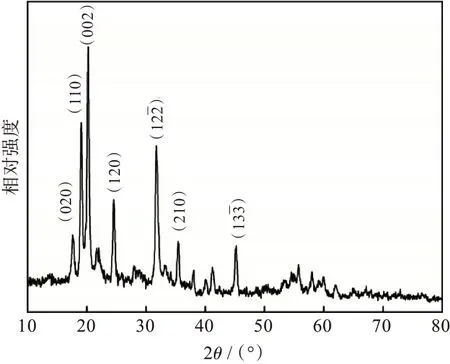
图3 除杂沉淀物的XRD 图Fig.3 XRD pattern of precipitate formed during impurity removal process
2.3 喷雾热解条件对碳酸锂转化率的影响
为确定硝酸锂喷雾热解温度,对硝酸锂原料进行热分析,图4 为硝酸锂热解的TG-DSC 曲线。图4 显示,DSC 曲线上,在600~650 ℃之间有1 个吸热峰,是硝酸锂热分解产生的。与此对应,TG曲线达到650 ℃后,质量不再变化,证明此时硝酸锂已完全分解。为确保硝酸锂完全分解,确定喷雾热解温度为700 ℃。

图4 硝酸锂的TG-DSC 曲线Fig.4 TG-DSC curves of lithium nitrate
通过控制变量法得到磷酸铁锂废料酸浸的最佳实验条件为:硝酸浓度为4 mol/L,反应温度为65 ℃,反应时间为3 h,并对该条件下所制得的硝酸锂溶液加入不同物质的量的甲醇,于700 ℃下喷雾热解,加入甲醇的物质的量对碳酸锂转化率的影响如图5 所示。

图5 加入甲醇的物质的量对碳酸锂转化率的影响Fig.5 Effects of different amounts of substance of methanol addition on conversion of lithium carbonate
从图5 中可以看出,将硝酸锂与甲醇混合热解,碳酸锂的转化率随加入甲醇的物质的量的提高而不断提高。当加入甲醇的物质的量达到1.5 mol时,碳酸锂转化率达到99%以上,较不含甲醇条件下的碳酸锂转化率提高了近40%,继续提高加入甲醇的物质的量,转化率不再增加。甲醇作为碳源,当反应体系中甲醇含量不断增多,其高温分解产物二氧化碳与硝酸锂热解产生的氧化锂充分接触反应,促进了碳酸锂的生成。因此,确定加入甲醇的物质的量为1.5 mol,且溶液中n(硝酸锂)∶n(甲醇)=1.0∶1.5。
2.4 碳酸锂的检测与分析
由上述实验讨论确定最佳实验条件为:硝酸浓度为4 mol/L,反应温度为65 ℃,反应时间为3 h,n(硝酸锂)∶n(甲醇)=1.0∶1.5,热解温度为700 ℃。
将最佳条件下制备的Li2CO3样品进行表征,如图6 所示。
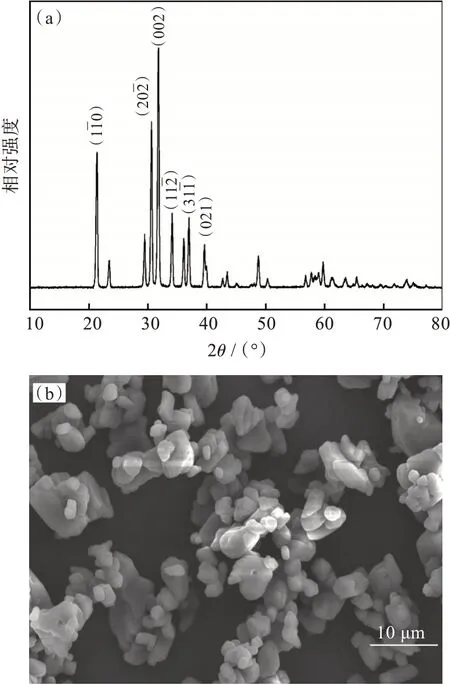
图6 最佳条件下Li2CO3样品的XRD 图(a)和SEM 图(b)Fig.6 XRD pattern(a)and SEM image(b)of Li2CO3 samples under optimum conditions
图6 (a)为Li2CO3样品的XRD 图,可以看出,Li2CO3样品主峰峰型完整尖锐,衍射峰强度较高,无其他明显杂质相,结晶度较好。通过对比发现,样品衍射峰与Li2CO3标准XRD 图谱(卡片JCPDF No.22-1141)特征峰一致,因此可确定样品为Li2CO3。
图6 (b)为Li2CO3样品的SEM 图,可看出碳酸锂粉体为类球形,分散性较好。相比于传统液相沉淀法,该方法制备的粒径分布更均匀,有利于合成质量稳定的产品。
取最佳条件下所制备碳酸锂样品,按照行业标准YS/T 582—2013《电池级碳酸锂》检测纯度,纯度可达到98.4%,各项指标对比如表3 所示,若继续提纯可制备电池级碳酸锂。
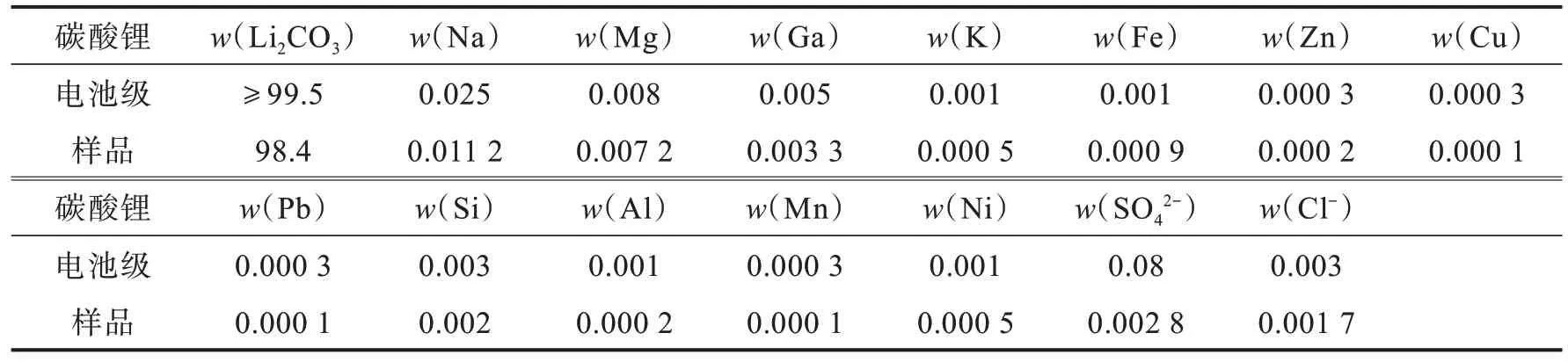
表3 碳酸锂样品化学成分含量与电池级碳酸锂对比Tab.3 Comparison of chemical compostion content of lithium carbonate samples with that ofbattery grade lithium carbonate%
3 结 论
(1)以硝酸作为酸浸剂,以锂浸出率作为考查指标,考查并确定了硝酸浸取磷酸铁锂正极废料的最佳工艺条件:硝酸浓度4 mol/L、反应温度65 ℃、反应时间3 h,锂浸出率达到97.47%。
(2)硝酸锂溶液可通过喷雾热解制备碳酸锂,最佳反应条件:n(硝酸锂)∶n(甲醇)=1.0∶1.5 配制混合溶液,热解温度为700 ℃,碳酸锂的转化率可达到99%以上,纯度可达到98.4%。
(3)以硝酸-喷雾热解法制备碳酸锂,工艺流程简便,不引入杂质离子,减少了洗涤除杂过程,降低了洗涤分离过程中锂的流失,产品回收率高,对磷酸铁锂回收锂元素的工业化生产具有一定的参考价值。
