不同混合比例茅台酒糟与芭蕉叶对其青贮饲料营养品质、发酵品质和微生物群落的影响
2024-03-05赵圆圆樊雪莹成启明陈玉连李茂雅王佳楚函何湘江王志军刘鹰昊
赵圆圆 樊雪莹 成启明* 陈 超 陈玉连 李茂雅 雷 耀 王佳楚函 何湘江 王志军 刘鹰昊
(1.贵州大学动物科学学院,贵阳 550025;2.内蒙古农业大学草原与资源环境学院,草地资源教育部重点实验室,农业农村部饲草栽培、加工与高效利用重点实验室,呼和浩特 010021;3.中国农业科学院草原研究所,呼和浩特 010010)
近年来,随着畜牧业的高速发展,动物饲料的供需关系逐渐失衡,饲料的供不应求状况是畜牧业急需解决的问题,开发和利用非常规饲料是目前有效解决饲料短缺的途径之一[1]。我国贵州地区四季分明,雨季较多,冬季牧草紧缺,青贮调制可提高牧草利用率和适口性,是解决青绿饲料季节性不均衡问题的重要方法[2]。
芭蕉(MusabasjooSieb. Et Zucc.)是芭蕉科芭蕉属植物,是生长于热带的多年生草本植物之一,在我国贵州、广东、广西、海南、四川、云南和台湾等地均有分布[3]。芭蕉的果肉、花、叶和根中均含有丰富的糖类、氨基酸、纤维素、矿物质、微量元素及多种化合物成分[4],而芭蕉叶作为废弃物,对其进行饲料化利用不仅可以缓解我国部分地区青绿饲料不足的问题,也能缓解资源浪费的问题[5]。芭蕉叶所含粗蛋白质(CP)(6.45% DM)和水溶性碳水化合物(WSC)较低,但其中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量较高,分别为53.35% DM和32.13% DM,单独青贮会导致青贮品质不佳,所以需要选取另一种材料来进行养分互补,从而改善芭蕉叶的青贮品质[6]。
酒糟是酿酒过程中高粱、小麦等原料经过蒸煮、发酵和蒸馏出酒后留下的固体废弃物,具有产量巨大、含水率高、酸度大及易腐烂变质的特点,如果处理不当会严重污染生态环境[7]。由于茅台酒糟中含有较高的蛋白质、粗纤维和丰富的水解氨基酸[8],具有良好的饲用价值,可通过青贮的方式利用茅台酒糟,缓解饲草紧缺问题,减少环境污染[9]。原现军等[10]研究表明,在箭筈豌豆与苇状羊茅(3∶7)混合青贮中添加10%青稞酒糟即能够提高混合青贮发酵品质。任海伟等[11]研究表明,在白酒糟与菊芋渣混合比例为1.2∶1和1∶1.5时,能够有效改善青贮发酵品质,提高饲用价值。由此推测,茅台酒糟与芭蕉叶混合青贮可能能获得优质的青贮饲料,而此前关于茅台酒糟与芭蕉叶混合青贮的研究还未见报道。
因此,本试验通过研究茅台酒糟与芭蕉叶不同混合比例对其青贮品质的影响,并通过对其养分含量、发酵品质和微生物群落等指标进行综合分析,筛选出茅台酒糟与芭蕉叶混合青贮的最适比例,旨在为芭蕉叶和茅台酒糟的饲料化利用提供科学依据,为缓解我国饲草资源紧缺和生产优质青贮产品提供参考,同时为茅台酒糟的后续处理提供一个解决方案,缓解茅台酒糟对环境的污染问题。
1 材料与方法
1.1 试验材料
本试验材料为在贵州省关岭县种植的芭蕉上采集的芭蕉叶,以及从贵州省仁怀市茅台镇茅台集团酒厂取回的茅台酒糟。茅台酒糟和芭蕉叶养分含量见表1。
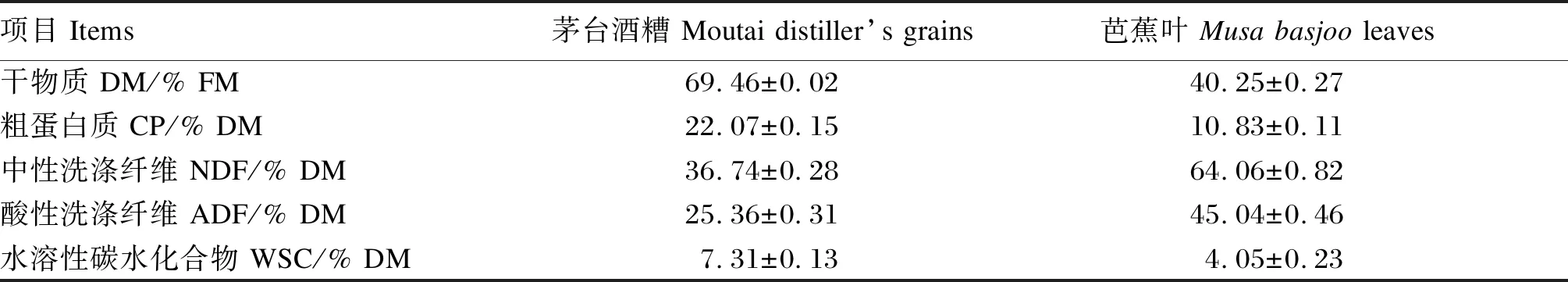
表1 茅台酒糟和芭蕉叶养分含量
1.2 试验设计
以鲜重为基础,本试验共设置6个茅台酒糟与芭蕉叶的混合比例,分别为:100%芭蕉叶单独青贮(BCK组)、20%茅台酒糟与80%芭蕉叶混合青贮(J20B80组)、40%茅台酒糟与60%芭蕉叶混合青贮(J40B60组)、60%茅台酒糟与40%芭蕉叶混合青贮(J60B40组)、80%茅台酒糟与20%芭蕉叶混合青贮(J80B20组)以及100%茅台酒糟单独青贮(JCK组)。青贮60 d后,对各处理青贮饲料的养分含量、发酵品质和微生物群落进行测定,每个处理设置3个重复。
1.3 青贮调制
将收获的新鲜芭蕉叶切成2~3 cm长小段,新鲜茅台酒糟经风干晾晒后,按照试验设计比例将茅台酒糟与芭蕉叶充分混匀后,称取300 g,装入聚乙烯袋中,用真空机抽真空密封青贮。青贮袋封口后置于室温下避光保存60 d。
1.4 测定指标及方法
1.4.1 养分含量和发酵品质测定
青贮开袋后称取120 g左右的样品于65 ℃烘48 h至恒重。将烘干的青贮料打为草粉后,装于自封袋中保存,用于后续养分含量的测定;青贮开袋后取10 g样品,加入90 mL蒸馏水进行破壁,用4层纱布过滤后,得青贮提取液,于-20 ℃保存,用于发酵品质的测定。
pH采用精密pH计进行测定,氨态氮(NH3-N)含量采用苯酚-次氯酸盐比色法[12]进行测定,乳酸(lactic acid,LA)、乙酸(acetic acid,AA)、丙酸(propionic acid,PA)和丁酸(butyric acid,BA)含量采用DB15/T 1458—2018方法[13]进行测定。CP含量采用凯氏定氮法使用定氮仪KN680进行测定[14],WSC含量采用蒽酮-硫酸法[15]进行测定,NDF和ADF含量采用滤袋分析法[16]使用自动纤维分析仪(ANKOM A-200i)进行测定。
1.4.2 微生物群落分析
青贮结束后进行开袋,每袋取出10 g样品,放入90 mL无菌蒸馏水中,用低温振荡器在4 ℃、180 r/min下摇匀30 min,然后用4层纱布过滤得到滤液,再使用冷冻离心机在4 ℃、8 000 r/min离心15 min,最终获得富含微生物的沉积物。使用QIAamp Fast DNA Stool Mini Kit试剂盒提取青贮饲料中的微生物总DNA,进行16S rDNA基因扩增子测序和真菌转录间隔区(ITS)扩增子测序。16S rDNA基因扩增子测序采用的引物序列为:338F,5′-ACTCCTACGGGAGGCAGCA-3′;806R,5′-GGACTACHVHHHTWTCTAAT-3′;ITS扩增子测序采用的引物序列为:SSU0817F,5′-TTAGCATGGAATAATRRAATAGGA-3′;1196R,5′-TCTGGACCTGGTGAGTTTCC-3′。将扩增产物回收纯化,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。使用MiSeq测序仪进行2×300 bp的双端测序并对结果进行分析[17]。使用QIIME软件进行各分类水平的分类学组成分析。
1.5 数据统计分析
采用Excel 2019对原始数据进行初步整理,再使用SPSS 20.0软件对数据进行单因素方差分析(one-way ANOVA)和Duncan氏法多重比较,结果以“平均值±标准误”表示,P<0.05表示差异显著。
2 结果与分析
2.1 不同混合比例茅台酒糟与芭蕉叶对其青贮饲料养分含量的影响
由表2可知,JCK组、J60B40组、J80B20组、J40B60组和J20B80组青贮饲料CP含量均显著高于BCK组(P<0.05),分别提高了94.60%、88.19%、86.66%、67.92%和40.30%;混合青贮组中,J60B40组CP含量最高,显著高于J20B80组和J40B60组(P<0.05)。J60B40组、J40B60组、J80B20组和J20B80组青贮饲料WSC含量与BCK组相比均无显著差异(P>0.05);JCK组WSC含量最高,显著高于其他组(P<0.05)。JCK组青贮饲料NDF和ADF含量显著低于其他组(P<0.05);随着茅台酒糟添加比例的提高,青贮饲料NDF含量呈现逐渐降低的趋势;J40B60组ADF含量最高,显著高于其他组(P<0.05),之后随着茅台酒糟添加比例的提高,青贮饲料ADF含量逐渐降低。由表1和表2对比可知,茅台酒糟和芭蕉叶青贮饲料CP和NDF含量比原料中CP和NDF含量均有所下降。

表2 混合青贮饲料养分含量
2.2 不同混合比例茅台酒糟与芭蕉叶对其青贮饲料发酵品质的影响
由表3可知,BCK组青贮饲料pH最高,显著高于其他组(P<0.05);各混合青贮组pH均显著高于JCK组(P<0.05)。J60B40组青贮饲料NH3-N含量最低,显著低于除JCK组外的其他组(P<0.05);J20B80组、J40B60组和J80B20组之间NH3-N含量均无显著差异(P>0.05)。J60B40组和J80B20组青贮饲料LA含量显著高于其他组(P<0.05),J20B80组、JCK组和BCK组之间LA含量均无显著差异(P>0.05);随着茅台酒糟添加比例的提高,青贮饲料LA含量呈现出先升高后降低的趋势。有趣的是,在JCK组青贮饲料中未检测到AA;J40B60组AA含量最高,显著高于其他组(P<0.05);BCK组、J20B80组、J60B40组和J80B20组之间AA含量均无显著差异(P>0.05)。J40B60组和J80B20组青贮饲料PA含量较高,显著高于其他组(P<0.05);J60B40组PA含量显著高于J20B80组、JCK组和BCK组(P<0.05)。所有组青贮饲料中均未检测到BA。

表3 混合青贮饲料发酵品质
2.3 不同混合比例茅台酒糟与芭蕉叶对其青贮饲料微生物群落的影响
如图1-A所示,仅JCK组青贮饲料的优势菌门为变形菌门(Proteobacteria),其余各组的优势菌门均为厚壁菌门(Firmicutes),其次是变形菌门;除此之外,各组还存在少量的拟杆菌门(Bacteroidota)和放线菌门(Actinobacteria);JCK组和J80B20组均存在少量的疣微菌门(Verrucomicrobiota)。
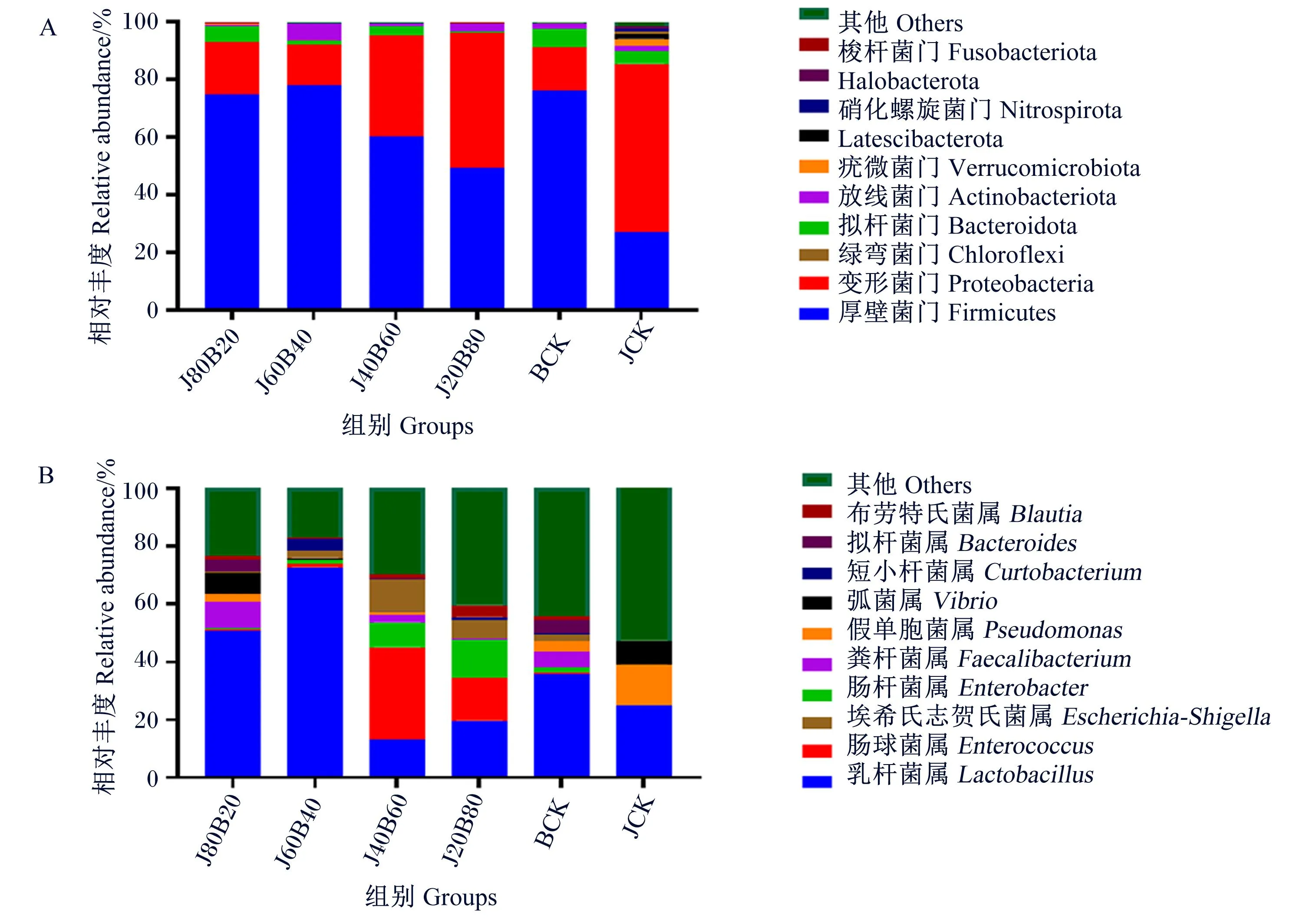
图1 混合青贮饲料细菌在门(A)和属(B)水平上的分布
如图1-B所示,J60B40组和J80B20组青贮饲料的优势菌属为乳杆菌属(Lactobacillus),相对丰度分别为72.76%和50.92%;J40B60组的优势菌属为肠球菌属(Enterococcus),其余组的优势菌属均为其他(others);J40B60组和J20B80组乳杆菌属的相对丰度低于BCK组和JCK组,而肠球菌属的相对丰度高于其他组。
如图2-A所示,仅J40B60组青贮饲料的优势菌门为其他(others),其余各组的优势菌门均为子囊菌门(Ascomycota),且JCK组子囊菌门的相对丰度最高,达到98.25%。J80B20组、J60B40组、J40B60组、J20B80组和BCK组均含有少量的担子菌门(Basidiomycota),相对丰度分别为8.06%、16.86%、3.95%、3.18%和3.34%。
图2 混合青贮饲料真菌在门(A)和属(B)水平上的分布
如图2-B所示,所有组青贮饲料的优势菌属均为其他(others),其次是毕赤酵母属(Pichia),相对丰度分别为J80B20组24.29%、J60B40组32.57%、J40B60组13.10%、J20B80组37.61%、BCK组30.48%以及JCK组21.38%;所有组均含有少量的裂殖酵母属(Schizosaccharomyces)。此外,JCK组含有相对丰度为23.03%的Kazachstania-Candidaclade,J60B40组含有相对丰度为8.72%的Wickerhamomyces-Candidaclade。
3 讨 论
3.1 不同混合比例茅台酒糟与芭蕉叶对其青贮饲料养分含量的影响
本试验中,新鲜茅台酒糟的各养分含量均优于新鲜芭蕉叶,因此将两者进行混合青贮能够提高芭蕉叶的青贮品质。牧草种类、CP含量和WSC含量等因素都会影响青贮饲料的营养品质[18]。本研究结果显示,单一茅台酒糟青贮饲料(JCK组)的CP含量较高(19.11% DM),而单一芭蕉叶发酵饲料(BCK组)的CP含量较低(9.82% DM),茅台酒糟与芭蕉叶混合青贮后克服了芭蕉叶在CP含量上的不足,使混合青贮饲料中CP含量高于单一芭蕉青贮,这与陈冬梅等[19]、刘雯雯等[20]的研究结果一致。混合青贮CP含量增高可能与混合青贮组pH降低和LA含量升高有关,酒糟中残留的乙醇可促进LA发酵,使pH下降,进而抑制蛋白酶活性,从而降低蛋白质分解[21]。WSC是青贮发酵的重要底物,要有足够的可溶性糖分,乳酸菌才能产生足够数量的LA[22]。本研究中,混合青贮组青贮饲料中WSC含量与BCK组没有显著性差异,这与韩健宝[23]在添加啤酒糟对稻秸与桔子皮、干苹果渣和苜蓿混合青贮研究中的结果一致。此外,本试验中单一茅台酒糟青贮饲料的NDF含量较低,而单一芭蕉叶发酵饲料的NDF含量较高,通过在芭蕉叶中添加不同比例的茅台酒糟,混合青贮组的NDF含量随着茅台酒糟添加比例的提高而不断降低,这与赖思蓉等[24]的结果一致,即添加一定比例的酒糟能使NDF含量显著降低。由于J60B40组青贮饲料CP含量高,NDF和ADF含量低,所以J60B40组的青贮营养品质最好。青贮60 d后,茅台酒糟和芭蕉叶的CP和NDF含量比原料中的CP和NDF含量均有所下降,其原因是好氧腐败菌在发酵初期利用青贮袋中残留的氧气大量繁殖,从而消耗了青贮原料的营养物质。
3.2 不同混合比例茅台酒糟与芭蕉叶对其青贮饲料发酵品质的影响
研究表明,pH是反映青贮饲料优劣的一个重要指标,较低的pH可以确保青贮饲料良好的保存,优质青贮饲料的pH在3.8~4.2[25]。本研究结果显示,4个混合青贮组青贮饲料pH(4.05~4.11)都符合优质青贮饲料标准,且都显著低于BCK组,而显著高于JCK组。J40B60组、J60B40组和J80B20组青贮饲料LA含量显著高于BCK组,由此可见,在芭蕉叶中添加一定比例的茅台酒糟能够提高青贮饲料LA含量,这与李茂雅等[26]的研究结果一致,且其中J60B40组LA含量最高。PA在青贮过程中能够提高青贮饲料的有氧稳定性[27],本试验中混合青贮组青贮饲料PA含量均显著高于BCK组,说明茅台酒糟与芭蕉叶混合青贮可能会提高青贮饲料的有氧稳定性。研究表明,青贮发酵前期以同型乳酸菌发酵为主,后期以异型乳酸菌发酵为主,由于后期异型乳酸发酵菌的存在,所以会导致部分LA转化为AA,从而导致AA含量升高[28]。本试验中,所有组青贮饲料LA/AA值均大于3,说明可能均以同型乳酸菌发酵为主。NH3-N含量越高,说明蛋白质分解越多,意味着青贮过程中养分保存不好[29]。本试验中,茅台酒糟与芭蕉叶混合青贮组青贮饲料NH3-N含量均低于BCK组,表明在芭蕉叶中添加茅台酒糟进行混合青贮能够减少蛋白质分解,有效保存青贮中的养分。综上可知,由于J60B40组青贮饲料的LA含量最高,PA含量较高,AA含量最低,且NH3-N含量最低,所以J60B40组的青贮饲料发酵品质最好。
3.3 不同混合比例茅台酒糟与芭蕉叶对其青贮饲料微生物群落的影响
微生物种类和数量的变化会导致青贮品质发生变化。厚壁菌门中的细菌可以降解纤维素、淀粉和蛋白质等物质;变形菌门中的细菌会跟乳酸菌竞争发酵底物,影响青贮的发酵品质[30]。本研究中,JCK组青贮饲料的优势菌门为变形菌门,其余组的优势菌门为厚壁菌门,其次是变形菌门,这与黄媛等[31]的研究结果一致。由此表明,茅台酒糟与芭蕉混合青贮能够抑制青贮饲料中的有害菌,促进有益菌的生长。从属水平看,茅台酒糟或芭蕉单独青贮组的优势菌属均为其他,乳杆菌属和肠球菌属等有益菌属相对丰度较低,不适宜青贮[32]。J60B40组和J80B20组的优势菌属为乳杆菌属,相对丰度分别为72.76%和50.92%;而J40B60组的优势菌属为肠球菌属,因此得出在芭蕉叶中添加40%的茅台酒糟能够提高混合青贮饲料中的肠球菌属相对丰度。从微生物多样性的角度来看,茅台酒糟与芭蕉叶混合比例为6∶4时有益微生物相对丰度较高,其青贮品质较好。
青贮过程中有氧暴露会产生真菌[33]。目前关于青贮饲料中的真菌群落研究较少。在本研究中,从门水平真菌群落看,除J40B60组外,其余组青贮饲料的优势菌门均为子囊菌门,这与孙安琪[34]的研究结果一致。相较于BCK组,混合青贮组青贮饲料的子囊菌门相对丰度均有一定程度的降低。从属水平真菌群落看,所有组青贮饲料的优势菌属均为其他,其次是毕赤酵母属,且均含有少量的裂殖酵母属。研究表明,毕赤酵母属在青贮过程中可以利用LA进行发酵[35]。酵母菌和霉菌被认为是与青贮有氧变质有关的主要微生物,会导致营养和能量损失[36]。本试验中,未检测出超过1%的霉菌,但有较多的酵母菌,其中J40B60组的酵母菌相对丰度较低。
4 结 论
将茅台酒糟与芭蕉叶按一定比例混合青贮后能提高其青贮饲料营养品质和发酵品质,其中二者比例为6∶4时,青贮饲料CP和LA含量较高,pH以及NH3-N和NDF含量较低;混合青贮组青贮饲料中乳杆菌属等有益菌的相对丰度较高,不明菌群和有害菌的相对丰度较低。结合养分含量、发酵品质和微生物群落等指标综合分析,茅台酒糟与芭蕉叶混合比例为6∶4时,其混合青贮发酵品质较好。
