小续命汤对OGD/R诱导HT22细胞损伤后突触可塑性的影响*
2024-03-05王漫漫付雪琴邹旭欢王玮玮李泓宇
王漫漫, 兰 瑞, 张 勇, 付雪琴, 邹旭欢, 王玮玮,李泓宇, 唐 琛, 刘 双
(1河南中医药大学第一临床医学院, 河南 郑州 450046;2河南中医药大学第一附属医院脑病中心,河南 郑州 450099;3郑州大学第三附属医院中医科, 河南 郑州 450052)
脑卒中是全球范围内的第三大死因[1],已给家庭和社会带来沉重的经济负担[2]。缺血性脑卒中是一种由于脑血管闭塞、脑部供血减少造成神经功能障碍的中枢神经系统疾病[3]。许多神经保护剂在基础实验研究中表现出有益的作用,但均未在临床试验取得成功,而临床应用的溶栓药物及手术治疗因窗口狭窄及副作用大等原因,仅有少数病人能够得到及时的救治及处理[4-5]。因此,开发新的缺血性脑卒中治疗药物及方法是当务之急。
神经元主要以电信号的形式处理和传递信息,并通过功能单位突触与其他神经元连接形成大量的神经网络[6]。缺血性脑卒中后梗塞组织中神经细胞的变性及死亡导致机体神经功能丧失[7]。外部刺激后激活整个大脑中的神经元导致突触的结构/功能改变,称为突触可塑性[8]。后者可以编码和存储信息,有助于学习和记忆等认知功能。因此,促进突触可塑性可改善缺血性卒中后认知和运动功能的恢复,为治疗缺血性脑卒中的有效方法[9-10]。
小续命汤(Xiaoxuming decoction, XXMD)是我国的传统方剂,具有祛风通络、活血化瘀的功效[11]。前期研究显示,小续命汤可以通过减少线粒体自噬的激活、改善线粒体功能、预防血脑屏障破坏、神经损伤和抗凋亡等作用而减轻缺血性脑卒中损伤[12-14]。本研究通过建立体外脑缺血再灌注损伤(ischemiareperfusion injury, IRI)模型,将小鼠海马神经元细胞系进行氧糖剥夺/复氧(oxygen glucose deprivation/reoxygenation, OGD/R)处理,CCK-8 法检测细胞生存率,选取小续命汤最佳治疗浓度。同时观察细胞形态、炎症因子及超微结构变化,并检测突触相关蛋白神经丝200(neurofilament 200, NF200)和微管相关蛋白2(microtubule associated protein 2, MAP2)的荧光强度及表达水平,为XXMD 缓解脑缺血再灌注损伤提供新的实验依据。
材 料 和 方 法
1 试剂与材料
XXMD 相关中药颗粒购自河南中医药大学第一附属医院(中国新绿药科技发展有限公司);小鼠海马神经元细胞系(220825)购自河南省工业微生物菌种工程技术研究中心。DMEM 高糖培养基(C3110)、胎牛 血清(C04001)购 自BI;DMEM 无 糖培 养基(D6540)、CCK-8 试剂盒(CA1210)、电镜固定液(P1126)购自北京索莱宝生物科技有限公司;IL-1β(EK301B/3-96) ELISA 试剂盒购自杭州联科生物技术股份有限公司;IL-6 (88-50625-88)、TNF-α(88-7340-88) ELISA 试剂盒购自赛默飞世尔科技有限公司;BCA 蛋白测定试剂盒(092721211228)购自上海碧云天公 司;破膜液(G1204)、DAPI 染色试剂(G1012)、NeuN(GB11138)、Alexa Fluor 488 标记的山羊抗兔IgG (GB25303)、Cy3 标记的山羊抗兔IgG(GB21303)购自武汉赛维尔生物科技有限公司;MAP2 (GTX133109)购自GeneTex;NF200 (18934-1-AP)购自武汉三鹰生物技术有限公司;HRP 标记的山羊抗兔IgG (AB205718)购自Abcam。
2 实验仪器
超净工作台(ECO 0.9)和CO2细胞培养箱(371)购自Thermo;细胞缺氧小室(MIC-101)购自Billups-RothenbergInc;凝胶电泳仪(041BR304570)和化学发光凝胶成像仪(GelDoc XR)购自Bio-Rad;倒置荧光显微镜(Ti-E)购自Nikon;酶标仪(Synergy H1 型)购自BioTek。
3 中药及抑制剂的制备
将XXMD 颗粒溶于PBS,多次离心取上清,经0.22 μm 针式无菌过滤器过滤后,调整最终浓度为50 g/L。
4 细胞培养
将HT22 细胞从-80 ℃冰箱取出后,快速溶解并加入2 mL 含10% FBS 的高糖DMEM,1 000×g离心5 min,弃上清,再次加入高糖DMEM 置于37 ℃、5%CO2环境中培养,待长至约80%时进行传代,第5 代细胞开始用于造模。
5 主要实验方法
5.1 氧糖剥夺/复氧模型的构建 将细胞按照每孔1×105均匀铺至12 孔板培养24 h。XXMD 分别按照0、25、50、100、200 mg/L 的浓度溶解于无糖培养基中,每孔加入含不同浓度XXMD无糖培养基1 mL,放入含95% N2、1% O2、4% CO2的缺氧小室中缺氧3 h,再更换为含有不同XXMD 浓度高糖完全培养基于5% CO2、37 ℃环境中复氧24 h。正常组细胞常规培养至其他组复氧结束。
5.2 CCK-8 检测细胞活力 将细胞以每孔1×104个细胞的密度接种在96孔板中24 h。复氧结束后每孔加入10 μL CCK-8 溶液,孵育0.5 h。取出96 孔板,在450 nm 处测量吸光度(A)值。细胞活力计算如下:细胞活力(%)=(实验组A值/空白组A值)×100%。
5.3 倒置荧光显微镜观察 将复氧24 h 后的HT22细胞置于倒置荧光显微镜下,观察各组细胞形态变化,拍照。
5.4 ELISA 收集各组HT22细胞,加入PBS进行匀浆,12 000 ×g,离心5 min,弃沉淀,采用ELISA 试剂盒检测细胞上清液中IL-1β、IL-6、TNF-α水平。
5.5 透射电镜 将各组细胞使用PBS 冲洗3 次后,加入电镜固定液常温固定5 min,用细胞刮刀沿一个方向轻轻刮取,将细胞液吸至离心管,1 000 ×g,离心5 min。弃上清,再次加入1 mL 电镜固定液,送至武汉赛维尔科技有限公司进行拍照。
5.6 免疫荧光染色 将各组细胞使用PBS冲洗3次后,加入4%多聚甲醛固定10 min,PBS 冲洗2 次,取出细胞爬片,加70 μL破膜工作液,室温孵育20 min,PBS洗3次,每次5 min。血清封闭30 min,加入NeuN或突触及通路相关蛋白4 ℃孵育过夜,PBS 清洗3次,加入Alexa Fluor 488 标记山羊抗兔IgG、CY3 标记山羊抗兔IgG 室温孵育50 min。PBS 洗涤3 次,滴加DAPI 染液,避光室温孵育10 min。抗荧光淬灭封片剂封片,最后进行图像采集。
5.7 Western blot 将各组细胞用PBS 冲洗3 次后,刮取细胞,离心弃上清,加入80 μL RIPA 冰上裂解1 h,BCA 定量后加入4×Buffer,上样后1×SDS 150V 1 h,240 mA转膜1.5 h,5%奶粉分封闭2 h,Ⅰ抗4 ℃过夜,TBST 5 min 6次,Ⅱ抗孵育1 h,洗膜显影。
6 统计学处理
使用SPSS 23.0 进行统计学分析,数据以均数±标准差(mean±SD)表示。符合正态分布后使用单因素方差分析(one way-ANOVA)进行统计学分析。P<0.05为差异具有统计学意义。
结 果
1 不同浓度的XXMD 对OGD/R 后HT22细胞活力的影响
通过CCK-8 测定各组HT22 细胞活力,初步探讨了XXMD 对OGD/R 作用下的HT22 细胞的保护作用,并筛选出最佳作用浓度。HT22 细胞在相同的OGD/R 条件下,不同浓度(25 mg/L、50 mg/L、 100 mg/L、200 mg/L)XXMD干预后,与未干预时相比,细胞活力均有不同程度的提高,其中XXMD 浓度为100 mg/L 细胞活力达到最高,作用效果最佳(P<0.05),见图1。因此选取100 mg/L的浓度用于以下实验。

Figure 1. The viability of HT22 cells in each group. Mean±SD.n=3. *P<0.05 vs0 mg/L XXMD group.图1 各组HT22细胞活力
2 XXMD对OGD/R HT22细胞形态的影响
倒置荧光显微镜观察结果显示,对照组细胞密度较大,胞体完整呈扁平样长梭形,折光性较强;经OGD/R 处理后,细胞形态破环严重,出现变圆、皱缩,突触间连接数量减少;OGD/R+XXMD 组在复氧结束后表现为出与空白组细胞相似的形态特征,突触连接交织呈网状。见图2。
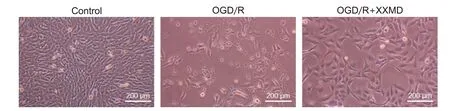
Figure 2. Morphological changes of HT22 cells in each group (scale bar=200 μm).图2 各组HT22细胞形态变化
3 HT22细胞上清液炎症因子水平变化
通过ELISA 测定HT22 细胞上清液中IL-1β、IL-6、TNF-α 水平,探讨了XXMD 对OGD/R 诱导的神经炎症的保护作用,见图3。与对照组相比,OGD/R 处理后炎症因子IL-1β、IL-6、TNF-α 平均水平分别从142.58 ng/L、69.86 ng/L、217.98 ng/L 显著升高至377.43 ng/L、211.72 ng/L、644.54 ng/L (P<0.05)。而XXMD 干预后,与模型组相比,IL-1β、IL-6、TNF-α平均水平显著下降至244.61 ng/L、135.01 ng/L、386.67 ng/L (P<0.05)。

Figure 3. The levels of inflammatory factors in HT22 cells of each group. Mean±SD. *P<0.05 vs Control group; #P<0.05 vs OGD/R group.图3 各组HT22细胞炎症因子水平
4 透射电镜观察细胞超微结构变化
透射电镜观察:对照组线粒体边界及结构清晰,基质均匀,嵴排列整齐,未见明显的肿胀变化。模型组HT22 细胞线粒体结构模糊,水肿,部分线粒体嵴断裂、减少,呈空泡样改变;溶酶体及自噬体数量异常。高浓度XXMD 处理组线粒体结构有所改善,受损伤线粒体数量及自噬体较模型组减少。见图4。
5 免疫荧光染色检测细胞突触相关蛋白的荧光强度
结果显示,与对照组相比,OGD/R 损伤后的HT22 细胞神经元标志物NeuN 阳性细胞较少,且NeuN 及突触相关蛋白NF200、MAP2 的平均荧光强度明显降低 (P<0.05);而XXMD 可以提高损伤细胞中NeuN 阳性细胞数量,显著提升NeuN、NF200 及MAP2平均荧光强度(P<0.05),见图5、图6。

Figure 5. The NF200 fluorescence level detected by immunofluorescence staining. The NeuN (green) and NF200 (red) were determined by double immunofluorescence staining (scale bar=50 μm, zoom scale bar=10 μm), and quantitative analysis of mean fluorescence intensity of NeuN and NF20 was shown. Blue: DAPI. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs OGD/R group.图5 免疫荧光染色检测NF200荧光水平
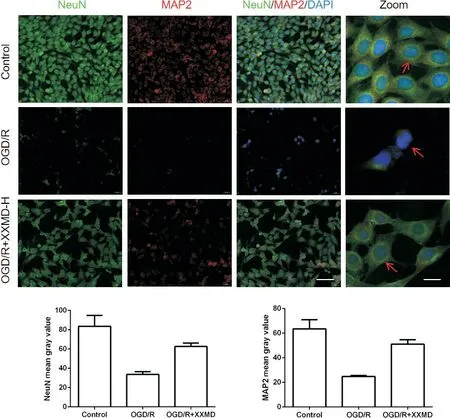
Figure 6. The MAP2 fluorescence level detected by immunofluorescence staining. The NeuN(green) and MAP2(red) were determined by double immunofluorescence staining (scale bar=50 μm, zoom scale bar=10 μm), and quantitative analysis of mean fluorescence intensity of NeuN and MAP was shown. Blue: DAPI. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs OGD/R group.图6 免疫荧光染色检测MAP2荧光水平
6 Western blot检测细胞突触相关蛋白表达水平
Western blot 检测各组细胞突触相关蛋白NF200、MAP2 的表达。与对照组相比,NF200、MAP2蛋白的表达水平显著降低(P<0.05);高浓度XXMD干预后NF200、MAP2 蛋白的表达量均显著高于模型组 (P<0.05),见图7。
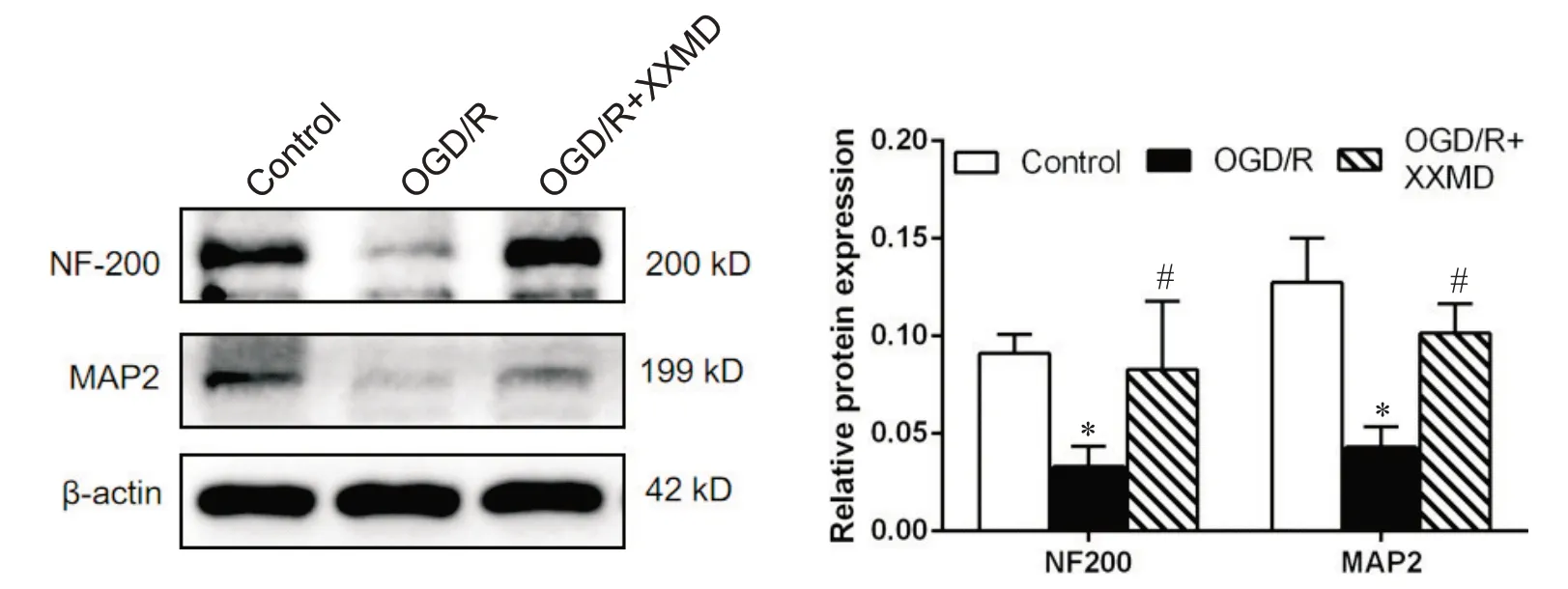
Figure 7. The levels of synapse-associated proteins NF200 and MAP2 detected by Weston blot. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs OGD/R group.图7 Western blot检测各组突触相关蛋白NF200和MAP2水平
讨 论
脑卒中是人类严重、长期残疾的主要原因之一。脑卒中可分为两种不同类型:缺血性中风和出血性中风,其中缺血性脑卒中占87%左右[15]。当发生局灶性缺血性中风时,缺血核心区的脑血流量低于正常的20%。脑灌注量减少会限制葡萄糖和氧气的输送,损害离子梯度所需的能量,并导致神经胶质和神经元膜电位的丧失[16]。缺血半暗带区域保留了部分能量代谢及结构完整性,但功能丧失或受损。核心区的细胞可能经历着永久性缺氧去极化,而缺血半暗带的细胞需要更多能量复极化。但由于持续的兴奋性毒性、炎症和细胞凋亡,缺血半暗带区域可能进展为梗死核心,挽救缺血半暗带成为神经保护的目标之一[16]。在过去20 年中,缺血性脑卒中死亡率迅速下降,但由于缺乏有效治疗手段,缺血性脑卒中后的残疾人数却逐步增加。因此,缺血性脑卒中的预防和治疗亟待进一步研究。
XXMD 作为治疗缺血性脑卒中的经典名方,为历代医家所推崇[17]。现代医学研究表明,XXMD 能够扩大脑组织供血量,降低毛细血管的通透性,抗炎抗凋亡及调节自噬等方面均具有保护神经细胞、促进恢复神经功能的作用[13-14,18-19]。Liu 等[20]报道了XXMD 可以通过抑制AGE-RAGE 信号通路,下调HMGB1、TLR4 和p-p65 的表达,减轻炎症因子的释放和中性粒细胞浸润,从而改善神经炎症。Wu 等[19]报道了XXMD 可以通过下调Nix、PINK1 及Parkin 蛋白表达减少线粒体自噬,进而保护神经元病理损伤。上述研究结论与本研究结果基本一致,证实了XXMD 对大脑神经元的保护作用。不同的是,我们的研究结果主要侧重于阐明XXMD 对神经元突触可塑性的作用及机制。
突触作为神经元之间传递信息的基本结构,是保持神经网络活动和正常大脑功能的关键。大脑受到外部刺激后,神经递质从突触前轴突释放到突触间隙,结合并激活突触后树突上的受体传递信号。虽然大多数神经元及轴突和树突结构可以在成熟的大脑中保持稳定,但它们之间的突触连接却并不稳定[21]。在缺血性脑卒中期间,正常神经元及突触功能的破坏,突触密度显著降低并出现运动功能障碍,记忆和认知能力下降等症状[22]。NF-200 和MAP2 作为神经元的主要细胞骨架成分,通常在轴突和树突中表达[23-24]。NF-200 在促进轴突的生长、维持和再生方面发挥着关键作用,从而成为评估中枢神经系统形态学改变和轴突修复或生长状态的指标[25-26]。MAP2 的主要功能在于通过调节微管之间的间距来促进树突棘的稳定性,并可以增强神经元轴突和树突的生长、分化、凋亡和可塑性[27]。本研究成功建立体外脑缺血再灌注模型,并进一步证实了OGD/R 可以下调HT22 细胞中突触相关蛋白NF200、MAP2 的表达,同时引起神经元细胞损伤,具体表现为细胞变圆皱缩、细胞间隙增大,生存率下降,炎症因子IL-1β、IL-6、TNF-α 水平升高及超微结构破坏严重等。这提示OGD/R 诱导的HT22 细胞损伤可能与炎症反应与突触功能的破坏相关。
既往研究发现,缺血性脑卒中发生后,可在一定时间段内观察到调控促进神经元生长、突触发生、轴突及树突增殖等基因和蛋白表达的自发性上调,这些与突触可塑性的增强及机体记忆及功能的自发性恢复有关[28]。突触可塑性作为是神经系统适应外部环境和内部生理变化的必要手段,是缺血脑卒中后记忆的形成和恢复的关键参与者[29]。如何提高脑卒中损伤后的突触可塑性,成为当今神经科学和康复医学研究的热点问题。因此,我们进一步使用NF200、MAP2 作为突触可塑性的主要观察指标,用于XXMD 机制的研究。结果显示,XXMD 可以有效逆转OGD/R 对HT22 细胞的形态、超微结构的损伤,减轻炎症因子水平,并上调NF200、MAP2 的荧光强度及蛋白表达。通过上述实验,表明XXMD 可以改善OGD/R诱导的神经炎症,增强突触可塑性。
综上所述,本研究证实了XXMD 可以有效抑制缺血性脑卒中后神经元炎症反应,增强突触可塑性。其作用机制为改善神经元超微结构,降低IL-1β、IL-6、TNF-α 平均水平,上调NF200、MAP2 的表达,从而发挥神经元保护的重要作用。
