类视黄醇X受体对缺氧/复氧诱导的大鼠II型肺泡上皮细胞氧化应激反应的调控作用*
2024-03-05王肖婷徐俊鹏陈思安张淇昊曹文傑田云娜王万铁
王肖婷, 徐俊鹏▲, 黄 曼, 陈思安, 张淇昊, 曹文傑,田云娜, 高 慧, 王万铁△
(1温州医科大学缺血/再灌注损伤研究所,浙江 温州 325035;2河南大学附属淮河医院病理科,河南 开封 475000)
肺原发性移植物功能障碍是一种严重的急性肺损伤,导致肺移植后早期发病率和死亡率增加,其发病机制主要是肺缺血再灌注损伤(lung ischemia-reperfusion injury, LIRI)[1]。临床上大量肺移植、心肺复苏等手术应用的同时,也大大提高了LIRI 的发生率,由于目前临床上尚无有效的防治措施,严重影响患者的预后康复甚至威胁生命。
LIRI的病理生理机制复杂,一个特定器官由于缺血引起的组织损伤往往会在再灌注时进一步加剧,这一过程比缺血本身更加有害。这一过程需要有氧的存在、血管、体液以及细胞因子的激活和维持[1],机体在各种有害刺激下,发生氧化应激反应,产生并聚集大量活性氧(reactive oxygen species, ROS),引发一系列细胞和组织病理性反应。当机体遭受不良刺激时,ROS 可在II 型肺泡上皮细胞(type II alveolar epithelial cells, AECII)、内皮细胞、肺泡巨噬细胞等肺组织细胞中的积聚,通过核因子κB(nuclear factorκB, NF-κB)等转录因子激活炎症过程,引起染色质重塑和促炎症介质基因的表达,从而加剧氧化应激反应,引起肺组织损伤[2-3]。
类视黄醇X 受体(retinoid X receptor, RXR)是继视黄酸受体之后发现的又一类核受体,主要包括3个亚型,其中以RXRα 研究最为充分。近年来,对RXR 的研究越来越多,人们对于RXR 的作用不断有了新的认识。研究表明,RXR 广泛参与肿瘤、糖尿病、心血管疾病等疾病过程[4-5]。研究报道,RXR 激动剂可以通过抑制蛋白激酶C 途径来增强细胞抗氧化能力,削弱高糖诱导下血管内皮细胞产生的氧化应激反应,其机制可能与RXRα 的抗氧化应激效应有关[6]。AECII是LIRI中主要的效应细胞,故本研究以大鼠AECII 为主要研究目标,通过建立细胞缺氧/复氧(hypoxia/reoxygenation, HR)损伤模型,模拟在体LIRI[7-8],旨在进一步明确氧化应激在HR 损伤中的发生机制;同时以RXR 为研究靶点,通过RXR 激动剂和抑制剂对AECII 进行预处理,研究RXR 在肺HR 损伤诱导的氧化应激反应过程中的可能作用及其调控机制,从而为在体LIRI的防治提供参考。
材 料 和 方 法
1 实验细胞
大鼠AECII 系购自武汉普诺赛生命科技有限公司。
2 主要试剂及仪器
高糖DMEM 培养液、胎牛血清、青-链霉素混合液、PBS、0.25%胰酶(含EDTA)和无血清细胞冻存液为进口分装或国产分析纯;RXR 激动剂9-顺式视黄酸(9-cis-retinoic acid, 9-RA)和RXR拮抗剂HX531购自Sigma;CCK-8 试剂盒购自Dojindo;抗表面活性物质蛋白A(surfactant protein A, SP-A)、RXRα 和核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)抗体购自Abcam;Nrf2 引物设计合成购自上海生工生物工程股份有限公司;即用型BCA 蛋白定量试剂盒购自上海雅酶生物医药科技有限公司;总超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(WST-1 法)和丙二醛(malondialdehyde, MDA)测定试剂盒(微板法)购自南京建成生物工程研究所。
凝胶成像系统(Bio-Rad);高通量荧光定量PCR仪(ABI);透射电镜(Hitachi)。
3 主要方法
3.1 实验分组及ACEⅡ缺氧/复氧模型的制备 按照随机原则将细胞分为:(1)对照(control, C)组:含10%胎牛血清的高糖DMEM 培养液常氧箱内培养30 h;(2)HR 组:低氧箱内(参数37 ℃,1% O2)无糖无血清DMEM 培养液处理细胞6 h 后,使用无血清的DMEM 培养液常氧箱内正常培养24 h;(3)HR+溶剂二甲基亚砜(dimethyl sulfoxide, DMSO)组(HD 组):在缺氧造模前用含终浓度低于0.1% DMSO 的无血清培养液处理1.5 h;(4)HR+9-RA 组(RA 组):用含9-RA(100 nmol/L)的无血清培养液预处理细胞1 h,之后进行缺氧/复氧处理;(5)HR+HX531组(HX组):在缺氧造模前先用100 nmol/L 的9-RA 预处理细胞0.5 h,再用2.5 μmol/L 的HX531 预处理1 h,其余处理同HR组。HR模型参考其他学者研究方法及在本实验室前期研究基础上[7-10],通过预实验多次实践再进行整合改进构建大鼠缺氧/复氧模型。细胞缺氧处理用无糖无血清培养液培养并放置于低氧箱6 h后再用不含血清的高糖DMEM 培养液,放置常氧箱恢复氧气培养24 h。
3.2 免疫荧光标记法 用4%多聚甲醛固定细胞,经打孔处理后,进行封闭处理,滴加相应Ⅰ抗(Nrf2,1∶1 000)后放于湿盒内避光,4 ℃冰箱孵育过夜,PBS洗涤3 次后用对应的荧光Ⅱ抗(1∶5 000)室温避光孵育1 h 后,再次PBS 充分洗涤3 次,使用DAPI 对核进行染色,封片,并在正置荧光显微镜下观察并拍片。
3.3 CCK-8 实验 根据CCK-8 试剂盒说明书进行实验,按照VCCK-8∶V培养液=1∶10 进行混合。96 孔板每孔加入110 μL CCK8 和培养液的混合液,37 ℃孵育1 h,450 nm测每孔的吸光度(A)值。
3.4 检测细胞SOD 活性 首先,用蛋白酶抑制剂PMSF+RAPI 法提取细胞蛋白样品,用BCA 法测蛋白浓度,再按照SOD 试剂盒使用说明步骤对试剂反应液进行配制和添加,水浴锅37 ℃孵育30 min 后立即在酶标仪450 nm 处测定A值,计算SOD 活性。SOD活性(U/mg)=SOD 抑制率/50%×反应体系稀释倍数(0.24 mL/0.02 mL)/待测样品蛋白浓度(mg/mL),SOD 抑制率(%)=[(A对照-A对照空白)-(A测定-A测定空白)]/(A对照-A对照空白)×100%。
3.5 检测细胞MDA 含量 提取细胞蛋白并测定蛋白浓度。按照试剂盒说明书滴加反应液,EP 管用针头刺一小孔,放于水浴锅95 ℃高温孵育40 min,流水下冲洗使之逐渐冷却,离心机2 680×g进行离心15 min,吸取200 μL 上清液在96 孔板中,酶标仪立即测定各管在532 nm处的A值,计算MDA 含量。MDA 含量(nmol/mg)=(A测定-A对照)/(A标准-A空白)×标准品浓度(10 nmol/mL)/待测样品蛋白浓度(mg/mL)。
3.6 透射电镜观察细胞超微结构的变化 用1 mL戊二醛固定液固定细胞,放到4 ℃冰箱过夜。隔日用PBS 放置摇床上洗3 次后,按照1%锇酸后固定,1%醋酸铀块染,丙酮梯度脱水、浸透,环氧树脂812 包埋剂包埋聚合的顺序依次进行,然后超薄切片,最后透射电镜下观察并拍摄。
3.7 RT-PCR 检测Nrf2 的mRNA 表达 使用Trizol法提取细胞总RNA。将RNA 逆转录成cDNA,然后进行PCR 扩增。扩增结束用2.0%琼脂糖凝胶对其进行电泳,然后全自动凝胶成像系统曝光成像半定量分析。Nrf2 的上游引物序列为5'-GAAAAGAAGTGGGCAACTGTGG-3',下游引物序列为5'-GGTGGGATTTGAGTCTAAGGAGGT-3',扩增产物长度为117 bp;内参照GAPDH 的上游引物序列为5'-ATTGCCGACAGGATGCAGAA-3',下游引物序列为5'-GAATGTGGATAGGCTGGCGA-3'。
3.8 Western blot 检测Nrf2 蛋白表达 造模结束后立即按照VPMSF∶VRAPI裂解液=1∶100 配制裂解混合液,冰上裂解细胞30 min 后收集6 孔板裂解液,超声后离心收集细胞上清液并用BCA 法测定蛋白浓度,加入上样缓冲液后金属孵育器(100 ℃)孵育10 min变性。依次经电泳仪电泳,转膜(湿转)、10%脱脂牛奶封闭2 h,Tris-HCl 缓冲盐溶液+Tween 20 (TBST)洗膜3次,Nrf2 抗体(1∶1 000)4 ℃孵育过夜。TBST 充分洗涤后,Ⅱ抗(1∶10 000)室温孵育1 h,TBST 洗膜3 次,滴加适量ECL 发光液(VA液∶VB液=1∶1),用化学发光成像系统进行曝光拍摄,半定量分析。
4 统计学处理
采用GraphPad Prism 9 统计软件进行数据分析。所有计量资料以均数±标准差(mean±SD)表示。数据服从正态分布,则多组样本均数间的比较使用单因素方差分析评估统计意义;否则,使用Kruskal-Wallis检验来评估统计学意义。以P<0.05为差异有统计学意义。
结 果
1 免疫荧光标记法鉴定AECII
用免疫荧光标记法检测AECII 的特异性表达标志物SP-A。荧光显微镜观察结果显示:蓝色荧光为细胞核,红色荧光为SP-A蛋白位置,定位于AECII细胞核周边,证实本实验细胞为AECII,见图1。

Figure 1. Identification of type II alveolar epithelial cells. Blue arrow: nucleus; yellow arrow: surfactant protein A(SP-A).图1 免疫荧光标记法鉴定II型肺泡上皮细胞的结果
2 CCK-8检测AECII活力
与C组比较,其余四组细胞的A值可见显著下降(P<0.05);与HR 组比较,RA 组的A值显著升高(P<0.05);与RA 组比较,HX 组的A值显著降低(P<0.05);而HR、HD 和HX 三组两两相比,A值无显著差异(P>0.05),见图2。

Figure 2. The changes of absorbance value in all groups. Mean±SD. n=5. ▲P<0.05 vs C group; #P<0.05 vs HR group; *P<0.05 vs RA group.图2 CCK-8检测结果
3 免疫荧光标记法检测AECII中RXRα表达
与C组相比,其余四组细胞中的RXRα含量显著增加(P<0.01);与HR 组相比,RA 组的RXRα含量增加(P<0.01);与RA 组对比,HX 组细胞的RXRα含量显著降低(P<0.01);而HR、HD、HX 三组两两相比,细胞中RXRα含量无显著差异(P>0.05),见图3。
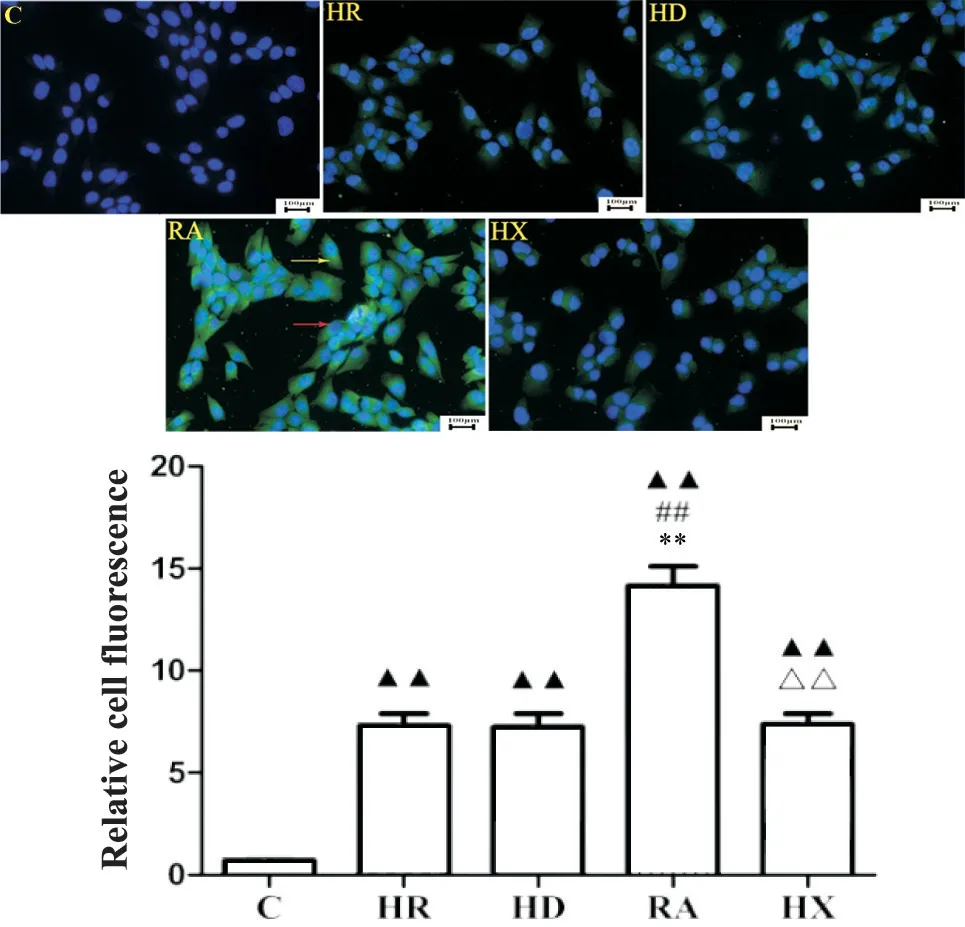
Figure 3. The RXRα expression was detected by immunofluorescence staining (scale bar=100 μm). Mean±SD. n=5. ▲▲P<0.01 vs C group; ##P<0.01 vs HR group;**P<0.01 vs HD group; △△P<0.01 vs RA group.图3 免疫荧光标记法检测RXRα表达结果
4 AECII中的SOD活性和MDA含量
与C 组相比,HR、HD、RA 和HX 这4 组在相应处理后细胞的SOD 活性均下降(P<0.05),而此4 组细胞MDA 的表达上升(P<0.05);与HR 组相比,RA 组的SOD 活性增高(P<0.05),而MDA 表达下降(P<0.05);与RA 组相比较,HX 组细胞的SOD 活性减少(P<0.05),细胞中MDA 表达增加(P<0.05);而HR、HD 和HX 三组两两相比,SOD 活性及MDA 含量的变化无显著差异(P>0.05),见图4。

Figure 4. Changes of SOD activity (A) and MDA content (B) in each group. Mean±SD. n=5. ▲P<0.05 vs C group; #P<0.05 vs HR group; *P<0.05 vsRA group.图4 SOD活性和MDA含量检测结果
5 透射电镜观察AECII超微结构
透射电镜下看见,C组肺泡细胞结构未见明显异常,可见丰富的板层小体;与C 组相比,剩余四组肺泡细胞内部可见结构出现不同程度的紊乱。其中HR、HD 和HX 三组AECII 内线粒体发生高度肿胀,线粒体嵴线溶解甚至消失,偶见变异性的增生,板层小体变性,出现空泡化现象;RA 组相较于HR、HD 和HX三组,AECII损伤减弱,板层小体数目增多且空泡化现象减少,线粒体结构相对较为完整,线粒体仅出现轻微肿胀且线粒体嵴清晰。见图5。
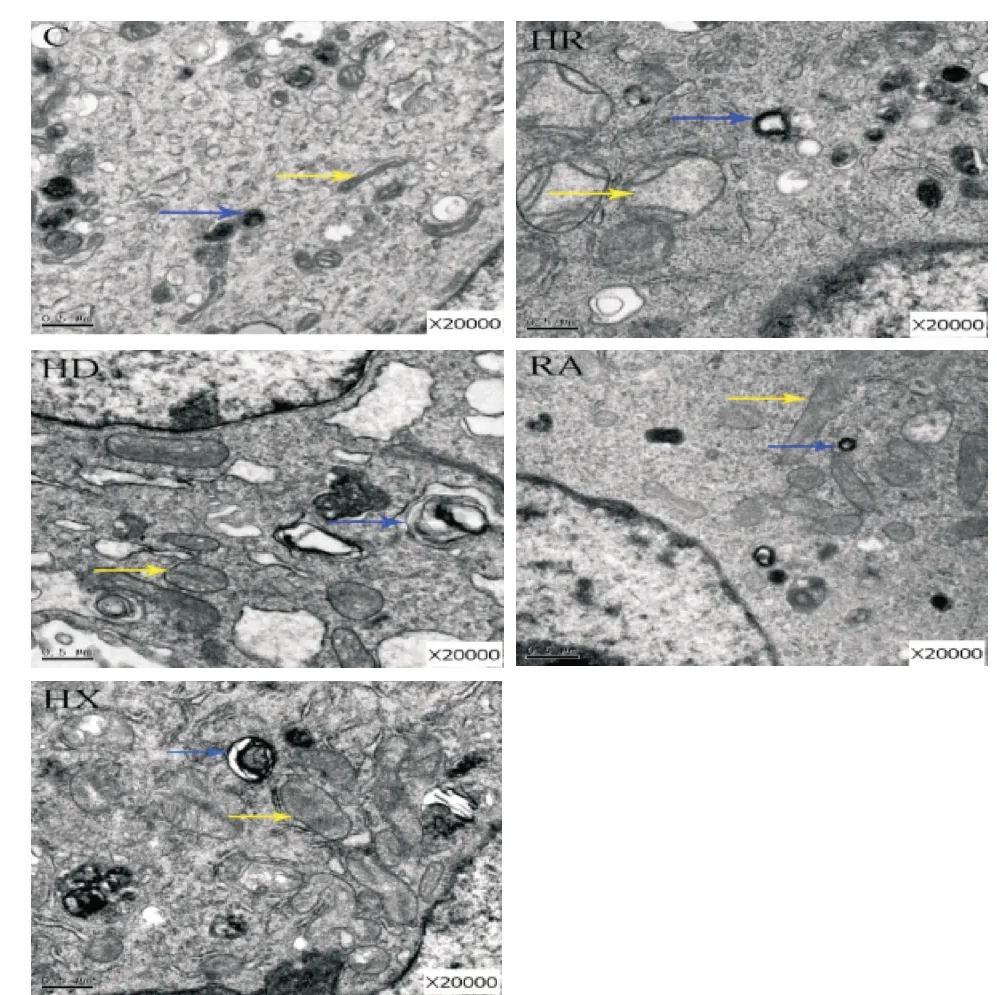
Figure 5. Ultrastructure of the cells under electron microscope.n=5. Scale bar=0.5 μm. The yellow arrow indicates mitochondria, and the blue arrow indicates lamellar bodies.图5 透射电镜观察结果
6 AECII中Nrf2表达
RT-PCR 检测结果显示,与C 组相比,HR、HD、RA 和HX 这四组的Nrf2 mRNA 表达均显著减少(P<0.01);与HR和HD组相比,RA组的Nrf2 mRNA表达显著增加(P<0.01);与RA 组相比,HX 组表达下降(P<0.01);HR、HD 和HX 三组两两相比,各组细胞Nrf2 mRNA表达改变无显著差异(P>0.05),见图6。
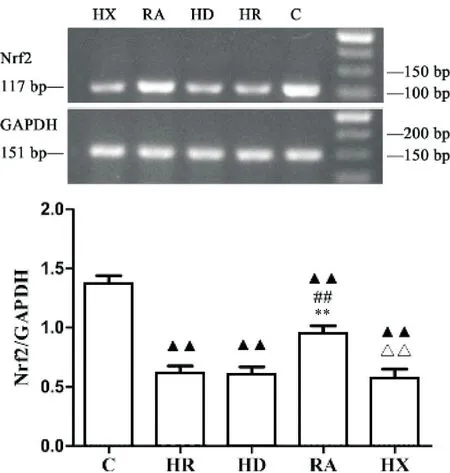
Figure 6. The mRNA expression of Nrf2 in each group. Mean±SD. n=5. ▲▲P<0.01 vs C group; ##P<0.01 vs HR group; **P<0.01 vs HD group; △△P<0.01 vs RA group.图6 RT-PCR检测结果
与C 组相比,剩余四组细胞中Nrf2 蛋白的表达下降(P<0.05);与HR 和HD 组相比,RA 组的Nrf2 蛋白表达显著升高(P<0.01);与RA 组相比,HX 组表达下降(P<0.01);HR、HD 和HX 三组两两相比,Nrf2蛋白表达变化无显著差异(P>0.05),见图7。
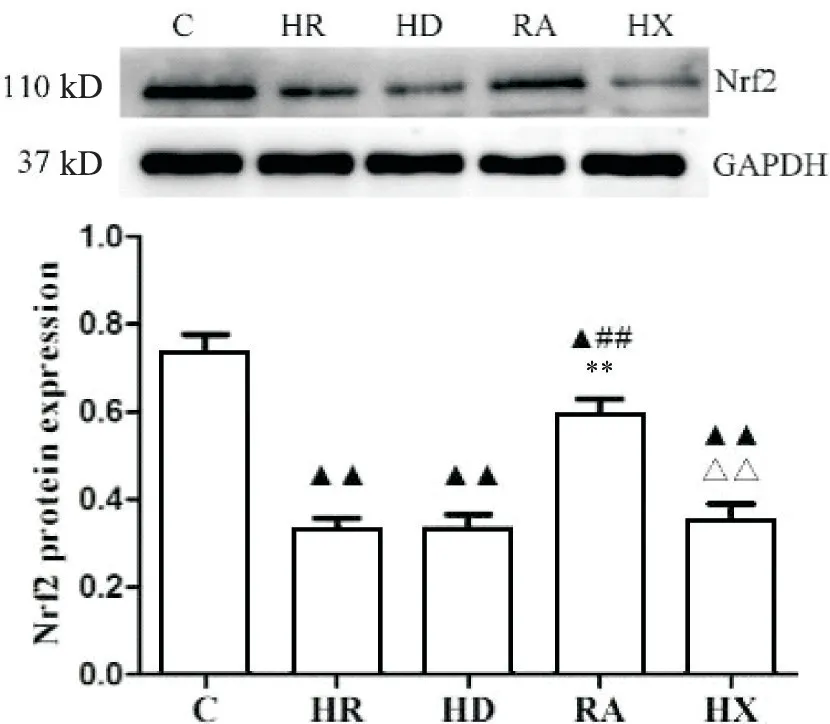
Figure 7. The protein expression of Nrf2 in each group. Mean±SD. n=5. ▲P<0.05, ▲▲P<0.01 vs C group; ##P<0.01 vs HR group; **P<0.01 vs HD group; △△P<0.01 vs RA group.图7 Western blot检测结果
讨 论
氧化应激反应是肺缺血再灌注损伤重要的发生机制,其产生病理性损害的直接原因是ROS的积聚,ROS 是一种高度不稳定的氧分子,肺内大量自由基的增加,使导致肺细胞结构以及功能的异常,伴随细胞通透性增加、肿胀甚至溶解坏死,肺毛细血管通透性异常,大量组织液无法及时被系统吸收,最终发展为肺水肿[11]。在病理条件下,大量自由基的迅速堆积引起自由基清除系统超负荷工作而被迫"瘫痪",必然引起细胞的损伤[12]。目前研究认为,Nrf2 在细胞介导的抗氧化应激防御反应中发挥着不可或缺的重要作用[13]。另外, SOD是一种抗氧化酶,在氧化应激反应的缓冲中占有关键地位,具有清除ROS 的特殊功能。机体发生氧化应激反应时,抗氧化机制无法满足机体的正常运转需求,必然造成脂质过氧化反应,从而生成降解产物MDA,引起细胞结构的损伤[14]。MDA的含量也可以反映机体内脂质氧化的程度。本实验通过测定细胞SOD、MDA 和Nrf2 来检测细胞损伤程度,结果表明,与C 组比较,HR、HD、RA和HX 四组的MDA 含量均升高,SOD 活性和Nrf2 mRNA 及蛋白表达水平均下降。另外,细胞活力呈下降趋势,细胞超微结构也发生损伤性改变,表明缺氧/复氧作为诱因引发了氧化应激反应,最终导致大鼠AECII损伤性改变。
RXR 是细胞核激素受体超家族中的重要成员之一,已经证实RXR 是由位于人类9 号染色体(RXRA,又称NR2B1)、6号染色体(RXRB、NR2B2)和1号染色体(RXRG,NR2B3)三个不同基因编码[15]。RXR 可以与甲状腺素受体(thyroid hormone receptor, TR)、维生素D 受体(vitamin D receptor, VD)等受体结合形成二聚体,发挥不同的生物学效应。RXRα作为其重要的分型之一,广泛表达于多个脏器,参与多种疾病的发生发展。RXRα的抗氧化应激效应,维护细胞稳定等特性已被得到证实[6]。本实验通过运用RXR 激动剂9-RA 和RXR 拮抗剂HX531 来干预,结果显示,与HR、HD 和HX 组相比,RA 组的MDA 含量显著降低,SOD 活性、Nrf2 mRNA 及蛋白表达水平升高,细胞活力上升,细胞损伤程度减轻。而在应用RXR 拮抗剂HX531 后,上述作用被成功阻断。这些结果证明激动RXR 在一定程度上可通过抑制氧化应激反应,对HR损伤的大鼠AECII起到一定保护作用。
综上所述,HR 可加剧大鼠AECII 的氧化应激反应,而激动RXR 在一定程度上减轻了大鼠AECII 的HR 损伤,提示其机制可能与抑制氧化应激反应有关。本研究为在体肺缺血/再灌注损伤的防治提供了新的有效干预靶点。
