高糖条件下氧化应激-AMPK-Cx43-NLRP3途径调节大鼠胃平滑肌细胞外基质重构的机制研究*
2024-03-05张高源宋佰慧包伊特格乐张默函
张高源, 宋佰慧, 包伊特格乐, 张默函△
(1延边大学医学院组织胚胎学教研室,吉林 延吉 133000;2长春医学高等专科学校,吉林 长春 130031)
胃动力来源于平滑肌细胞的协同收缩运动,而细胞间的相互关系对平滑肌运动的影响是不可忽视的。正常状态下胃平滑肌细胞外表面环绕着细胞外基质(extracellular matrix, ECM),具有机械连接、限制肌细胞过度伸展及影响细胞间信息传递的作用。前期研究发现,糖尿病胃轻瘫(diabetic gastroparesis, DGP)大鼠胃平滑肌自主收缩运动振幅下降、频率变慢,且存在ECM 重构[1],表明高糖(high glucose, HG)通过诱导ECM重构降低了胃平滑肌的自主收缩功能。
缝隙连接蛋白43(connexin 43, Cx43)是最常见的缝隙连接蛋白,通常形成缝隙连接通道、半通道或以蛋白单体形式存在,在细胞增殖、凋亡和炎症中起重要作用。Sun 等[2]研究发现,HG 条件下Cx43 过表达能够抑制NRK-52E 细胞ECM 中纤连蛋白(fibronectin)、I型胶原(collagen type I, Col I)和Col IV 的表达,而Cx43 缺乏则具有相反的效果。另外,Huang等[3]研究发现,小鼠巨噬细胞内氧化应激状态通过Cx43调节促进核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)活化,且Cx43 表达增加,NLRP3 表达增加,反之Cx43 表达减弱,NLRP3 表达下降。这表明在细胞中Cx43 的异常表达可能通过NLRP3 参与调控细胞ECM 改变。AMP 活化蛋白激酶(AMP-activated protein kinase, AMPK)广泛存在于机体各种组织,其活性表现为磷酸化AMPK。前期研究发现,HG 通过氧化应激诱导AMPK 活性的改变[4]。Li 等[5]发现,HG 条件下心肌细胞Cx43 蛋白表达降低,给予apelin 后可逆转;而沉默AMPKα可消除apelin 对Cx43 的作用。而Chen 等[6]发现,apelin-13能够通过激活AMPK 抑制血管紧张素II 以浓度依赖性方式降低Cx43在HL-1细胞中的表达。这表明HG条件下AMPK 能够调控Cx43 的表达且作用明显。AMPK还参与ECM的分泌和重塑的调控。Wang等[7]发现,AMPK 活化能够显着减轻转化生长因子β1(transforming growth factor-β1, TGF-β1)介导的肾缺血再灌注损伤的肾小管间质纤维化。而Cho 等[8]发现,活化的AMPK 能够缓解糖尿病小鼠中TGF-β 诱导的神经纤维ECM 变化。因此,本研究以体外培养的原代大鼠胃平滑肌细胞为研究对象,探讨氧化应激-AMPK-Cx43 参与调节ECM 重构的相关机制,旨在进一步阐明DGP 的发病机理,为防治DGP 及糖尿病其它平滑肌病变的药物研发提供实验依据。
材 料 和 方 法
1 细胞
大鼠原代胃平滑肌细胞购于iCell。
2 主要试剂
Col III 抗体(BOSTER);Col I 抗体(Bioss);Cx43抗体(Cell Signaling Technology);NLRP3、基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)、p-AMPK、嘌呤能P2X7 受体(purinergic P2X7 receptor, P2X7R)和TGF-β1 抗体(Abcam);caspase-1 和TGF-β3 抗体(ABclonal);金属蛋白酶组织抑制物1(tissue inhibitor of metalloproteinase-1, TIMP-1)抗体(Santa Cruz);β-actin 抗体和辣根过氧化物酶标记的羊抗兔(或羊抗鼠)IgG Ⅱ抗(Sigma);抗氧化剂α-硫辛酸(α-lipoic acid, α-LA; STADA Pharmaceutical);NLRP3 抑制剂MCC950、AMPK 抑制剂Compound C (CC)和Cx43 半通道阻滞剂GAP19(MedChemExpress);大鼠白细胞介素1β(interleukin-1β, IL-1β)ELISA试剂盒(上海酶联生物科技有限公司);Col I 和Col III ELISA 试剂盒(Merck);大鼠腺苷三磷酸(adenosine triphosphate,ATP) ELISA试剂盒(江苏晶美生物科技有限公司)。
3 实验方法
3.1 细胞分组 将细胞分为正常糖(normal glucose, NG)组、HG 组、HG+MCC950(15 nmol/L)组、HG+GAP19(100 μmol/L)组、HG+CC(10 μmol/L)组和HG+α-LA(100 μmol/L)组。HG 组葡萄糖浓度35 mmol/L,检测时间均为48 h。
3.2 细胞复苏与传代 取出冻存的大鼠原代胃平滑肌细胞株,37 ℃融化。将细胞悬液吸到离心管中,1 000 r/min 离心10 min,弃上清液。沉淀加1 mL 培养液,吹打均匀,再离心10 min,弃上清液,加适当培养液后将细胞转移至培养瓶中,37 ℃培养,倒置显微镜观察细胞状态。将瓶内的培养液吸出,加入5 mL PBS 清洗细胞1 次,吸出PBS 加入1.5 mL 胰酶,1 min后吸出胰酶37 ℃消化。用新鲜培养液混匀细胞,转移到培养瓶内添加适量新鲜培养液,分装到2~3 个培养瓶中,每个培养瓶补充适量培养液,37 ℃培养箱培养。调整细胞密度为1×109L-1后进行后续检测。
3.3 Western blot 检测细胞中蛋白表达 提取各组细胞总蛋白、膜蛋白和胞浆蛋白,全波长分光光度计测定蛋白样品浓度。8%或12% SDS-PAGE 分离蛋白后转膜,5%脱脂奶粉TBST 缓冲液封闭后洗膜。HG+MCC950组Ⅰ抗:MMP-2抗体(1∶1 000),TGF-β3和TIMP-1 抗体(1∶500);HG+GAP19 组Ⅰ抗:NLRP3和P2X7R 抗体(1∶1 000),caspase-1 抗体(1∶500);HG+CC 组Ⅰ抗:Cx43、NLRP3 和P2X7R 抗 体(1∶1 000),caspase-1 抗体(1∶500);HG+α-LA 组Ⅰ抗:p-AMPK (Thr172)、Cx43、NLRP3 和P2X7R 抗 体(1∶1 000),caspase-1 抗体(1∶500)。4 ℃过夜,洗涤后加入辣根过氧化物酶标记的羊抗兔(或羊抗鼠)IgG,室温下孵育2 h,洗膜,曝光成像后,以β-actin 为内参照分析图像。实验重复3次。
3.4 ELISA 法检测细胞培养上清液中IL-1β、Col I、Col III 和ATP 水平 HG+MCC950 组:收集细胞培养上清液,按照IL-1β、Col I和Col III ELISA试剂盒操作要求检测;HG+GAP19组、HG+CC 组和HG+α-LA 组:收集细胞培养上清液,按照ATP ELISA 试剂盒操作要求检测。利用酶标仪在450 nm 波长处测定吸光度。实验重复3次。
4 统计学处理
采用GraphPad Prism 5 软件进行统计学分析和制图。计量资料以均数±标准差(mean±SD)表示,组间比较采用t检验和单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 HG条件下细胞培养液中Col I和Col III含量
ELISA 结果显示,HG 组细胞培养上清液中Col I含量显著低于NG 组(P<0.05),而两组Col III含量的差异无统计学意义(P>0.05),见图1。
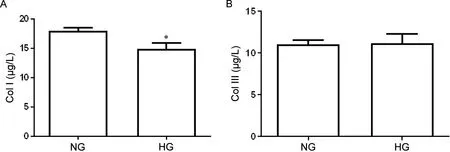
Figure 1. Content of collagen type I (Col I) and Col III in the cell culture supernatants detected by ELISA. HG: high glucose. Mean±SD. n=3. *P<0.05 vsnormal glucose (NG) group.图1 正常糖组和高糖组细胞培养液中I型胶原和III型胶原的含量
2 抑制NLRP3 后大鼠胃平滑肌细胞中MMP-2、TGF-β3、TGF-β1 和TIMP-1 表达及细胞培养液中IL-1β、Col I和Col III含量
加入NLRP3 抑制剂MCC950 后,Western blot 检测发现HG+MCC950 组胃平滑肌细胞中MMP-2 和TGF-β3 表达水平显著低于HG 组(P<0.01),而TGFβ1 和TIMP-1 表达水平显著高于HG 组(P<0.01),见图2A。ELISA 结果显示,HG+MCC950组细胞上清液中IL-1β 含量显著低于HG 组(P<0.01),而两组之间Col I 和Col III 含量的差异无统计学意义(P>0.05),见图2B~D。

Figure 2. The protein expression of MMP-2, TGF-β3, TGF-β1 and TIMP-1 in rat gastric smooth muscle cells detected by Western blot, and the content of IL-1β, Col I and Col III in the cell culture supernatants detected by ELISA after treatment with NLRP3 inhibitor MCC950 (15 nmol/L). A: the expression of MMP-2, TGF-β3, TGF-β1 and TIMP-1; B: the content of IL-1β; C: the content of Col I; D: the content of Col III. Mean±SD. n=3. **P<0.01 vs high glucose (HG) group.图2 抑制NLRP3后大鼠胃平滑肌细胞中MMP-2、TGF-β3、TGF-β1和TIMP-1表达及细胞培养液中IL-1β、Col I和Col III含量
3 阻滞Cx43 后大鼠胃平滑肌细胞中NLRP3、caspase-1和P2X7R表达及细胞培养液中ATP含量
加入Cx43 半通道阻滞剂GAP19 后,Western blot检测发现HG+GAP19 组胃平滑肌细胞中NLRP3 和caspase-1 表达水平显著低于HG 组(P<0.01),而两组之间P2X7R 表达的差异无统计学意义(P>0.05),见图3A。ELISA 结果显示,HG+GAP19 组细胞上清液中ATP含量显著低于HG组(P<0.05),见图3B。

Figure 3. The protein expression of NLRP3, caspase-1 and P2X7R in rat gastric smooth muscle cells detected by Western blot(A),and the content of ATP in the cell culture supernatants detected by ELISA (B) after treatment with Cx43 hemichannel blocker GAP19 (100 μmol/L). Mean±SD. n=3. *P<0.05, **P<0.01 vs high glucose (HG) group.图3 阻滞Cx43后大鼠胃平滑肌细胞中NLRP3、caspase-1和P2X7R表达及细胞培养液中ATP含量
4 抑制AMPK 后大鼠胃平滑肌细胞中NLRP3、caspase-1、P2X7R 和Cx43 表达及细胞培养液中ATP含量
加入AMPK 抑制剂CC 后,Western blot 检测发现HG+CC组胃平滑肌细胞中NLRP3、caspase-1、P2X7R、总Cx43和胞膜Cx43蛋白水平及胞膜Cx43/胞浆Cx43比值均显著低于HG 组(P<0.01),见图4A。ELISA结果显示,HG+CC 组细胞上清液中ATP 含量显著低于HG组(P<0.01),见图4B。

Figure 4. The protein expression of NLRP3, caspase-1, P2X7R and Cx43 in rat gastric smooth muscle cells detected by Western blot (A), and the content of ATP in the cell culture supernatants detected by ELISA (B) after treatment with AMPK inhibitor Compund C (CC; 10 μmol/L). Mean±SD. n=3. **P<0.01 vshigh glucose (HG) group.图4 抑制AMPK后大鼠胃平滑肌细胞中NLRP3、caspase-1、P2X7R和Cx43表达及细胞培养液中ATP含量
5 抗氧化应激后大鼠胃平滑肌细胞中p-AMPK、NLRP3、caspase-1、P2X7R 和Cx43 蛋白水平及细胞培养液中ATP含量
加入抗氧化剂α-LA 后,Western blot 检测发现HG+α-LA 组胃平滑肌细胞中p-AMPK、NLRP3、caspase-1、P2X7R、总Cx43 和胞膜Cx43 蛋白水平均显著低于HG 组(P<0.01),见图5A。ELISA 结果显示,HG+α-LA 组细胞上清液中ATP 含量显著低于HG 组(P<0.01),见图5B。

Figure 5. The protein levels of p-AMPK, NLRP3, caspase-1, P2X7R and Cx43 in rat gastric smooth muscle cells detected by Western blot (A), and the content of ATP in the cell culture supernatants detected by ELISA (B) after treatment with antioxidant α-lipoic acid (α-LA; 100 μmol/L). Mean±SD. n=3. **P<0.01 vs high glucose (HG) group.图5 抗氧化应激后大鼠胃平滑肌细胞中p-AMPK、NLRP3、caspase-1、P2X7R和Cx43蛋白水平及细胞培养液中ATP含量
讨 论
胃平滑肌属于单位平滑肌,由于其内有一部分肌细胞属于起搏细胞,且其兴奋可通过丰富的缝隙连接向周围的平滑肌细胞扩散,故而能够形成一个功能单位。平滑肌细胞除了完成舒缩功能外,还有合成、分泌胶原蛋白、弹性蛋白、蛋白多糖及ECM 的作用。ECM 的合成和降解受多种因素调控。经文献回顾,我们认为氧化应激、AMPK、Cx43 和NLRP3 均可通过相关机制参与ECM的调控,且相互之间关系紧密。
NLRP3 可刺激下游caspase-1、IL-1β、IL-18 等物质的释放,参与多种细胞行为的发生[9];同时,TGF-β在细胞生长、分化、凋亡和ECM 重构中发挥着关键作用[10]。MMPs 是TGF-β 的下游,也一种促进ECM降解的中性内肽酶,其中MMP-2 可以消化Col I、Col II和Col III。Col I和Col III是ECM 的主要组分,其含量变化可以反映ECM 的改变。TIMPs 是参与控制MMPs在组织中局部活性的特异性抑制剂,通常按照1∶1比例来结合MMPs,形成MMP-TIMP化合物,从而防止MMP 融合底物,抑制MMP 活性;这其中TIMP-1活性最强[11]。为确定氧化应激-AMPK-Cx43-NLRP3调控胃平滑肌ECM 重构的机制。本研究首先利用工具药对HG 条件下体外培养大鼠胃平滑肌细胞的NLRP3 进行抑制(加入NLRP3 抑制剂),并检测其下游相关蛋白表达及细胞上清液中IL-1β、Col I 和Col III 含量。结果发现,抑制NLRP3 后其下游MMP-2 和TGF-β3表达减少,而TGF-β1和TIMP-1表达增加,且细胞上清液中IL-1β 含量下降而Col I 和Col III 含量不变。学者研究认为,TGF-β3能够通过抑制TGF-β1的功能进而抑制ECM 合成[12],且NLRP3 炎症小体活化是IL-1β 释放的前提[13]。这表明,在HG 条件下,NLRP3 通过上调TGF-β3 而下调TGF-β1 表达,并进一步上调MMP-2 而下调TIMP-1 表达,从而调控胃平滑肌细胞Col I的分泌,参与ECM重构。
为探讨Cx43 是否具有调节NLRP3 功能的作用,随后我们在HG 条件下对体外培养胃平滑肌细胞的Cx43 进行了半通道抑制(加入Cx43 半通道阻滞剂),并检测其下游的NLRP3、caspase-1、P2X7R 及细胞上清液中的ATP 含量。结果发现,抑制Cx43 后NLRP3和caspase-1 表达下降而P2X7R 表达不变,且细胞上清液中ATP 含量下降。研究认为,P2X7R 为ATP 门控离子通道,可调控多种生理功能,包括细胞死亡、炎症过程等[14]。当细胞受损时,将向胞外释放出大量ATP,细胞外ATP 与细胞膜表面的P2X7R 结合,打开孔隙通道,导致Ca2+内流、K+外流。其中,胞内K+外流将促进NLRP3 表达与NLRP3 炎症小体的组装,并释放IL-1β 和IL-18[15]。这表明HG 条件下Cx43 通过上调胃平滑肌细胞ATP 的胞外释放,增加ATP 与细胞膜表面P2X7R的结合,进而促进胞内K+外流,增加NLRP3 表达并促进NLRP3 炎症小体活化;而关于Cx43 的半通道开放是否参与K+外流,有待进一步研究。
HG 可诱导氧化应激的发生,而氧化应激又是激活AMPK 的上游因素。为此,接下来本实验利用工具药在HG 条件下先后对体外培养的大鼠胃平滑肌细胞AMPK 和氧化应激进行抑制,并检测相应指标。结果发现,加入AMPK 抑制剂后NLRP3、caspase-1 和P2X7R 表达及胞外ATP 含量均下降,且Cx43 膜浆比下降;而加入抗氧化剂后,p-AMPK 蛋白水平下降,其余指标变化与加入AMPK 抑制剂后的变化类似。这表明HG 确实能够通过氧化应激调节AMPK 的活性,进而调控Cx43的细胞再定位,改变Cx43的半通道开放,从而达到调节下游NLRP3 的功能,参与调控ECM重构的目的。
综上所述,我们认为HG 通过氧化应激诱导AMPK-Cx43-NLRP3 通路活化,进而通过调节TGFβ3、TGF-β1、MMP-2 和TIMP-1 的生物学功能,参与了DGP大鼠胃平滑肌ECM的重构。
