低置换量血浆置换术联合双重血浆分子吸附术治疗慢加急性肝衰竭患者短期预后的结果
2024-03-05邹波朱龙川甘达凯张鑫垚姚雪兵
邹波 朱龙川 甘达凯 张鑫垚 姚雪兵
1南昌大学第二附属医院 (南昌 330000);2南昌市第九医院 (南昌 330002)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在慢性肝病的基础上,由出血、感染及其他各种诱因引起肝功能急性损伤的一类综合征[1],主要表现为急性黄疸加重、凝血功能障碍,严重者可短期内出现腹水、肝性脑病(hepatic encephalopathy,HE)、多脏器衰竭(multiple organ failure, MOF)等并发症。国外研究[2]显示在肝硬化和慢性肝病患者中,ACLF 已成为导致死亡的主要原因。ACLF 经正规治疗后,死亡率仍然较高[3]。目前尚无针对性的治疗方法,主要为药物治疗和手术治疗,肝移植手术是治疗本病的最终手段[4],早期可以选择人工肝支持作为替代治疗[5]。人工肝支持系统中的血浆置换(plasma exchange, PE)是以往临床上最常用的治疗模式,但PE 在清除血浆毒性物质方面缺乏针对性,且需耗费血浆。而双重血浆分子吸附术(dual plasma molecular adsorption system, DPMAS)可同时吸附血浆胆红素和中大分子毒素,达到清除有毒代谢物质的目的[6],且不耗费血浆。许何明等[7]认为,DPMAS 治疗急性肝衰竭效果明显优于PE,可改善肝功能,减少炎症反应。目前临床上,关于PE 和DPMAS 治疗肝衰竭的研究并不少见,但低置换量血浆置换术(lymphoplasmapheresis, LPE)联合DPMAS 治疗ACLF 患者是否对肝功能、短期预后等产生正面影响尚未阐明,仍有待充实。基于此,本研究以肝功能及炎症细胞因子等为观察指标,进一步探讨使用LPE+DPMAS 联合治疗ACLF 患者的临床价值,现报告如下。
1 资料与方法
1.1 样本量估算根据两样本均数比较的样本量计算公式:N1= N2= 2×[(tα/2+tβ)s/δ]2,带入公式后得到N1= N2= 40,即两组各需要40 例,考虑到研究过程中可能出现较大的失访率,按20%脱失率增加样本例数,最终取样本量100 例。观察组和对照组分配比例为1∶1,以保证组间均衡性,每组50 例。
1.2 一般资料选择2021 年1 月至2022 年9 月至南昌大学第二附属医院及南昌市第九医院就诊的100 例ACLF 患者作为研究对象,使用信封法将其随机分为观察组和对照组,各50例。两组患者一般资料,差异无统计学意义(P> 0.05),具有可比性。见表1。本研究经南昌大学第二附属医院医学伦理委员会审核批准。纳入标准:(1)参考《2019 年亚太肝病学会共识建议:慢加急性肝衰竭管理更新》[8],均符合ACLF 相关标准;(2)年龄≥ 18 岁;(3)患者意识清楚、生命体征平稳;(4)患者及家属均知情,且自愿签署同意书。排除标准:(1)合并有肝癌在内的恶性肿瘤患者;(2)伴发活动性出血或弥漫性血管内凝血者;(3)确诊为肝硬化失代偿期者;(4)哺乳期或妊娠期妇女;(5)对治疗方案不耐受,中途退出者;(6)依从性差,不配合研究者。
表1 两组患者一般资料比较Tab.1 Comparison of general data between the two groups ±s
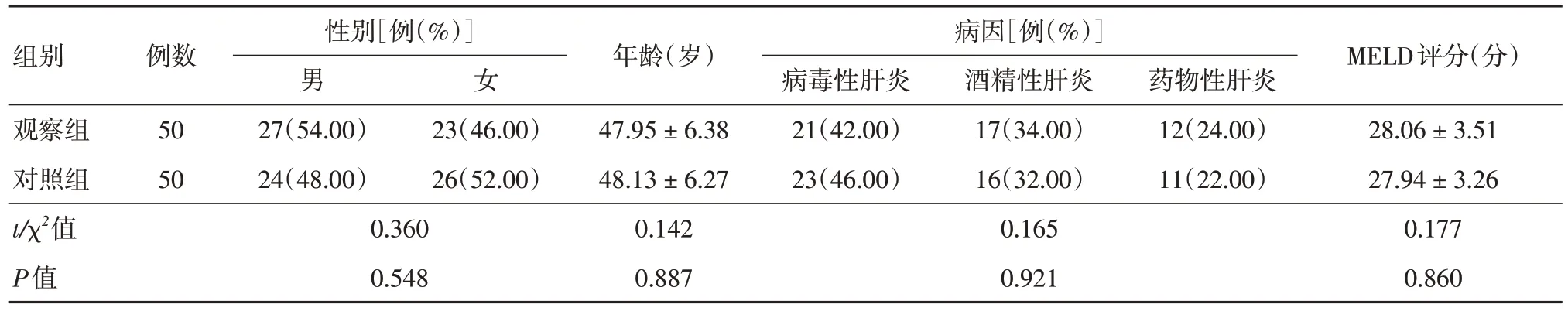
表1 两组患者一般资料比较Tab.1 Comparison of general data between the two groups ±s
组别例数性别[例(%)]男27(54.00)24(48.00)0.360 0.548女年龄(岁)MELD评分(分)观察组对照组t/χ2值P值50 50 23(46.00)26(52.00)47.95 ± 6.38 48.13 ± 6.27 0.142 0.887病因[例(%)]病毒性肝炎21(42.00)23(46.00)0.165 0.921酒精性肝炎17(34.00)16(32.00)药物性肝炎12(24.00)11(22.00)28.06 ± 3.51 27.94 ± 3.26 0.177 0.860
1.3 治疗方法
1.3.1 常规治疗护肝、退黄、降酶、抗病毒、预防出血等对症治疗。
1.3.2 对照组在常规治疗的基础上,加予PE 治疗,PE 治疗方法如下:使用DX-10 血液净化机人工肝治疗器[购自日本旭化成(杭州)有限公司]进行治疗,按PE 模式连接管路,予肝素化预冲。置换液为新鲜冰冻血浆,血浆分离器中血液流速为100 ~ 150 mL/min,血浆分离速度为20 ~ 30 mL/min,血浆置换量为2 500 ~ 3 000 mL。PE 治疗结束后,予以鱼精蛋白注射液对抗肝素,使用剂量为肝素总量的1/2(不得超过50 mg)。单次治疗时间2 ~3 h,治疗需间隔3 ~ 5 d。根据患者病情变化情况决定治疗次数。注意事项:补充置换液时遵循等量、等速,避免血容量波动;维持胶体渗透压稳定;维持水、电解质平衡;避免出现出血等严重并发症;若患者循环相对稳定、未见严重凝血功能障碍,可先输入人工胶体或晶体,后输入新鲜冰冻血浆或白蛋白。治疗过程中持续监测患者生命体征、凝血指标及机器运行参数。
1.3.3 观察组在常规治疗的基础上,加予LPE+DPMAS联合治疗。LPE治疗方法与对照组PE相同,但血浆置换量设置为1 200 ~ 1 500 mL。DPMAS 治疗方法如下:使用设备为 DX-10 血液净化机人工肝治疗器、EC-4A 血浆分离器[日本旭化成(杭州)有限公司]、BS330 阴离子胆红素吸附柱(珠海健帆生物科技股份有限公司)及HA330-II 中性大孔树脂血液灌流器(珠海健帆生物科技股份有限公司)。具体流程如下:予以股静脉置管,使血液通过DX-10 血液净化机及其配套管路泵出体外,流速为130 ~ 150 mL/min,先流经EC-4A 血浆分离器,血浆分离速度约为25 mL/min,再依次通过BS330阴离子胆红素吸附柱和HA330-Ⅱ中性大孔树脂血液灌流器,最后与血细胞混合后经股静脉置管回输体内。治疗结束后,予以鱼精蛋白注射液对抗肝素,使用剂量约占为肝素总量的1/2(不得超过50 mg)。DPMAS 单次治疗时间为3 ~ 4 h,可吸附约3.5 ~ 4 L 血浆,治疗需间隔3 ~ 5 d。根据患者病情变化情况决定治疗次数。治疗过程中持续监测血压、心率等生命体征及机器运行参数。
1.4 观察指标(1)肝功能:分别于治疗前及治疗后,抽取所有患者空腹肘静脉血3 mL,送至实验室后,离心后取上清液,使用电化学发光法检测丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)及总胆红素(total bilirubin,TBIL)水平,及时记录数据。(2)凝血功能:分别于治疗前及治疗后,取血及备血方法同前,使用凝固法检测纤维蛋白原(fibrinogen,FIB)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT),及时记录数据。(3)炎症细胞因子:分别于治疗前及治疗后,取血及备血方法同前,使用酶联免疫法检测血清超敏C 反应蛋白(hypersensitive c reactive protein,hs-CRP)、白细胞介素(interleukin,IL)-6 及IL-8 水平,及时记录数据。(4)90 d 生存情况:两组患者开始治疗后,均随访90 d,统计死亡病例,比较两组患者短期生存情况。(5)不良反应:本研究中治疗项目开始后,密切观察患者是否出现不良反应,主要包括低血压、继发感染、失衡综合征、消化道出血及凝血异常等,计算治疗1个月后总发生率。
1.5 统计学方法使用SPSS 21.0 统计学软件对所得数据进行处理,计量资料如年龄、终末期肝病模型(modle end-stage liver disease,MELD)评分、ALT、AST、TBIL、FIB、PT、APTT、hs-CRP、IL-6 及IL-8 水平,以均数±标准差表示,比较采用t检验;计数资料如性别、病因、不良反应,以率(%)表示,比较采用χ2检验,以P< 0.05 为差异有统计学意义。采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验,以P< 0.05 为差异有统计学意义。
2 结果
2.1 两组患者肝功能比较治疗前,比较两组患者ALT、AST 及TBIL 水平,差异无统计学意义(P>0.05);治疗后,观察组ALT、AST 及TBIL 水平均明显低于对照组(P< 0.05)。见表2。
表2 两组患者肝功能比较Tab.2 Comparison of liver function between the two groups ±s

表2 两组患者肝功能比较Tab.2 Comparison of liver function between the two groups ±s
注:与同组治疗前比较,*P < 0.05
组别例数AST(U/L)治疗前395.12 ± 41.86 394.87 ± 42.05 0.030 0.976治疗后235.74 ± 36.82*281.93 ± 40.76*5.946< 0.001观察组对照组t值P值50 50治疗后139.75 ± 18.14*167.03 ± 26.59*5.993< 0.001 ALT(U/L)治疗前482.96 ± 74.15 483.11 ± 74.29 0.010 0.992治疗后241.86 ± 29.78*328.04 ± 57.12*9.460< 0.001 TBIL(μmol/L)治疗前392.18 ± 45.07 391.79 ± 45.26 0.043 0.966
2.2 两组患者凝血功能比较治疗前,比较两组患者FIB、PT 及APTT 水平,差异无统计学意义(P> 0.05);治疗后,观察组FIB 显著高于对照组,而PT 及APTT 均明显低于对照组(P< 0.05)。见表3。
表3 两组患者凝血功能比较Tab.3 Comparison of coagulation function between the two groups ±s

表3 两组患者凝血功能比较Tab.3 Comparison of coagulation function between the two groups ±s
注:与同组治疗前比较,*P < 0.05
组别例数FIB(g/L)治疗前1.16 ± 0.35 1.09 ± 0.32 1.044 0.299 PT(s)治疗后41.29 ± 4.68*45.12 ± 4.93*3.984< 0.001观察组对照组t值P值50 50治疗后1.87 ± 0.49*1.46 ± 0.42*4.492< 0.001治疗前24.18 ± 2.26 23.97 ± 2.31 0.459 0.647治疗后16.43 ± 2.15*18.72 ± 2.24*5.215< 0.001 APTT(s)治疗前52.36 ± 5.47 51.87 ± 5.62 0.442 0.660
2.3 两组患者炎症细胞因子水平比较治疗前,比较两组患者hs-CRP、IL-6 及IL-8 水平,差异无统计学意义(P> 0.05);治疗后,观察组hs-CRP、IL-6 及IL-8水平均明显低于对照组(P< 0.05)。见表4。
表4 两组患者炎症因子水平比较Tab.4 Comparison of inflammatory factor levels between the two groups ±s,ng/L

表4 两组患者炎症因子水平比较Tab.4 Comparison of inflammatory factor levels between the two groups ±s,ng/L
注:与同组治疗前比较,*P < 0.05
组别例数hs-CRP治疗前84.12 ± 20.36 83.95 ± 20.47 0.042 0.967 IL-8治疗后95.67 ± 21.83*112.08 ± 24.15*3.564 0.001观察组对照组t值P值50 50治疗后35.78 ± 10.76*43.69 ± 13.52*3.237 0.002 IL-6治疗前113.68 ± 27.14 114.25 ± 26.89 0.105 0.916治疗后76.91 ± 24.63*92.18 ± 25.27*3.060 0.003治疗前136.24 ± 25.18 135.72 ± 25.64 0.102 0.919
2.4 两组患者90 d 生存情况比较随访时间为90 d,截止至2022 年12 月,观察组死亡19 例,对照组死亡24 例,观察组的90 d 生存率为62.00%(31/50)高于对照组为52.00%(26/50),但差异无统计学意义(Log-rank χ2= 1.020,P= 0.313)。见图1。

图1 两组生存曲线比较Fig. 1 Comparison of survival curves between the two groups
2.5 两组患者不良反应比较观察组不良反应总发生率为12.00%,对照组为18.00%,经比较,差异无统计学意义(P> 0.05)。见表5。

表5 两组患者不良反应比较Tab.5 Comparison of adverse reactions between the two groups例 (%)
3 讨论
据流行病学调查结果显示,乙型肝炎病毒(hepatitis B virus,HBV)感染是世界范围内的一个主要公共卫生问题[9],而中国是世界上HBV 感染负担最重的国家之一[10]。慢性乙肝患者中有部分患者可能进展为肝衰竭[11],而ACLF 是肝衰竭中较为常见的一种类型。查阅文献[12]可知,引起ACLF 的致病因素较多,包括慢性乙型肝炎病毒感染后再活化、重叠感染、未规范治疗、细菌真菌感染、停用核苷类药物及使用肝损伤药物等。ACLF患者的28 d 和90 d 病死率均较高[13],但90 d 存活的ACLF 患者中经治疗后,大多有较好的长期存活率[14]。系统性炎症的发生是影响ACLF 疾病进展的重要因素[15],属于机体对感染的自然防御类型,若炎症介质过度释放,则会引起机体原本的“抗炎”和“促炎”平衡状态破裂,导致肝损伤加重,甚至出现失代偿等并发症,因此,炎症反应的强度可显著影响ACLF 患者的预后情况。因此,有必要严密监测ACLF 患者是否出现感染,以便尽早予以对症治疗。此外,ACLF 患者可合并HE、凝血障碍、多器官功能障碍及衰竭[16]。因此,采取科学的疾病管理对ACLF 预后具有决定性影响。
目前,对于ACLF 的治疗有肝移植、内科治疗及人工肝支持治疗等多种方式。肝移植费用昂贵,且难以及时找到匹配的肝源,而内科治疗虽然在一定程度上可缓解临床症状,但并未有效清除体内毒素物质,故人工肝支持治疗逐渐成为主要治疗方式。PE 通过使用大孔径中空纤维膜分离技术,将血液中的毒素物质滤出膜外,同时将等量的新鲜血浆及膜内保留的血液有形成分回输体内,可有效清除致病因子,补充凝血因子等必需物质,并针对性地纠正ACLF 引起的代谢紊乱[17]。DPMAS 属于非生物型人工肝技术,是国内外近几年开展的一种新型血液净化方法,血浆和血细胞经分离后,血细胞回输体内,将分离出的血浆通过树脂吸附剂进行吸附,不仅可有效吸附胆红素,还能清除中大分子毒素,减少血浆耗费和避免血浆不良反应,可迅速缓解患者黄疸症状,提升救治成功率,改善预后。以往研究[18-19]证实,DPMAS 治疗急性淤胆型肝炎、暴发性肝衰竭安全有效。在HBV 相关ACLF(HBV-ACLF)患者的治疗中,与综合药物和单独PE 治疗比较,DPMAS+PE 治疗可有效改善HBV-ACLF 患者肌酐、AST、TBIL 水平及28 d 和90 d 生存率[20]。
农村立等[21]使用DPMAS 序贯血浆置换治疗HBV-ACLF 患者,其血清ALT、TBIL、INR 水平均明显改善。刘春涛等[22]在报道中指出,DPMAS 模式人工肝治疗乙肝相关ACLF 疗效显著优于PE 模式,可有效改善肝功能,降低炎症因子水平,且治疗过程中不需要使用血浆,可作为临床早期患者的首选。另外,杨晴等[23]认为PE 联合DPMAS 治疗乙型肝炎病毒相关ACLF 患者,不仅可明显改善肝功能及凝血功能,还可有效降低90 d 病死率。与上述结论类似,在本研究中,治疗后,观察组FIB显著高于对照组,而PT、APTT、ALT、AST、TBIL、hs-CRP、IL-6 及IL-8 水平水平均明显低于对照组(P< 0.05),说明使用LPE+DPMAS 联合治疗ACLF患者,可有效改善肝功能和凝血功能,降低炎症因子水平。本研究中,观察组90 d 生存率为62.00%高于对照组为52.00%,但差异无统计学意义(P>0.05),与之类似,有研究[24]提出与单独使用DPMAS相比,LPE+DPMAS联合治疗可有效改善ACLF患者肝功能,但90 d 生存率无明显变化。但有学者[25]认为与单纯PE 相比,DPMAS+PE 可更有效地改善ACLF 患者的暂时性TBIL,并提高HBV-ACLF 中晚期患者的28 d 生存率。熊晏等[26]认为将DPMAS联合LPE 应用于ACLF 患者,可有效纠正Th1/Th2型细胞因子紊乱,促使肝功能改善,且治疗期间未见明显不良反应,安全可靠。治疗期间,观察组不良反应总发生率为12.00%,对照组为18.00%,经比较,两组差异无统计学意义(P> 0.05),表明使用LPE+DPMAS 联合治疗ACLF 患者安全性高。
本研究同时存在一定不足,如样本量偏少、观察时间偏短等,另外,入组患者病因包括病毒性肝炎、酒精性肝炎和药物性肝炎,上述患者进展至ACLF 后使用本研究中两种治疗方式,可能在肝功能、凝血功能、炎症细胞因子水平以及90 d 生存情况方面存在差距,但本研究尚未进行分组讨论,期望后续进行大样本多中心研究,延长观察时间,并进一步探讨不同病因致ACLF 患者在接受LPE 联合DPMAS 治疗后的疗效及预后。
综上所述,LPE+DPMAS 联合治疗ACLF 患者,可有效改善肝功能及凝血功能,降低炎症因子水平,安全性高。
