新生儿感染性肺炎血清Gal-3、IL-17水平与肺超声评分关系及对继发呼吸窘迫综合征的预测价值
2024-03-04徐岸楠廖崇皓李世瑶肖宗莉
徐岸楠, 廖崇皓, 李世瑶, 肖宗莉
重庆市开州区人民医院新生儿科, 重庆 405400
新生儿感染性肺炎(neonatal infectious pneumonia,NIP)是指婴儿出生28 d内发生的肺炎疾病,近两年数据显示,约50%的NIP是由细菌感染引起的,其病情进展迅速,易继发呼吸窘迫综合征(respiratory distress syndrome,RDS)[1,2]。尽管近年随生命支持技术、肺保护策略、体外膜肺氧合等手段的应用,NIP继发RDS的病死风险得到显著降低,但寻找NIP患儿继发RDS风险的评估工具仍十分重要。半乳糖凝集素-3(galectin-3,Gal-3)是哺乳动物特有的一种β半乳糖苷结合凝集素,最新研究证实,Gal-3是肺损伤后机体免疫稳态显著上调的一种重要调节因子,其在大叶性肺炎[3]、新冠肺炎[4]等肺部炎症性疾病中存在与疾病严重程度呈依赖性增加的特征。白细胞介素-17(interleukin-17,IL-17)是保护宿主免受黏膜感染的重要细胞因子,也是一种具备强大促炎能力的前炎症因子,可诱导中性粒细胞向炎症部位聚集,发挥致炎、病原菌清除、损伤修复等作用[5]。同时有研究指出,IL-17是小鼠呼吸道黏蛋白——Gal-3互相作用的重要调节因子,Gal-3和IL-17可能互相作用诱导气道炎症的发生发展[6]。目前NIP患儿血清Gal-3、IL-17水平与其病情间关系如何尚缺乏广泛研究,本研究通过比较继发RDS与未继发RDS新生儿间指标的差异,分析血清Gal-3、IL-17水平对继发RDS的预测价值。
1 资料与方法
1.1 研究对象
选取2021年2月至2023年2月我院NIP患儿98例作为研究组,选取同期健康新生儿98例作为对照组。研究组纳入标准:根据《儿科学》(第9版)[7]诊断确诊,即患儿发生气促、鼻翼煽动、发热或体温下降、三凹征等,肺细小湿啰音,X线片示肺斑片状阴影;入组前未经相关治疗;监护人对研究内容知情,签署同意书。研究组排除标准:重大脏器功能发育不全;代谢性疾病;其他感染性疾病;免疫功能异常;特发性肺纤维化;入组时已出现RDS。研究组男51例,女47例,出生胎龄33+4~42周,平均(38.22±1.89)周;分娩方式:自然分娩59例,剖宫产39例;出生体重1.91~4.02 kg,平均(2.98±0.41)kg。对照组男55例,女43例,出生胎龄34+3~42周,平均(38.64±2.16)周;分娩方式:自然分娩63例,剖宫产35例;出生体重2.11~4.00 kg,平均(3.04±0.43)kg。两组性别、出生胎龄、分娩方式、出生体重基线资料均衡可比(P>0.05)。本研究经我院伦理委员会批准。
1.2 方法
1.2.1检测方法
研究组于治疗前、对照组于出生后3~7 d内用非抗凝真空管采集股静脉血4 mL,室温静置30 min,离心10 min(半径8 cm,转速3500 r/min),取上层血清,用上海恒远生物科技有限公司Gal-3酶联免疫试剂盒、IL-17酶联免疫试剂盒分别检测Gal-3、IL-17水平。操作由相同资深检验科技师参照试剂盒说明书步骤规范完成,Gal-3、IL-17均用酶联免疫法规范检测3次,取平均值。
1.2.2肺超声评分
飞利浦EPIQ7型超声仪,探头频率9~12 MHz,2名新生儿科超声医师配合检查,患儿取仰卧位、侧卧位,每侧肺分成12区域,探头自第2肋间自上至下,自左至右,先顺肋间隙横扫,再旋转探头90°纵扫,记录图像。根据《感染性肺炎超声诊断专家建议》[8],并参照韩转宁等[9]的肺超声评分法,平滑A线或孤立B线不足3条记4分,有散在清晰B线记3分,大量B线(有融合)记2分,B线瀑布征记1分,肺实变记0分。当同一区域出现不同征象时,以最严重超声表现打分,每个区域评分总和为肺超声评分,总分0~48分,评分越低提示感染越严重。
1.2.3研究组干预方法
研究组患儿均给予抗感染、吸氧、维持水电解质及酸碱平衡等治疗,同时进行体位引流,定期翻身、拍背等,清理口腔分泌物确保呼吸道畅通等。监测患儿病情变化,参照《儿科学》(第9版)[7]诊断是否继发RDS。
1.3 观察指标
(1)对比研究组、对照组血清Gal-3和IL-17水平、肺超声评分。(2)分析研究组血清Gal-3和IL-17水平与肺超声评分的关系。(3)NIP继发RDS的影响因素分析。(4)NIP继发RDS的独立影响因素分析。(5)血清Gal-3、IL-17水平对NIP继发RDS的评估价值。(6)血清Gal-3、IL-17水平评估NIP继发RDS的净受益率。
1.4 统计学方法
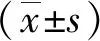
2 结果
2.1 对比研究组、对照组血清Gal-3和IL-17水平、肺超声评分
研究组肺超声评分23~41分,平均(32.06±2.47)分。研究组血清Gal-3、IL-17水平高于对照组(P<0.05)。见表1。

表1 对比研究组、对照组血清Gal-3和IL-17水平、肺超声评分
2.2 分析研究组血清Gal-3和IL-17水平与肺超声评分的关系
经Spearman秩相关系数分析,血清Gal-3(r=-0.671,P<0.001)、IL-17(r=-0.637,P<0.001)水平与肺超声评分呈负相关。见图1和图2。

图1 血清Gal-3水平与肺超声评分的关系
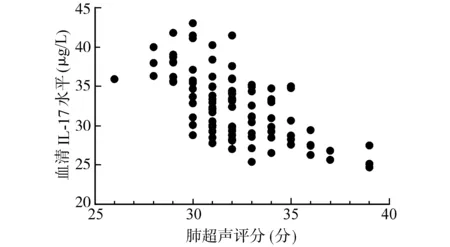
图2 血清IL-17水平与肺超声评分的关系
2.3 NIP继发RDS的影响因素分析
研究组98例NIP患儿中继发RDS 22例,发生率22.45%。是否继发RDS患儿间性别、分娩方式、日龄、出生体重、病原菌类型比较,差异无统计学意义(P>0.05)。NIP继发RDS患者出生胎龄、肺超声评分小于未继发RDS患者,降钙素原、C反应蛋白、有创通气、血清Gal-3和IL-17水平高于未继发RDS患者(P<0.05)。见表2。
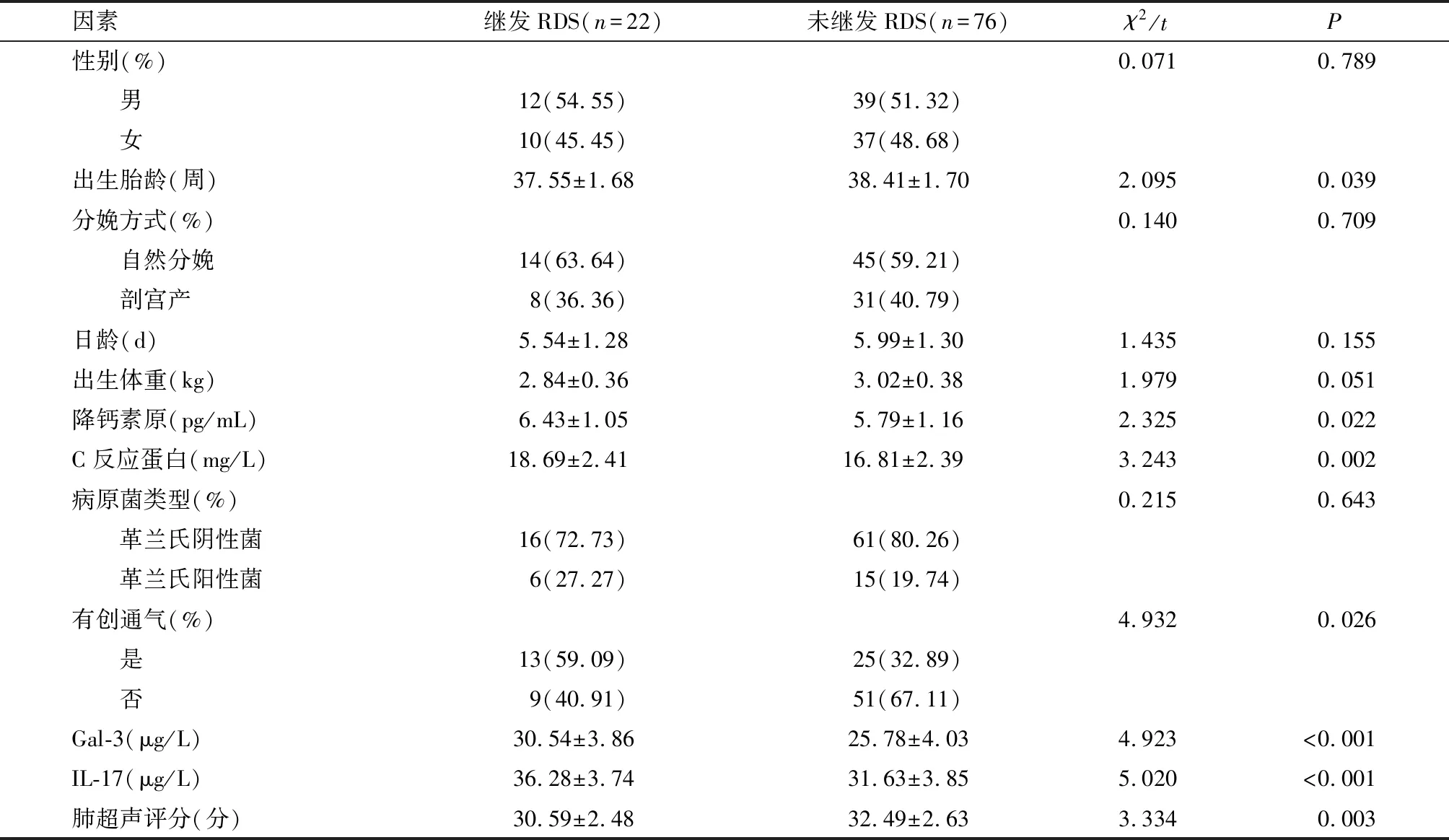
表2 NIP继发RDS的影响因素分析
2.4 NIP继发RDS的独立影响因素分析
将表2中P<0.05的项目(出生胎龄、降钙素原、C反应蛋白、有创通气、Gal-3、IL-17、肺超声评分)作为自变量,将NIP继发RDS情况作为因变量(赋值说明见表3),首先进行多重共线性检验,肺超声评分存在多重共线性(方差膨胀因子VIF>10),移除混杂因素后将出生胎龄、降钙素原、C反应蛋白、有创通气、Gal-3、IL-17纳入多因素Logistic回归模型,结果显示,Gal-3、IL-17是NIP继发RDS的独立危险因素,胎龄是NIP继发RDS的独立保护因素(P<0.05)。见表4。

表3 自变量及因变量的赋值说明
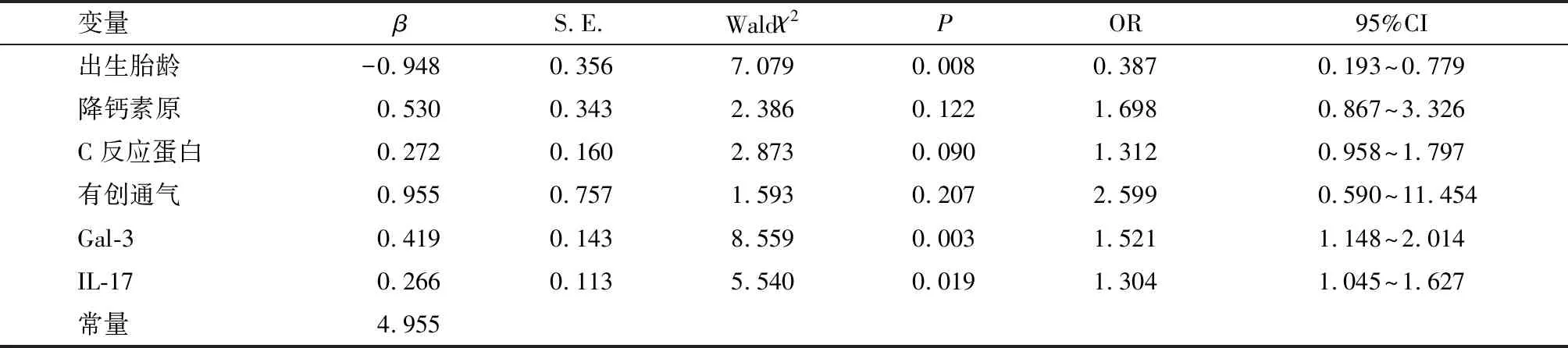
表4 NIP继发RDS的独立影响因素分析
2.5 血清Gal-3、IL-17水平对NIP继发RDS的评估价值
经ROC曲线分析,血清Gal-3、IL-17水平评估NIP继发RDS的AUC值分别为0.808、0.803,通过Logistic二元回归拟合血清Gal-3、IL-17水平联合评估NIP继发RDS的模型,返回预测概率logit(p)作为独立检验变量,再经ROC曲线分析,血清Gal-3、IL-17水平联合评估NIP继发RDS的AUC值为0.876,大于血清Gal-3(Z统计=2.116,P=0.034)、IL-17(Z统计=2.125,P=0.032)水平单一指标评估(P<0.05)。见表5、图3。
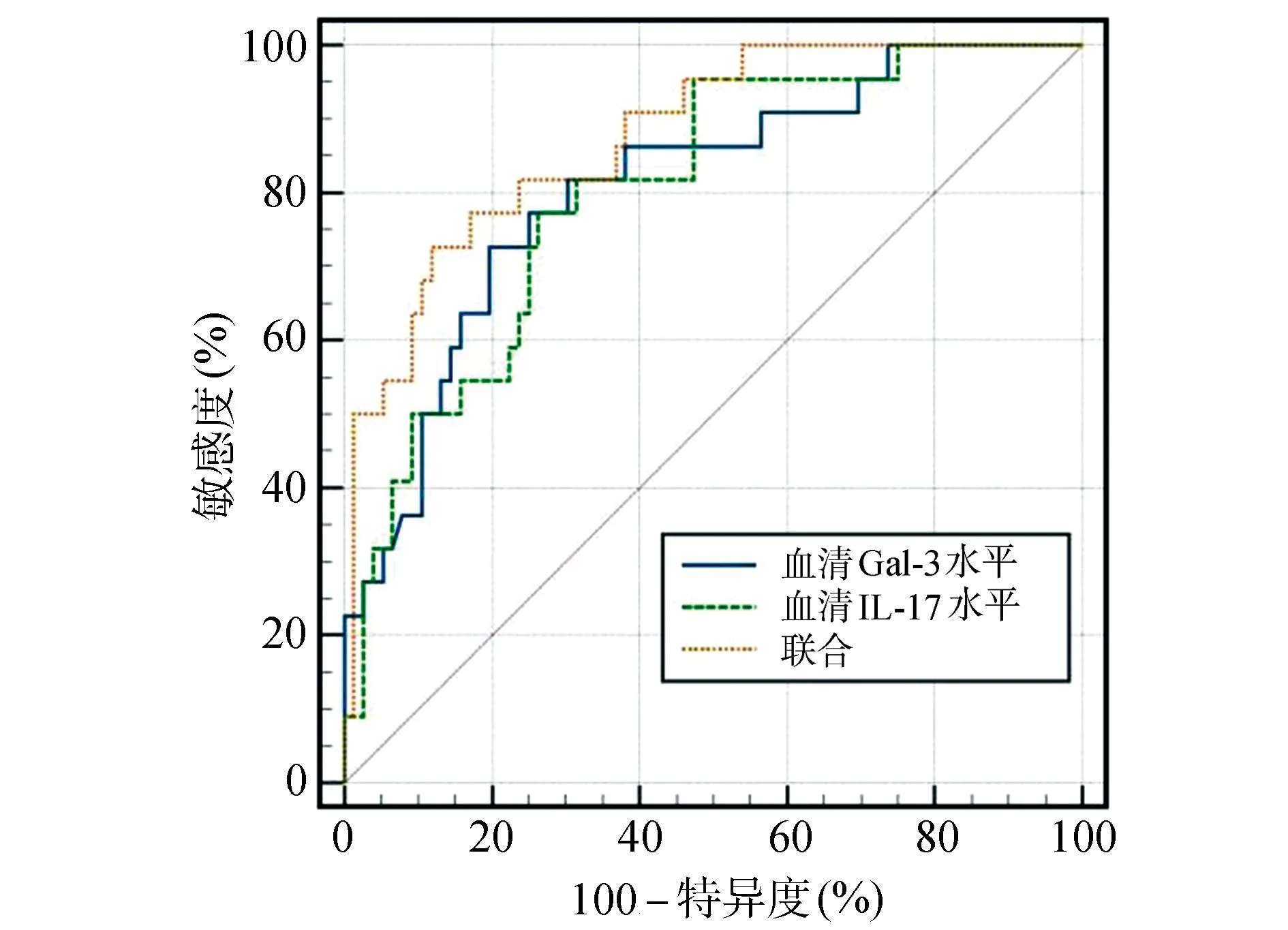
图3 血清Gal-3、IL-17水平评估NIP继发RDS的ROC曲线

表5 血清Gal-3、IL-17水平对NIP继发RDS的评估价值
2.6 血清Gal-3、IL-17水平评估NIP继发RDS的净受益率
将高风险阈值作为横坐标,净受益率作为纵坐标绘制决策曲线,当风险阈值约为0.20~0.88时,血清Gal-3、IL-17水平联合评估NIP继发RDS的净受益率大于单独评估,在阈值0.41时受益最佳。见图4、图5。

图4 血清Gal-3、IL-17水平评估NIP继发RDS的决策曲线

图5 血清Gal-3、IL-17水平评估NIP继发RDS的临床影响曲线
3 讨论
新生儿呼吸道结构、功能及免疫系统发育尚不完善,是感染性肺炎的高发群体,且发病后致病菌可迅速增殖使病情进展至重症肺炎,当合并RDS时可造成肺外器官功能异常,会增加后遗症及病死风险[10]。因此,早期个体化识别NIP患儿继发RDS的风险是指导临床实现精准干预的关键。
目前肺超声是医疗机构检查新生儿肺部疾病的重要手段,临床已证实,通过肺超声评分可有效评估患儿病情严重程度,为临床治疗提供参考[11]。本研究也发现,NIP患儿的肺超声评分显著降低,与上述报道一致,但肺超声评分主要依据肺病理性改变进行病情评估,难以为临床前期预防提供参考。鉴于当前主流观点认为,肺炎所致RDS普遍存在弥漫性肺泡损伤,NIP发病后所出现的局部及全身炎症反应不仅是造成肺泡腔和间质内渗出性水肿、肺泡塌陷的重要原因,也是引起肺泡上皮细胞增生、间质纤维化的主要病理生理基础[12],因此,从该过程相关的生化层面入手或可为临床实现前期预防提供依据。Gal-3在人体内广泛表达,主要参与机体免疫稳态及免疫反应的调节过程,是评估机体炎症及组织纤维化的重要指标。王刚祚等[13]研究发现,高水平Gal-3是NIP合并RDS患儿病死的独立危险因素,其评估NIP合并RDS患儿预后的AUC值为0.682,具有一定评估价值。但NIP患儿血清Gal-3水平对继发RDS风险的评估价值如何尚缺乏研究,本研究结果显示,研究组血清Gal-3水平普遍升高,且与肺超声评分呈负相关,提示血清Gal-3水平变化可能与NIP的发生发展有关。继续分析发现,继发RDS的NIP患儿血清Gal-3水平升高更显著。分析可能是因Gal-3作为细胞间互相作用的凝集素,正常情况下,Gal-3可促进中性粒细胞、巨噬细胞等向感染部位聚集以清除致病原,但受机体内外众多因素影响,当致病原持续存在时可能会刺激造血组织的巨噬细胞大量生成Gal-3,以致中性粒细胞、巨噬细胞等炎性细胞在炎症部位过度聚集,其在清除致病原的同时也会释放炎症因子损害正常组织细胞[14]。上述研究说明,NIP患儿血清Gal-3水平过度升高可能是继发RDS的重要危险因素。
IL-17是一种多效应促炎症细胞因子,能通过诱使促炎性细胞因子生成而降解血管内皮细胞基膜、肺间质,以促进炎性细胞浸润[15]。既往有关IL-17的研究主要集中在自身免疫性疾病、肿瘤疾病等方面,近年随研究深入,其在肺感染性疾病中的研究也逐渐增多。有研究显示,IL-17与细胞增殖、细胞外基质蛋白产生等过程有关,在慢性阻塞性肺疾病急性加重期患者外周血中表达增加,有可能成为该疾病的治疗靶点[16]。本研究同样发现,NIP患儿血清IL-17水平显著升高,且与肺超声评分呈负相关。分析相关机制可能是下呼吸道感染后Th17细胞受刺激生成、分泌IL-17,而IL-17不仅可促使中性粒细胞成熟,且可诱导上皮及内皮细胞生成炎症递质,募集中性粒细胞向炎症部位聚集,参与肺组织的炎症损伤过程[17]。上述研究说明,NIP患儿血清IL-17水平变化可能与NIP发病发展有关,或可为临床评估此类患儿继发RDS提供依据。但也有多项研究表明,肺炎所致RDS是多种因素单独或(和)共同作用的结果,降钙素原、C反应蛋白等均与肺炎发生发展有关[18,19]。本研究也发现,降钙素原、C反应蛋白等因素均是NIP患儿继发RDS的影响因素,但该过程病理机制十分复杂,仅从当前现有研究仍不足以解释NIP患儿继发RDS的完整病理过程。本研究继续多因素Logistic回归分析发现,血清Gal-3、IL-17水平升高均是继发RDS的独立危险因素,当控制胎龄为固定变量时,血清Gal-3、IL-17水平每升高1个单位,继发RDS的风险分别可增加0.521倍、0.304倍。分析得出主要是因Gal-3、IL-17在诱导中性粒细胞、巨噬细胞等向炎症部位聚集方面具有协同作用,同时高水平的Gal-3可与Th17细胞表面的免疫突触结合,刺激Th17细胞分泌IL-17,而IL-17又可通过调节黏蛋白表达而增强Gal-3在调节细胞间黏附性中的作用[20,21]。由此说明血清Gal-3、IL-17水平与NIP患儿继发RDS关系密切,或可为临床评估NIP患儿继发RDS风险提供参考。ROC分析显示,胎龄是NIP继发RDS的独立保护因素(P<0.05);血清Gal-3、IL-17水平联合评估NIP继发RDS的AUC值为0.876,大于血清Gal-3、IL-17水平单一指标评估(P<0.05),且风险阈值约为0.2~0.88时,联合评估NIP继发RDS的净受益率大于单独评估,在阈值0.41时受益最佳。
综上可知,NIP患儿血清Gal-3、IL-17水平与肺超声评分关系密切,是继发RDS的重要影响因素,临床通过检测血清Gal-3、IL-17水平可评估NIP患儿继发RDS的风险。
