KED碰撞模式-电感耦合等离子体质谱(ICP-MS)法测定血液、尿液中8种重金属和准金属元素
2024-03-04吴泽清张成龙刘番番毕文姬杨瑞琴
吴泽清 张成龙 国 菲 刘番番 毕文姬 杨瑞琴* 李 鹏*
(1.中国人民公安大学 侦查学院,北京 100038;2.淄博市公安局 刑侦支队,山东 淄博 255022)
重金属和准金属元素常被不法分子用于投毒犯罪活动,涉及重金属和准金属的中毒案件时有发生。相关案件中的血液、尿液取样便捷且在人体内含量丰富,能够反映不同途径元素暴露的体内负荷信息[1-2]。血液、尿液中重金属和准金属元素常见的检测方法主要包括原子发射光谱(AES)、原子吸收光谱(AAS)、电感耦合等离子体发射光谱(ICP-AES)和电感耦合等离子体质谱(ICP-MS)法。ICP-MS是20世纪80年代以来发展最快的多元素分析技术,与AES、AAS和ICP-AES相比,检出限更低、线性范围更宽、分析速度更快,被广泛应用于环境监测、食品分析、医学诊断和法庭科学等领域。然而,ICP-MS在检测血液、尿液中的重金属和准金属元素时会受到基质干扰、多原子离子干扰等因素的干扰,影响分析结果的准确性,这就要求检测复杂基质样品时选择适当的前处理方法和校准方法。血液、尿液样品常用的前处理方法包括微波消解法和直接稀释法等。微波消解法消解完全,密闭环境能够有效避免挥发性元素的损失,避免外界污染[3],但样品处理时间长、操作复杂,不适合批量测定;直接稀释法操作简单快速且无需前处理设备,能够减少可能引入的污染。稀释能有效降低样品基质效应,避免样品中的有机物和较高浓度的无机盐堵塞进样毛细管[4],减少因雾化器和锥口上的固体沉积而引起的仪器漂移[5]。
由于血液、尿液样品的基质复杂且具有个体差异性,无法配制与血液、尿液样品成分相似的标准溶液,难以获得较好的准确度[6]。外标法、同位素稀释法和标准加入法是定量分析中常用的校准方法[7]。外标法通过扣除本底值有效减少系统偏差,但不同样品间基质效应的差异仍会显著影响定量的准确性;同位素稀释法是校正ICP-MS中基质效应和信号漂移最有效的方法,但该方法耗时长、成本高,要求目标元素至少有两个不受光谱干扰的同位素,不适用于Co、As、Sb、Tl等只有一个同位素或者单同位素的元素[5];标准加入法应用成本低,无需另外引入空白基质,克服了基质效应且被证明在生物基质中具有极高的准确性[8]。本实验在直接稀释前处理方法的基础上,通过标准加入法和稀释剂改善血液、尿液样品的基质效应和个体元素差异造成的误差,再应用动能歧视(KED)检测模式减少样品中生物分子对测定产生的质谱和非质谱干扰,实现血液、尿液样品中多元素的精准和高通量分析。
1 实验部分
1.1 仪器与试剂
iCAP Qc ICP-MS仪器(美国Thermo Fisher公司)、去离子纯水处理系统(法国Merck公司)、HY-5 涡旋振荡器(常州恒睿仪器设备制造有限公司)、CF16RN 落地式多功能离心机(日本日立公司)、AUW220D 电子天平(日本岛津公司)、移液器(德国Eppendorf公司)。
去离子水(18.2 MΩ·cm),1 g/L Cr、As、Cd、Pb单元素标准溶液(山东省冶金科学研究院),1 g/L Co、Ni、Sb单元素标准溶液(国家有色金属及电子材料分析测试中心),1 g/L Tl单元素标准溶液(AccuStandard®),1 g/L In单元素标准溶液(坛墨质检,BW30046-100-N-50),超纯浓硝酸(德国Merck公司),1 g/L Ba、Bi、Ce、Co、In、Li、U调谐液(美国Thermo公司),Triton X-100 试剂(Sigma-Aldrich®),99.9%乙醇溶液(德国Merck公司),志愿者血液、志愿者尿液各1份。
1.2 仪器参数
用美国Thermo公司仪器调谐液(S55602)调节仪器至最优状态,并满足氧化物产率CeO+/Ce+<3%,双电荷离子Ba2+/Ba+<3%。通过调谐优化后的仪器参数条件为:射频(RF)功率1 550 W、载气流速12 L/min、蠕动泵转速40 r/min、扫描次数20次、积分时间0.02 s、扫描方式跳峰、每个样品连续重复测量3次,检测模式KED模式、碰撞气体He。
1.3 样品前处理
将存储于-22 ℃环境下的空白血液和尿液取出解冻,涡旋仪混匀后处理。血样和尿液分别取5 mL空白样品各自置于8个10 mL试管内,留1份空白样品,向其余试管中分别添加0.05 mL的25、100、500、1×103、2×103、5×103、1×104μg/L梯度浓度溶液。移取200 μL血液至10 mL离心管,加入30 μL内标溶液后向内加入稀释剂(0.1%HNO3+0.05%Triton X-100)稀释50倍至10 mL,涡旋1 min后4 500 r/min离心5 min,移液枪移取上清液后使用ICP-MS检测;移取200 μL尿液至2 mL离心管,加入30 μL内标溶液后向内加入稀释剂(0.1% HNO3+1%乙醇)稀释10倍至2 mL,涡旋1 min直接使用ICP-MS检测。
1.4 数据处理与分析
Microsoft Excel 2019和IBM SPSS Statistics 26.0对样品数据进行处理和分析。
2 结果与讨论
2.1 碰撞气流量和载气流速的优化
检测前通过自动调谐达到仪器最佳实验状态,但为了提高仪器对检材中单个目标元素定性定量时的灵敏度,对能显著影响元素响应值的碰撞气和载气流速进行了考察。KED模式下碰撞气He流量的大小影响进入质量分析器中待测离子的数目,从而影响检测灵敏度[9];进样过程中在雾化器处引入载气,其流速大小能够影响等离子体中样品气溶胶的电离效率和停留时间[10]。本实验通过考察1 μg/L的Cr、Co、Ni、As、Cd、Sb、Pb、Tl标准品溶液,分别研究He流量在1~6 mL/min,载气流速0.4~1.3 L/min时各元素响应值的变化,结果如图1所示。由图1可知,随He流量的增大,Co、Cd、Sb、Pb元素的响应值呈现先增大后减小然后再增大的趋势,Cr、Ni、Tl元素的响应值呈现整体增大的趋势,As的响应值呈现先增大后减小的趋势;随载气流速的增加,更多均匀的样品气溶胶颗粒进入等离子体中,整体呈现先增大后减小的趋势。75As、208Pb的最佳He流量分别为4.0、2.0 mL/min,其余元素的响应值在He流量为6.0 mL/min时最大;75As的最佳载气流速为1.1 L/min,其余元素的最佳载气流量为1.2 L/min。
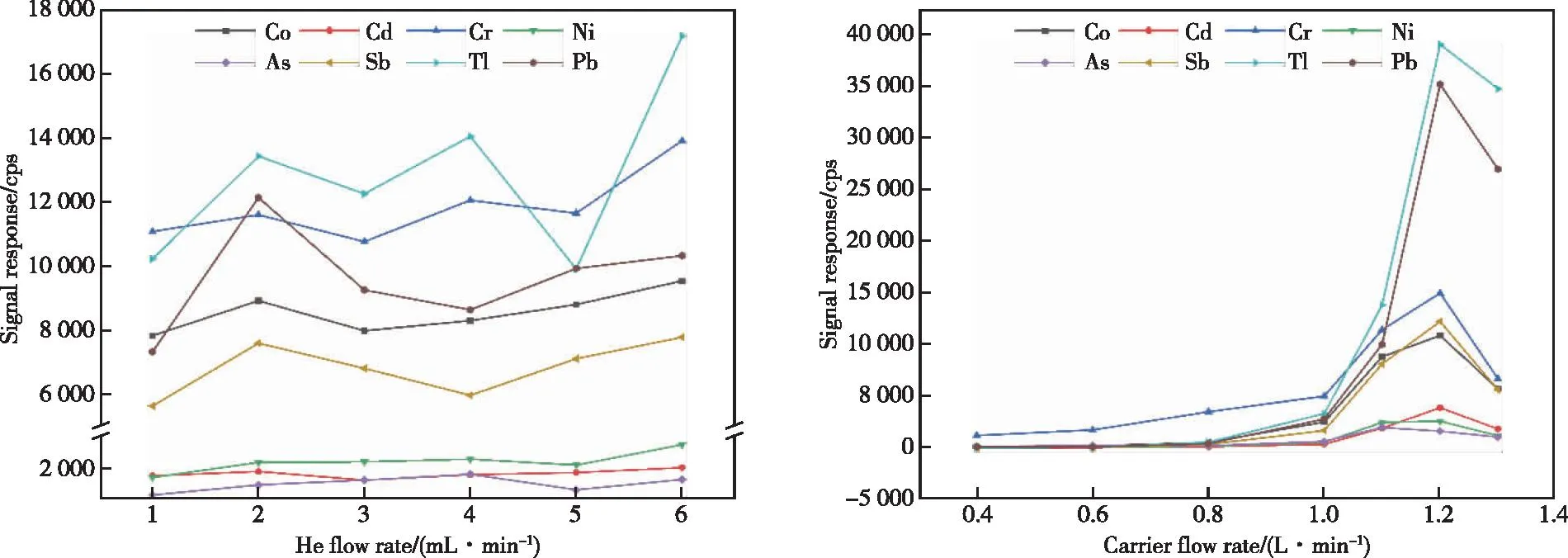
图1 He流量和载气流速对8种重金属和准金属元素响应值的影响Figure 1 Effects of He flow rate and carrier gas flow rate on the response values of 8 heavy metals and quasi metallic elements.
2.2 稀释剂的选择
血液、尿液基质成分复杂[11-12],稀释能够有效降低样品基质效应。相对于碱性稀释剂,Mn、As等元素在酸性条件下更加稳定。HNO3对大多数金属及痕量元素的溶解性好且谱图干扰小[6],是目前常用的稀释剂,但过高浓度HNO3可能导致样品中的蛋白质变性,使得仪器进样管和雾化器堵塞[13],因此选择低浓度HNO3(0.1%)作为基本稀释剂,同时对不同体积分数ICP-MS增敏剂Triton X-100和乙醇的效果进行考察。不同体积分数的Triton X-100、乙醇对8种重金属和准金属元素信号响应的影响见图2。
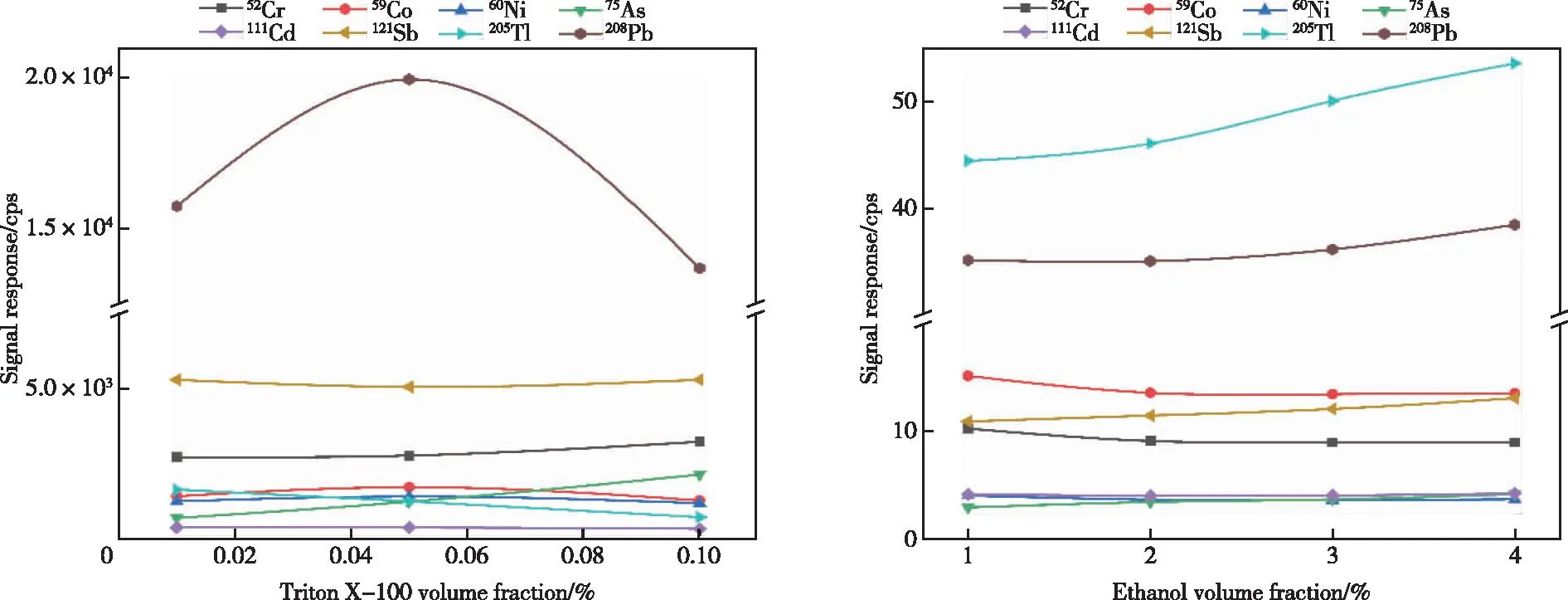
图2 不同体积分数的Triton X-100和乙醇溶液对8种重金属和准金属元素信号响应的影响Figure 2 Effects of Triton X-100 and ethanol solutions with different volume fractions on signal response of 8 heavy metals and quasi metallic elements.
未经消解的血液中基质成分复杂,大约含有60~80 g/L蛋白质和10 g/L无机盐。非离子型表面活性剂Triton X-100具有溶血作用,经常应用于生化以溶解蛋白质[14],相比于乙醇更适合作为血液稀释剂。由图2可知,同质量浓度的Cr、As、Sb标准溶液在体积分数为0.1%的Triton X-100溶液中获得最高信号,但其他元素信号响应值均较低;在0.05%Triton X-100溶液中,Co、Ni、Cd和Pb标准溶液的信号响应最高,同时其他元素也具有较高的信号响应值。故实验选用0.05% Triton X-100溶液作为增敏剂,采用0.1% HNO3-0.05% Triton X-100混合溶液作为血液稀释剂。
乙醇简单易得,对工作环境及人员无毒害,适合作为大批量样品的ICP-MS增敏剂[6]。由图2可知,Cr、Co、Ni等低质量数元素的标准溶液在体积分数为1%乙醇溶液中获得最高信号,As、Cd、Sb、Tl和Pb等高质量数元素的标准溶液在体积分数为4%乙醇溶液中获得最高信号,其余体积分数乙醇溶液对元素信号的增强和抑制不明显,响应值差别较小。样品离子束进入提取透镜后受空间电荷效应的影响,轻质量数离子受影响偏转甚至逃逸,导致轻质量数元素的灵敏度偏低[7]。因此在同等浓度下,Cr、Co、Ni元素标准溶液信号响应相对As、Cd、Sb、Tl和Pb元素更低,1%乙醇溶液能够有效提高低质量数元素的信号响应,同时其他元素也具有较高的信号响应值。实验选用1%乙醇溶液作为增敏剂,采用0.1% HNO3-1%乙醇混合溶液作为尿液稀释剂。
2.3 干扰来源与消除
ICP-MS测定血液和尿液样品中元素时受多原子离子干扰、双电荷干扰、拖尾干扰等影响,此外空白样品和检材样品间基质的差异也会对检测结果造成干扰。血液、尿液样品中含有的生物分子、有机物和盐类物质,使得样品基质更加复杂,容易在离子化过程中与氩气结合形成如40Ar14N+、ArCl+、40Ar12C+等复杂的干扰物[15],这是造成多原子离子干扰的原因之一。KED模式在四极杆滤质器中的四极杆上形成电势栅栏,从而区分动能有所差别而质荷比相同的离子,通入碰撞气He抑制多原子离子干扰以达到减低质谱干扰的目的[15-16]。双电荷干扰在ICP-MS中并不是主要的干扰类型,同时对生物样品检测的影响较小,在检测开始前使用含有Ce2+或Ba2+的调谐液检测双电荷离子的形成[5]。拖尾干扰的大小取决于仪器的丰度灵敏度,血液等液体检材中的55Mn容易受54Fe和56Fe的影响导致不真实的高响应值。检测中标准加入法的引入避免了使用空白样品量化检材中的目标物,使得样品基质保持一致[17]。
此外,仪器在分析高浓度样品后对低浓度样品的测定会出现记忆效应,应当按照浓度升序检测样品,同时设置合适的清洗时间以降低记忆效应。根据上述仪器条件测定8种元素的50 μg/L高浓度样品溶液,分别将样品测定完成后的清洗时间设定为10、30、60和120 s,当清洗时间为60 s时,各元素响应值已经接近空白样品水平的响应值,有效消除了各元素测定过程中引入的记忆效应。
2.4 标准加入法测定样品中重金属和准金属

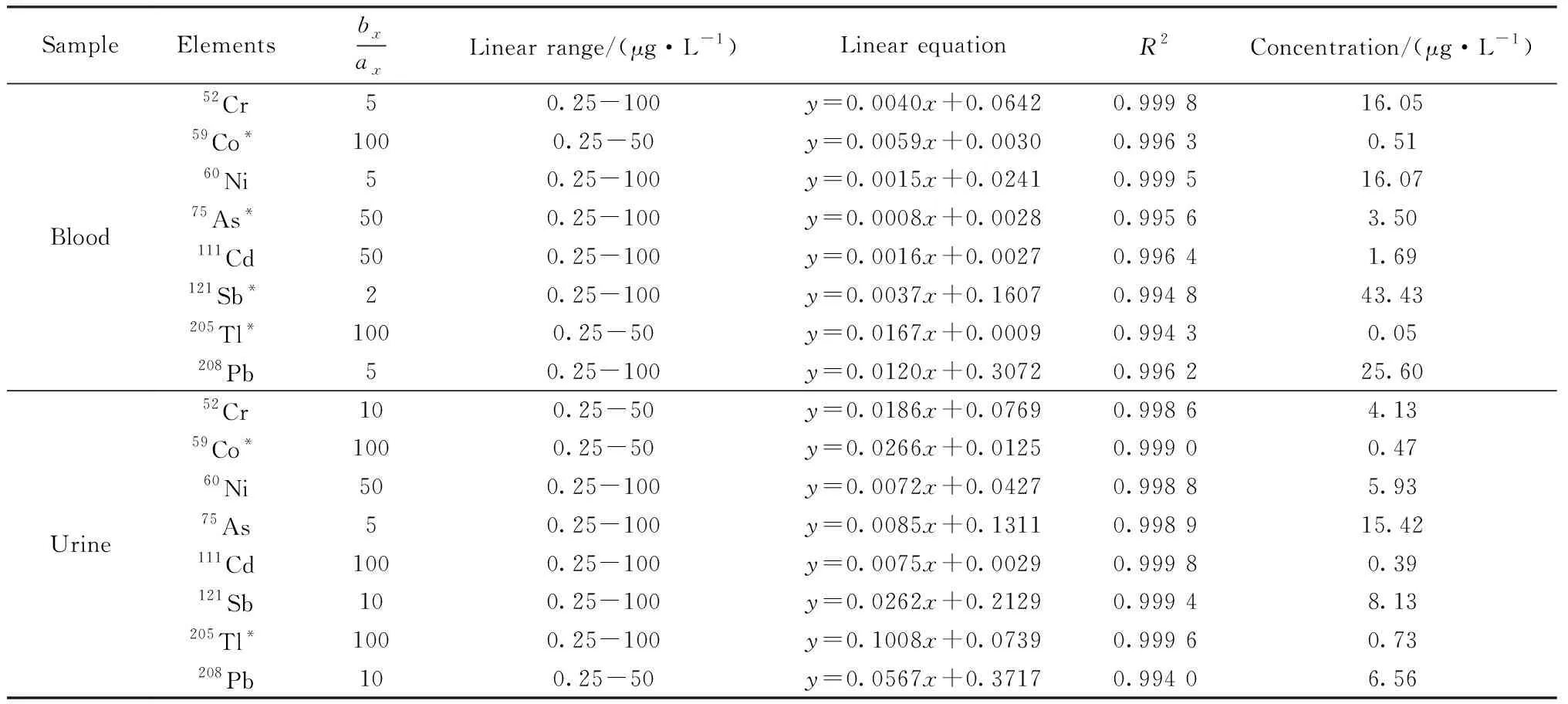
表1 血液和尿液样品中8种元素的线性关系及含量Table 1 Linear relationship and contents of 8 elements in blood and urine samples
2.5 方法学验证
2.5.1 检出限及定量限
通过对空白溶剂的测量,计算出检出限和定量限。使用ICP-MS连续检测11次,检出限LOD=3SD,其中SD表示测量的标准偏差。根据IUPAC指南计算定量限,定量限LOQ为标准偏差的10倍,即LOQ=10SD,结果如表2所示。

表2 8种元素的检出限和定量限Table 2 Detection limits and quantification limits of 8 elements
2.5.2 加标回收率及精密度


表3 标准加入法下8种元素的低、中、高浓度溶液在血液和尿液中的回收率Table 3 Recoveries of low,medium and high concentration solutions of 8 elements in blood and urine under the standard addition method /%
选取血液、尿液样品的低、中、高(血液:10、50、100 μg/L;尿液:5、50、100 μg/L)浓度消解后溶液,连续测定11次,连续测定3 d,得到8种元素的日内和日间精密度。如表4所示,血液中各元素的日内和日间精密度为0.90%~8.7%和0.73%~1.9%;尿液中各元素的日内和日间精密度为0.30%~3.0%、1.5%~7.7%,说明该方法对血液和尿液中重金属和准金属元素的测定值准确可靠。

表4 血液和尿液中8种元素的日内和日间精密度Table 4 Intra-day and inter-day precision of 8 elements in blood and urine(n=11) /%
3 结论与展望
建立了采用直接稀释方法对血液、尿液样品进行前处理,并应用标准加入法和KED模式定量的ICP-MS检测方法,灵敏准确、快速便捷、准确性高,适用于血液、尿液中多种重金属和准金属元素的检测。本文比较了不同浓度和种类的ICP-MS增敏剂的效果,调整了清洗时间,有效避免了测定过程中的记忆效应,引入内标元素In调节仪器信号漂移并补偿基体干扰,同时KED模式使用He作为碰撞气与多原子离子碰撞裂解,利用电压差过滤低动能离子,有效抑制了检测过程中的多原子离子干扰,相关方法验证结果均能满足测定要求。应注意为避免样品中未消解的有机物在雾化器和锥口上沉积导致仪器信号漂移,使用时应当在灵敏度允许的范围内,根据实际情况和相关文献报道尽量以大倍数稀释样品,以减少样品基质对仪器的影响。
