NaHCO3溶液浓度改变引起的支配质子转移反应变化:从质子自递反应到水解反应
2024-03-04柳青刘建宇王海水
柳青,刘建宇,王海水
1 华南理工大学分析测试中心,广州 510640
2 华南理工大学化学与化工学院,广州 510640
NaHCO3属于两性物质,既可以给出质子,也可以接受质子。水溶液中存在如下质子转移平衡[1,2]:
Kw为水的质子自递常数,Ka1(4.2 × 10−7)和Ka2(5.6 × 10−11)分别为碳酸的一级和二级解离常数[3],Ks为的质子自递常数,Kb2为的二级碱式解离常数。
碳酸氢钠溶液浓度越大,式③和式④进行的程度越大,两反应产生的H+和OH−越多,式③产生的H+和式④产生的OH−结合生成水,即反应⑤,
式⑤平衡常数为1/Kw。式②可以看做式③ + ④ + ⑤,其平衡常数Ks=Ka2Kb2× 1/Kw=Ka2/Ka1= 1.33 ×10−4。
在反应物种类及浓度相同的情况下,酸碱反应进行的程度可以用反应的平衡常数来衡量。比较式③和式④,因为Kb2>Ka2也就是Ka1Ka2<Kw,所以,[OH−] > [H+],NaHCO3溶液为碱性。碳酸氢钠溶液的质子平衡方程为:,从可以推出:碳酸氢钠溶液中存在关系式。注意式③可以写成。为了便于与式④反应物比较,本文采用式③形式。
溶液浓度c变化,溶剂水的浓度几乎保持不变。极稀溶液中,比如1.0 × 10−9mol·L−1NaHCO3溶液中,溶液pH ≈ 7.00,则可推导出关系式,注意[Na+] = 1.0× 10−9mol·L−1。也就是说式②、③和④生成的H2CO3和很少,溶液的酸碱性质主要由起支配作用的质子反应H2O ⇌ H++ OH−控制。
对于式②、③和④,质子反应进行的程度除了与平衡常数有关,还与NaHCO3溶液浓度c有关。随着浓度c增大,溶液碱性增加,与质子转移相关的产物H2CO3、H+、OH−和的相对含量也会发生变化。费德军[4]计算结果表明,0.1000 mol·L−1NaHCO3溶液中,存在关系式,表明该浓度下H2O ⇌ H++ OH−已经不占支配地位。
0.1000 mol·L−1NaHCO3溶液中,哪个质子反应占支配地位呢?寻找支配质子反应与NaHCO3溶液浓度c的关系,研究多重化学平衡中的不同质子反应之间的移动规律,即能加深对两性物质溶液多重平衡的认识,也能避免NaHCO3(两性)溶液与同浓度的CH3COONa (弱碱)溶液比较pH大小这一类问题的产生。通常,只有同类性质的物质溶液才能比较pH大小。
1 支配质子转移反应与溶液浓度c关系
首先,利用Matlab获得各种浓度(0.10, 0.075, 0.050, 0.025, 0.010, ·····, 5.0 × 10−6, 2.5 × 10−6, 1.0 ×10−6mol·L−1)的NaHCO3溶液氢离子浓度准确值[H+]。质子反应式①、②、③和④的产物为,c为溶液分析浓度。求算得到不同c时溶液的pH、pOH、pA和pH2A。其中,,pH2A = −lg[H2CO3]。以分析浓度pc (pc = −lgc)作横坐标,以pH、pOH、pH2A和pA为纵坐标,绘制各组分浓度动态图,见图1。
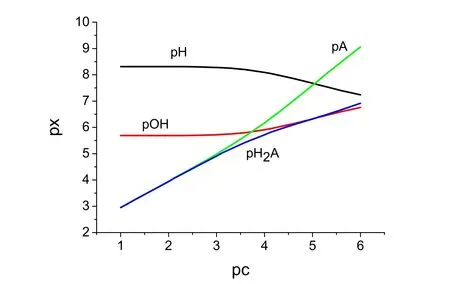
图1 碳酸氢钠溶液中pH2A、pA、pH和pOH随溶液浓度c (mol∙L−1)变化曲线
图1清晰地表明:[OH−] > [H+]和恒成立,表明NaHCO3溶液呈碱性。
图1中,可以观察到不同曲线间有3个交点。pOH与pA交点处,对应NaHCO3溶液浓度c= 1.82 ×10−4mol·L−1,注意1.82 × 10−4mol·L−1≈Kb1(Kb1=Kw/Ka2= 1.79 × 10−4)。NaHCO3溶液浓度c= 9.1 ×10−6mol·L−1时,pA与pH相交,pOH与pH2A相交。
NaHCO3溶液中存在以下四种质子转移平衡[1,2]。
质子自递反应:
溶质溶剂酸碱反应:
容易计算,极稀NaHCO3溶液(c<< 1.0 × 10−7mol·L−1),溶液pH ≈ 7.00,OH−和H+为溶液主要离子,,因此有,此时质子反应H2O ⇌ H++ OH−居支配地位。反应式②、③和④生成的产物相对数量可以忽略不计。
注意pOH与pH2A交点处,即9.1 × 10−6mol·L−1溶液中,关系式成立,表明产生H+的反应式①和③居次要地位,产生的反应式②和③也居次要地位,即质子反应式①、②和③均居次要地位。实际上,浓度9.1 × 10−6mol·L−1附近,质子反应占据支配地位。此时,可以将NaHCO3溶液视作一元弱碱溶液。注意溶液浓度较大时,即c>> 9.1 ×10−6mol·L−1时,不可将碳酸氢钠溶液视作一元弱碱溶液。
例1计算5.0 × 10−6mol·L−1碳酸氢钠溶液的pH。
解:5.0 × 10−6mol·L−1接近9.1 × 10−6mol·L−1,NaHCO3溶液可视作一元弱碱溶液。
Kb2= 2.38 × 10−8,c≥ 105Kb2,cKb2≥ 10Kw,则[5]:
溶液pH = 7.54。与溶液准确值[H+] = 2.91 × 10−8mol·L−1比较,计算结果满足要求。
对于1.0 × 10−6mol·L−1碳酸氢钠溶液,图1表明,关系式成立,量非常少,表明生成的反应式②和③居次要地位,质子转移反应主要为。
图1左端,c≥ 10Kb1= 1.79 × 10−3mol·L−1时,存在关系式。质子转移反应居支配地位。值得强调的是,文献中,①、③和④三个质子转移平衡已经是科学界的共识,而的质子自递反应,还没有得到广泛认可[4,5]。图1清晰表明,c≥ 1.79 × 10−3mol·L−1时,只有占据支配地位,才能更合理地解释关系式成立。溶液中,占据支配地位时,,与溶液浓度c无关。
2 结论
本文研究了NaHCO3溶液的多个质子转移反应和多重化学平衡与溶液浓度c的关系,得到了下列重要结论:
1)浓度c≥ 10Kb1时,即c≥ 1.79 × 10−3mol·L−1时,质子自递反应占据支配地位,溶液,与溶液浓度c无关。
2) 浓度c在9.1 × 10−6mol·L−1附近时,水解反应占据支配地位。碳酸氢钠溶液可作为一元弱碱处理。
3)浓度在1.79×10−3– 9.1×10−6mol·L−1区间时,从占据支配反应,逐渐过渡到两反应共同为主要反应,再过渡到为支配反应。
4) 极稀溶液,c<< 1.0 × 10−7mol·L−1时,水的离解反应H2O ⇌ H++ OH−占据支配地位。
