双碳之光
——利用光化学制氢实现“双碳”目标的希望之光
2024-03-04欧阳述昕高云翔范塬嫄王灿原弘
欧阳述昕,高云翔,范塬嫄,王灿,原弘
华中师范大学化学学院,化学国家级实验教学示范中心(华中师范大学),武汉 430079
1 引言
从石器时代到现代社会,人类的生活品质不断提高,对能源及其能量密度的需求也在不断增长。以西方各国所领导的多次能源革命让人类的步伐走得更快、更远,但化石能源的过度使用导致的温室效应加剧等问题也日益凸显。联合国气候变化框架公约《巴黎协定》的实施代表了全球绿色低碳转型的大方向[1]。作为发展中的经济大国,我国政府承诺力争于2030年前实现碳达峰,2060年前实现碳中和[2](以下简称“双碳”)。
在对能源需求不降反增和实现“双碳”目标的双重压力下,大力发展清洁能源迫在眉睫。在各类可再生能源中,部分科学家将目光聚焦于能量之源——太阳,据统计太阳每秒向地球辐射的能量约为1.73 × 1017J[3,4],相当于燃烧800万吨煤,超过地球一天所需的能源。然而,由于地域差异、供需失衡、“三弃”(弃水、弃风、弃电)等问题,必须寻找新型的能源载体。氢气(H2)因质轻、清洁、能量密度高(表1)等多种优势备受青睐,若能实现太阳能到氢能的高效转化,将带来巨大的能源变革。光化学分解水方法制氢便是该领域的研究热点,其以零排放等优势而成为“双碳之光”,承载着人类的希望。近年来,国家相继出台了一系列氢能产业未来发展战略政策[5–8],为构建氢循环提供了保障。

表1 四种可燃物的性质
地球表面的水资源较为丰富,约有70%以上的面积被水所覆盖。水(H2O)中含有氢(H)、氧(O)两种元素,根据物质守恒定律,水分解时应产生H2和氧气(O2)两种气体。然而,此反应为吸热反应且焓变相当高(ΔH= 237.13 kJ·mol−1),若想利用热能来实现水分解则需要2000 °C以上的高温[4]。在溶液中,水存在着微弱的电离平衡,理论上当向体系中提供电子(e−)时(如通电或加入活泼金属等),溶液中的氢离子(H+)可得到电子而被还原为H原子,进而相互结合形成H2并从溶液中析出。以电解水(图1A)为例,为了增强溶液的导电性,通常会加入电解质,如氢氧化钾(KOH)、盐酸(HCl)等,由标准电极电势(φϴ)计算所得水的理论分解电压(Eϴ)约为1.23 V (图1B)。

图1 (A) 电解水实验装置图[10];(B) 酸性和碱性电解液中电极反应及电势[11]
通过将电能转化为氢能,将有效地解决“三弃”等问题,光伏电化学制氢便应运而生。此外,为了减少太阳能转化至氢能的过程损耗,科学家尝试将太阳能直接用于水分解制氢,光催化制氢方法研究正如火如荼地进行中。本文主要介绍这两种光能驱动的制氢方法,并通过探究实验和科普活动方案向受众传播实现“双碳”目标的思想,普及发展氢能的意义及目前制约氢能发展的因素。
2 实验部分
2.1 实验原理
2.1.1 光伏电催化制氢
光伏电催化制氢(图2)是将光伏发电和电解水结合的一种可再生能源制氢方式,其中光伏发电是利用半导体界面的光生伏特效应将光能直接转变为电能,相关机理已被广泛研究[3,12,13]。而常用于电解水的电极有碳棒、铂电极等,由于超电势(η)的存在,使得实际水分解电压(可由Tafel经验公式算出)要高于理论分解电压,这增加了电解水制氢的成本,因此有必要对电极改性以获得更加经济的制氢材料。本文中所用电极以泡沫镍(泡沫Ni)为载体,阴极电镀铂(Pt)以降低析氢超电势,阳极采用水热法沉积镍铁层状双金属氢氧化物(NiFe-LDH)以降低析氧超电势。
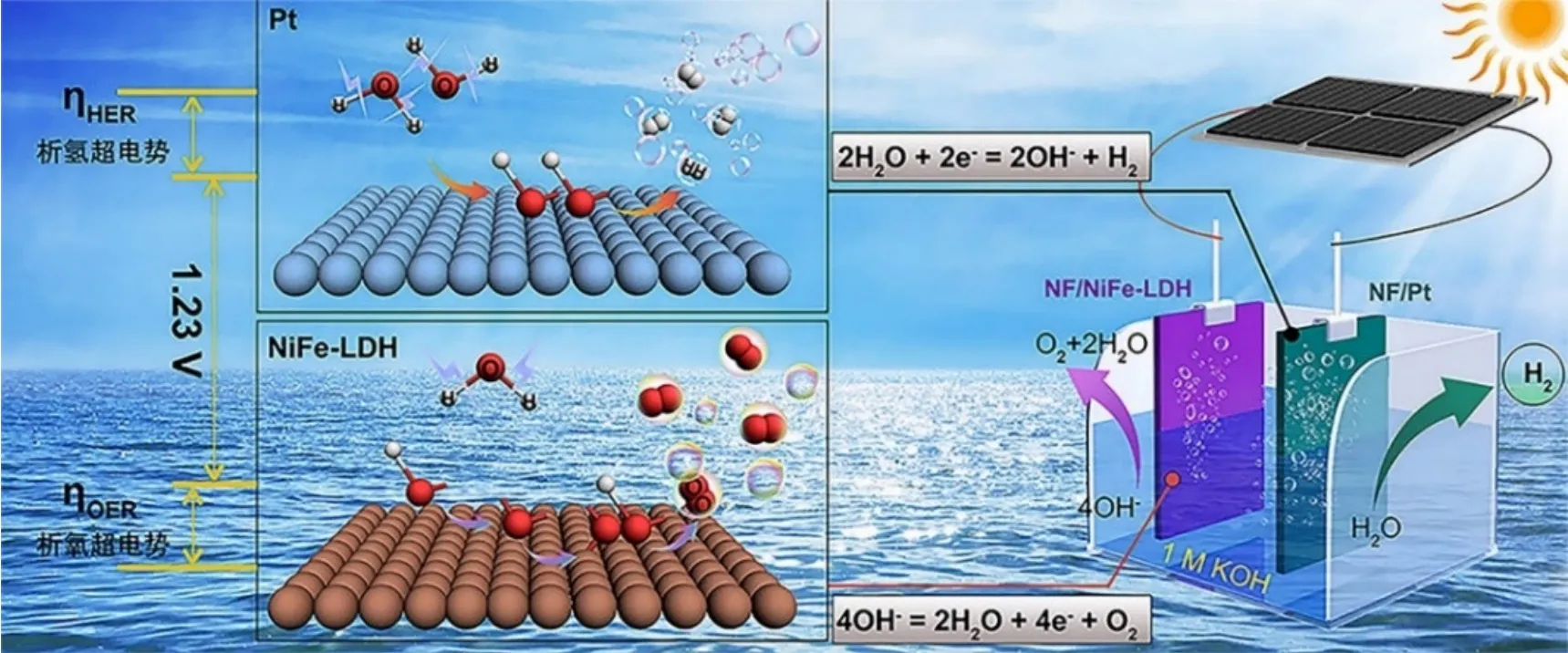
图2 光伏电催化分解水示意图
2.1.2 光催化制氢
光催化制氢是一种利用半导体特定的能带结构与H+还原及H2O的氧化电位进行匹配实现分解水制氢的方式。根据能带理论,当半导体吸收能量等于或大于其带隙的光子时,电子将从价带(VB)激发至导带(CB),从而产生光生电子(e−)和空穴(h+),其分别具有还原性和氧化性,经转移至半导体表面后与吸附在半导体表面的物质发生氧化还原反应,从而三步驱动光催化反应[4](图3)。1972年Fujishima等人首次报道了二氧化钛(TiO2)电极上光分解水的现象[14],但由于TiO2为宽带隙半导体,不能吸收可见光,因而太阳能利用率较低。之后新型半导体材料如Ni掺杂InTaO4、ZnO-GaN固溶体及氮化碳[15–17]等相继涌现,将光吸收拓宽至可见光区域。本文采用Pt负载在TiO2作为光催化剂。
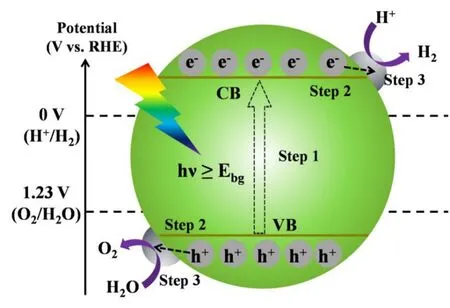
图3 光催化制氢原理示意图[4]
2.2 试剂或材料
所使用的实验试剂与材料如表2所示。

表2 实验试剂与材料
2.3 实验仪器
所使用的实验仪器如表3所示。
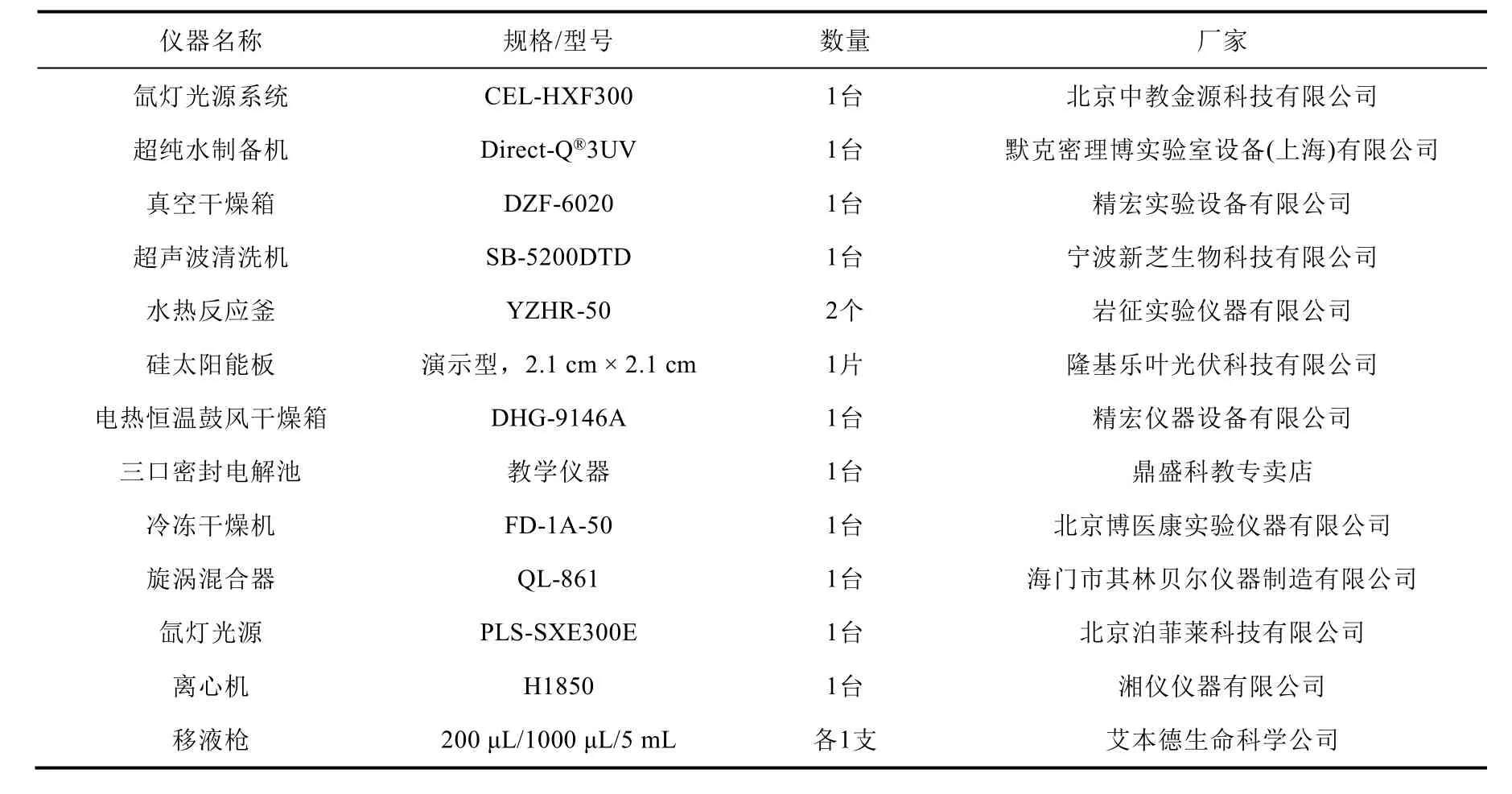
表3 实验仪器
2.4 实验材料/步骤/现象
2.4.1 电解水
2.4.1.1 电解KOH溶液
(1) 配制1 mol·L−1KOH溶液:称取28.0550 g KOH固体,并溶于500 mL水中;
(2) 将所配制的KOH溶液倒入电解水装置至满,塞上橡胶管防止漏气,用导线接上外接电源(3–12 V电压可变,电流2 A);
(3) 启动电源(9 V),可观察到两极均有气体产生,且体积比约为2 : 1(图4)。

图4 相关电解实验现象
2.4.1.2 电解饱和NaCl溶液和HCl溶液
为了展示在不同酸碱性下的实验现象,将2.4.1.1节中的电解质溶液依次换为饱和NaCl溶液(需滴加3滴酚酞)及2 mol·L−1HCl溶液,重复前述步骤。可分别观察到两者阴极均有气体产生,且前者阴极区溶液变红。而两者阳极区底部均变为绿色,可能是由于产生的氯气(Cl2)溶于水所致。
2.4.2 光伏电催化制氢
2.4.2.1 光伏电催化电极制备
a. 析氢电极
(1) 配制电解液:称取0.2840 g硫酸钠固体于三口密封电解池中,加入2 mL 4 mg·mL−1氯铂酸溶液和20 mL水;
(2) 电镀Pt:以2 cm × 3 cm的泡沫镍为阴极,碳棒为阳极,5 mA电流下室温搅拌3 h;
(3) 取下电极,用水洗净,自然干燥,得到镀Pt的泡沫镍电极。
b. 析氧电极
(1) 裁剪2 cm × 3 cm的泡沫镍于离心管中,水浸没后超声清洗16 min (设定仪器参数:功率为96%、工作频率为40 MHz);
(2) 分别称取0.3000 g Ni(NO3)2、0.4000 g Fe(NO3)3·9H2O、0.3300 g尿素并加入反应釜中,加入80 mL水,室温下用磁力搅拌器在300 r·min−1搅拌1.5 min,使固体完全溶解;
(3) 将b(1)中的泡沫镍放入反应釜中,于烘箱中120 °C下反应12 h;待反应完成,打开反应釜取出泡沫镍,其表面附着暗黄色沉淀;
(4) 将上述样品用乙醇和水交替冲洗并超声清洗3 s以除去表面不牢固的附着沉淀;
(5) 将清洗所得样品置于烧杯中,烧杯用保鲜薄膜密封(膜上扎有均匀小孔),置于60 °C真空干燥箱中干燥,得到NiFe-LDH电极。
2.4.2.2 实验装置搭建
将硅太阳能板置于氙灯光源正下方,在三口密封电解池中加入电解液,用导线将二者连接(硅太阳能板的正极与NiFe-LDH电极相连,负极与镀Pt的泡沫镍电极相连) (图5)。

图5 光伏电催化制氢装置图
方案一:将NiFe-LDH电极、镀Pt电极插入至三口密封电解池中。
方案二:在方案一的基础上于两电极间加入物理隔板。
方案三:在方案一的基础上于两电极间加入质子交换膜。
2.4.2.3 实验步骤
(1) 配制1 mol·L−1KOH溶液:称取28.0550 g KOH并溶解于500 mL水中;
(2) 向三口密封电解池加入25 mL 1 mol·L−1的KOH溶液,将电镀有Pt的泡沫镍电极、NiFe-LDH电极插入电解池中(电极片浸入长度约为2 cm);
(3) 打开氙灯,观察两个电极表面的变化;
(4) 分别用半透明和黑色遮光板遮挡氙灯出射光,观察电极片表面变化;取走遮光板,观察电极片表面的变化;
(5) 反应一段时间后,用针管吸取0.1 mL实验产生的气体于气相色谱仪中检测;
(6) 关闭氙灯电源开关,分别按照方案二和三搭建实验装置,重复本小节中的步骤(1)−(5)。
2.4.2.4 实验现象
(1) 打开氙灯光源,两电极均有气泡产生,NiFe-LDH电极片比泡沫Ni电极片上产生的气泡少;气泡产生速率随电流增大而加快;当氙灯光源被遮挡时,两电极片上产生气泡逐渐变少,黑色挡板完全遮挡时无气泡产生;取走遮光板,电极片上重新产生气泡(图6)。

图6 (A) 不遮光实验;(B) 遮光实验;(C) 气相色谱检测的产出气体体积随光照时间变化图
(2) 方案一:反应收集气体为混合气体,气相色谱检测结果为H2: O2= 2 : 1;方案二、三:两极产生的气体被分离。
2.4.3 光催化制氢
2.4.3.1 光催化材料制备
a. Pt的负载
(1) 称取250 mg锐钛矿二氧化钛(TiO2)于250 mL烧杯中,加入25 mL甲醇水溶液(体积比1 : 4),超声10 min;
(2) 加入16.5 mL 4 mg·mL−1氯铂酸溶液,加入磁子搅拌,在600 r·min−1下光照2 h;
(3) 离心,用水洗净,置于冷冻干燥机中冷冻干燥(条件:-43 °C,68.0 Pa),得到灰黑色固体,研磨,得到Pt-TiO2粉末。
b. 载玻片的涂覆
(1) 称取50 mg制备的Pt-TiO2粉末于离心管中,分别用1000 µL移液枪、200 µL移液枪移取2.5 mL乙醇和25 µL Nafion溶液,加入离心管中,超声30 min;
(2) 剪裁2 cm × 3 cm的载玻片,用100 µL移液枪移取上述溶液均匀滴于载玻片上,红外灯照射使溶剂蒸发而制备材料牢固地附着于载玻片上,不断重复,得到Pt-TiO2均匀涂覆的载玻片。
2.4.3.2 实验步骤
(1) 配制甲醇水溶液:将40 mL甲醇和160 mL水混合均匀;
(2) 将Pt-TiO2均匀涂覆的载玻片放置在单口反应器中,载玻片底部与顶部分别与反应器两对侧的容器壁紧靠,防止其在反应中发生移动或倾倒;
(3) 将(1)所配制的反应溶液倒入反应器直至涂覆有催化剂的载玻片被完全淹没,盖上塞子;
(4) 将反应器侧面的抽气孔与抽气泵连接,抽气10 min,断开抽气泵;
(5) 设置氙灯出射光与载玻片夹角为120°-135°,打开氙灯,观察载玻片表面变化;
(6) 用黑色遮光板遮挡氙灯出射光,观察载玻片表面变化;取走黑色遮光板,观察载玻片表面变化。
2.4.3.3 实验现象
打开氙灯光源,涂覆有催化剂的载玻片上有气泡产生,气泡产生速率随氙灯电流增大而增大。当氙灯出射光被遮光板遮挡时,涂覆有催化剂的载玻片上产生的气泡逐渐变少;取走遮光板,载玻片上产生气泡速率加快(图7)。

图7 光催化实验装置(A);低强度光(B)、高强度光(C)照射分解水产氢实验现象
2.4.4 气体性质实验
2.4.4.1 密度实验
向气球中分别充入氢气和氧气,并用细绳系紧,松手后氢气球上升,而氧气球下沉(图8A)。

图8 气体性质实验现象
2.4.4.2 氢气燃烧实验
(1) 点燃氢气球:(在较为空旷的地方进行,该实验具有危险性,建议录制视频并在科普活动中播放)将氢气球系在重物上防止气球放飞,再将缠有火柴的铁丝固定在遥控汽车尾部,点燃火柴,移动小车使火柴接触氢气球,观察氢气球剧烈燃爆现象(图8B)。
(2) 肥皂泡实验:将氢气发生装置(如铁粉和水蒸气反应等)产生的氢气经弯导管导入肥皂液中,用点火枪点燃肥皂泡,观察到明显爆炸和火焰(图8C)。
(3) 氢气纯度检验:用向下排空气法收集电解水产生的氢气于试管中,拇指按紧,置于酒精灯火焰上方后松开拇指,观察到氢气燃烧,发出爆鸣声(图8D)。
2.4.4.3 氧气助燃实验
木条复燃实验:点燃长火柴,甩动火柴至火焰熄灭,将带火星的木柴放入实验收集的氧气瓶中,观察到木柴复燃(图8E)。
3 科普展示和互动方案
3.1 科普理念
通过介绍化石能源的过度燃烧带来的环境问题,引出国家氢能发展战略及目前已有的制氢方式[18–20],了解实现碳中和目标的两种策略:一是构建氢循环,二是利用其平衡碳循环,感受科学前沿与未来生活的密切联系(图9);通过一系列实验互动(表4–表6)和生活情景导入(表7),让受众了解氢气的性质及氢能的特点,感受化学的魅力,体会氢气易燃、易爆导致其难储存和运输的难点;通过类比已有制氢方法和光化学制氢现象的差异,了解后者产生绿氢[21,22]的优越性,知道其有待提高的方面,体会未来氢能的发展任重道远。
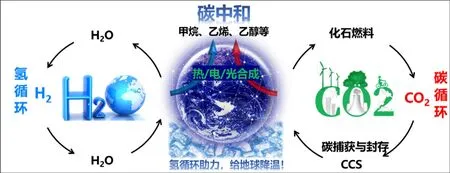
图9 氢循环助力碳中和理念示意图

表4 小学生科普互动方案

表5 中学生科普互动方案

表6 成人群体科普互动方案
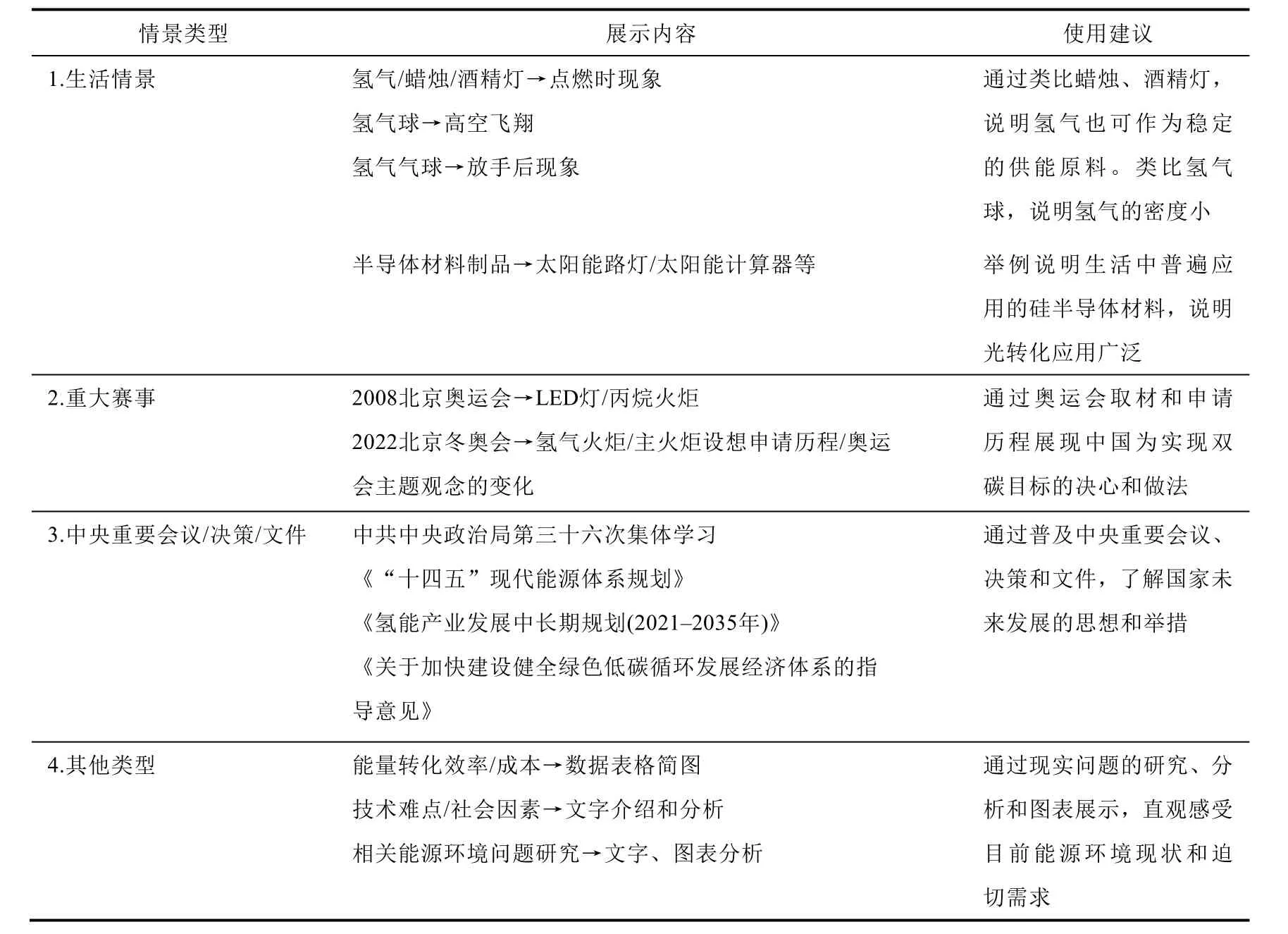
表7 科普实施情景活动建议
3.2 展示及互动方案
实验过程涉及到光、电、试剂、燃烧、爆炸等因素,务必有专业人士现场指导,并对演示场所和人群进行评估后再开展活动。此外,针对于不同的受众群体,可依据实际情况选择性增补、挖掘和使用相关实验,本文所展示的互动方案仅供参考。
4 结语
首先,本文基于既要满足人类不断增加的能源需求,又要实现“双碳”目标的现实问题,聚焦于光化学制氢这一“双碳之光”,详细介绍了光伏电催化和光化学催化两种制氢方法,并通过探究实验和科普方案向受众传播实现“双碳”目标的思想和路径,普及发展氢能的意义。
其次,本文设置了一系列性质实验和趣味实验使大、中、小学生及社会群众了解氢气和氧气的性质特点,感受化学的魅力,激发其对化学学科学习的兴趣。同时,通过实验知道氢气易燃、易爆的性质,理解其导致储存和运输的困难,形成性质决定用途的科学思想。
最后,通过介绍化石能源过度燃烧带来的环境问题,自然引出构建氢循环和平衡碳循环以实现碳中和目标的两种策略,让受众感受科学前沿与未来生活的密切联系,激起未来有意投身于此领域的潜在人才的兴趣和决心。
5 特点/创新性
(1) 现实化:“双碳之光”,一语双关,围绕现实问题激起该领域潜在人才志向。
(2) 模块化:以知识顺序和认知特点分设三方案一情景模块,有灵活性和针对性。
(3) 层次化:对不同群体,同一实验的科普程度存在层级,多手段使效果更凸显。
