溶液燃烧法制备长余辉发光材料
——介绍一个大学化学综合性实验
2024-03-04周盈吉唐子灵周丁香唐万军
周盈吉,唐子灵,周丁香,唐万军
中南民族大学化学与材料科学学院,武汉 430074
1 概述
与一般发光材料不同,长余辉发光材料指的是在自然光或其他人造光源照射下能够存储外界光辐照的能量,然后缓慢地以可见光的形式释放这些存储能量的光致发光材料[1]。长余辉发光材料按照基质成分划分,主要包括硫化物型、碱土铝酸盐型、硅酸盐型及其他基质型。20世纪90年代开发成功的以碱土铝酸盐为基质的稀土长余辉发光材料[2],具有发光效率高、余辉时间长、化学性质稳定、无放射性污染等优点,引起了人们对长余辉发光材料的广泛关注。自诞生以来,以Eu2+激活的碱土铝酸盐为代表的长余辉发光材料的制备及其应用开发,一直是发光材料领域研究的热点[3–5]。CaAl2O4:Eu2+,Nd3+、SrAl2O4:Eu2+,Dy3+和BaAl2O4:Eu2+,Dy3+是三种常见的长余辉发光材料,广泛应用于各种荧光粉和夜视显示。这三种材料的发光性能见表1。在这三种材料中,Eu2+是发光的激活剂,Dy3+和Nd3+是形成长余辉发光的敏化剂。

表1 三种碱土铝酸盐长余辉发光材料的发光性能比较
碱土金属铝酸盐长余辉发光材料的常用合成方法为高温固相法[6–8]。以碱土金属碳酸盐、氧化铝,以及高纯稀土氧化物为原料,反应温度为1300–1400 °C,反应时间为3–5 h,通入H2或CO将原料中的Eu3+还原为Eu2+。本实验采用的合成方法是溶液燃烧法,其与高温固相法相比,具有如下优点:① 原料各组分在水溶液中均匀混合,产物为泡沫状,易于研磨;② 反应温度低,采用普通的电炉即可得到目标产物;③ 耗时短,只需十几分钟就能完成反应;④ 调控尿素用量即能控制气氛的氧化-还原性,不需要另外通入还原性气体[9];⑤ 实验设备简单,可利用学院开放的粉末X射线衍射仪、荧光光度计等仪器设备对所得样品进行表征。
学生能够在指定课时内顺利地完成实验内容,分析讨论测试数据,探索影响材料发光性能的主要因素,并学以致用,将得到的长余辉发光粉应用于各种科普小制作。在国内外的实验教学中几乎没有涉及溶液燃烧法的实验。将本实验内容引入大学化学实验,可以帮助学生理解溶液燃烧和光致发光原理。本实验让学生经历了一个“材料合成–物性表征–性能测试”的科研过程,有助于巩固学生的专业基础知识,培养学生的科研兴趣,从而实现创新型人才的培养。
2 实验目的
(1) 通过查阅文献,了解光致发光和长余辉发光的基本原理;
(2) 掌握溶液燃烧法制备碱土金属铝酸盐材料的基本原理;
(3) 学习发光性能的测试方法和XRD图谱分析方法,了解荧光光度计、屏幕亮度计的操作方法,了解物质结构的测试方法;
(4) 探索基质化学组成、燃料、助熔剂,以及敏化剂对材料发光性能的影响规律。
3 实验原理
本实验以金属硝酸盐为氧化剂,尿素为还原剂,少量硼酸作助熔剂。所有原料溶于适量蒸馏水,经过搅拌,形成均匀溶液。把溶液放入普通坩埚中,置于普通电炉上加热。达到一定温度后,溶液发生如下快速燃烧反应:
调节尿素和硝酸盐比例,在尿素过量的前提下,燃烧过程产生还原性气氛将Eu3+还原为Eu2+,直接得到CaAl2O4:Eu2+,Nd3+、SrAl2O4:Eu2+,Dy3+、BaAl2O4:Eu2+,Dy3+发光材料。在原料中加入硼酸作为助熔剂,以提高样品的结晶性能。添加Dy3+和Nd3+等稀土离子作为Eu2+发光的敏化剂[10],可提高Eu2+的发光强度和余辉时间。采用不同的碱土硝酸盐,从而得到不同发光颜色的荧光粉。
4 试剂和仪器
试剂:四水硝酸钙(分析纯,99.0%),硝酸锶(分析纯,99.0%),硝酸钡(分析纯,99.0%),九水硝酸铝(分析纯,99.0%),尿素(分析纯,99.0%),硼酸(分析纯,99.0%),氧化铕(光谱纯,99.99%),氧化镝(光谱纯,99.99%),氧化钕(光谱纯,99.99%),以上试剂购买于国药集团化学试剂有限公司。Eu2O3、Dy2O3和Nd2O3溶于硝酸,用蒸馏水定容,分别得到浓度为1.00 × 10−4mol·L−1的Eu(NO3)3、Dy(NO3)3和Nd(NO3)3溶液。
仪器:FA2004分析天平(上海舜宇恒平科学仪器有限公司),FL-1可调式封闭电炉(天津市泰斯特仪器有限公司),SX2-10-10箱式电阻炉(湖北英山县建力电炉制造有限公司),ZF-1型三用紫外线分析仪(上海金鹏分析仪器有限公司),F-7000荧光光度计(日本HITACHI公司),Brucker X射线多晶粉末衍射仪(德国Bruker公司),ST-86LA屏幕亮度计(北京师范大学光学仪器厂)。
5 长余辉发光粉的制备
以0.005 mol的SrAl2O4:0.02Eu2+,0.02Dy3+,0.05B目标产物的制备过程为例。
(1) 在100 mL陶瓷坩埚中,加入6.00 g的尿素、18.0 mg的H3BO3、1.0582 g的Sr(NO3)2和3.7513 g的Al(NO3)3·9H2O,分别滴加Eu(NO3)3和Dy(NO3)3溶液各1.0 mL,加入少量蒸馏水,剧烈搅拌,得到无色透明溶液,如图1a。

图1 (a) 原料混合物溶液;(b) 自然光下的燃烧产物;(c) 紫外光下的燃烧产物
(2) 将装有溶液的坩埚放置于电炉上,接通电源,约2 min时溶液开始沸腾,10 min左右溶液燃烧,火焰持续约10 s,在坩埚中形成白色泡沫状固体,如图1b。
(3) 关闭电源,样品自然冷却至室温,研磨,得到组成为SrAl2O4:0.02Eu2+,0.02Dy3+,0.05B的发光粉样品,装入封口袋,以备下一步测试。
(4) 以Ba(NO3)2取代Sr(NO3)2,称取1.3067 g Ba(NO3)2,其余步骤同上,得到组成为BaAl2O4:0.02Eu2+,0.02Dy3+,0.05B的发光粉样品。
以Ca(NO3)2·4H2O取代Sr(NO3)2,称取1.1807 g Ca(NO3)2·4H2O,以Nd3+溶液代替Dy3+溶液,其余步骤同上,得到组成为CaAl2O4:0.02Eu2+,0.02Nd3+,0.05B的发光粉样品。
6 实验结果
6.1 所得样品的发光情况
分别在自然光和紫外光(365 nm)下观察各样品的发光现象,并通过拍照来记录样品在自然光和紫外光下的颜色。在自然光下,粉末状的SrAl2O4:Eu2+,Dy3+样品呈现淡淡的绿色,CaAl2O4:Eu2+,Nd3+和BaAl2O4:Eu2+,Dy3+两种样品为白色的粉末。在自然光照射后转移至暗处,仍能观察到SrAl2O4:Eu2+,Dy3+样品发出一定亮度的绿光,CaAl2O4:Eu2+,Nd3+和BaAl2O4:Eu2+,Dy3+两种样品分别发出微弱的蓝光和青绿光。
在紫外灯照射下,SrAl2O4:Eu2+,Dy3+发出明亮的绿光(见图1c,CaAl2O4:Eu2+,Nd3+和BaAl2O4:Eu2+,Dy3+分别发出蓝光和青绿光。关掉紫外灯后,在黑暗中SrAl2O4:Eu2+,Dy3+样品发出绿色的余辉,并能持续相当长的一段时间。CaAl2O4:Eu2+,Nd3+和BaAl2O4:Eu2+,Dy3+两种样品分别发出的蓝色余辉和青绿色余辉,持续时间与SrAl2O4:Eu2+,Dy3+相比较短。
6.2 物相表征及光谱特性
图2a为制备得到的CaAl2O4:Eu2+,Nd3+样品的粉末X射线衍射(XRD)图谱。各衍射峰峰型尖锐,衍射峰位置以及相对强度与尖晶石型CaAl2O4相(PDF卡片编号:#70-0134)完全匹配,表明采用溶液燃烧法得到的样品为尖晶石型CaAl2O4相,具有较高的结晶度。
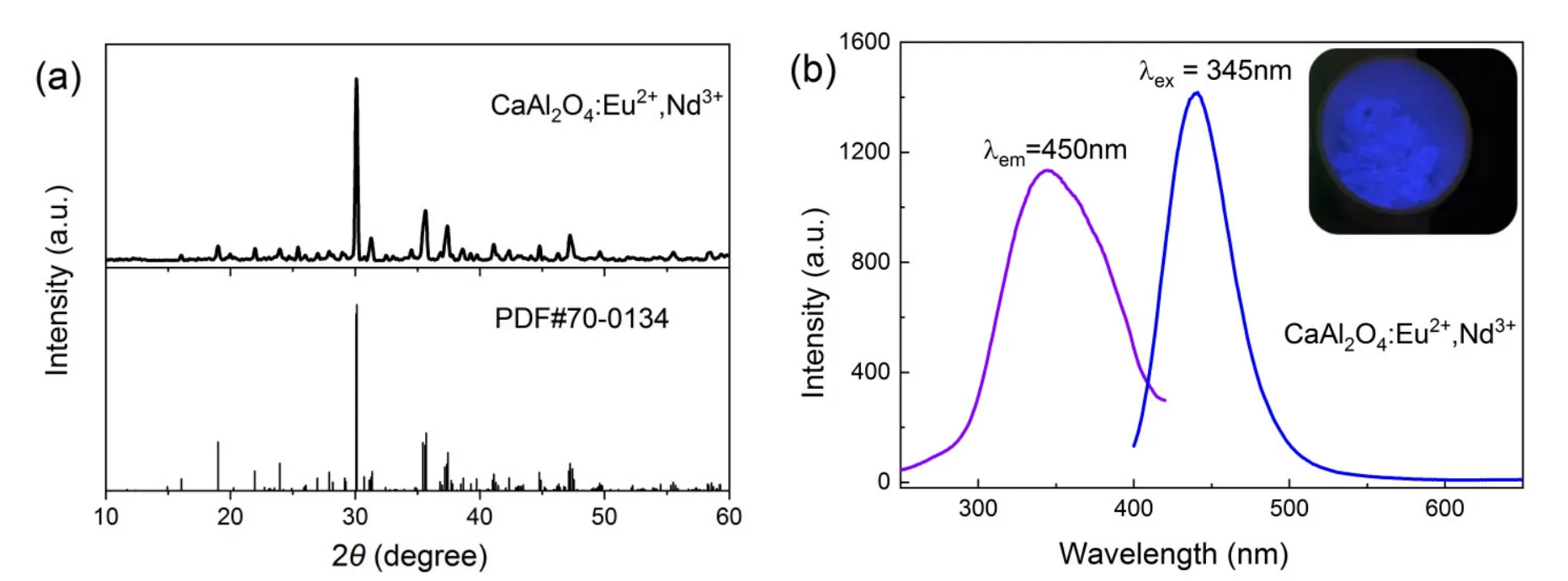
图2 (a) CaAl2O4:Eu2+,Nd3+样品的XRD图谱;(b) CaAl2O4:Eu2+,Nd3+样品的荧光光谱图,插图为样品在紫外灯下实物图
图2b为CaAl2O4:Eu2+,Nd3+样品的激发-发射光谱图。在波长为345 nm的紫外光激发下,样品发出宽谱带蓝光,最大波长位于450 nm。在发射波长为450 nm条件下记录样品的激发光谱,其激发波段为280–420 nm,其最大激发峰位于345 nm。
图3a为SrAl2O4:Eu2+,Dy3+样品的XRD图谱。各衍射峰峰型尖锐,各衍射峰的位置以及相对强度与尖晶石型SrAl2O4相(PDF卡片编号:#34-0379)完全匹配,表明得到的SrAl2O4:Eu2+,Dy3+样品为尖晶石型SrAl2O4相。样品结晶度良好,没有观测到其他杂相。
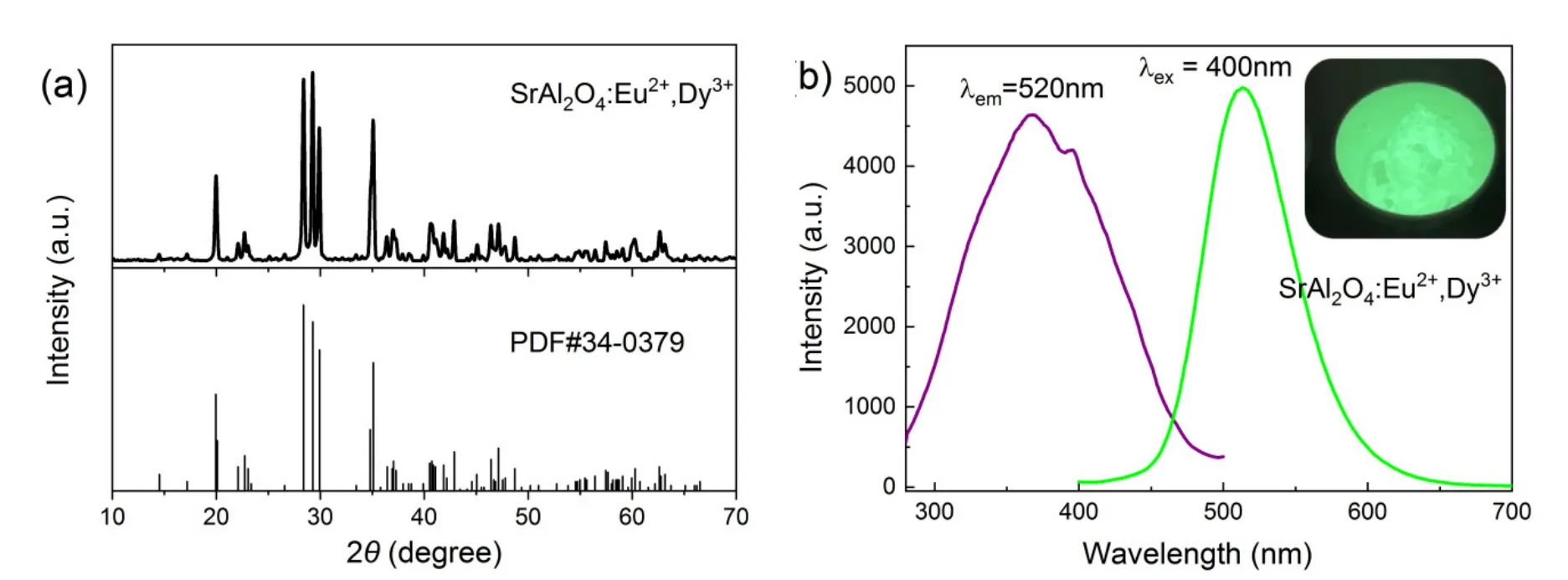
图3 (a) SrAl2O4:Eu2+,Dy3+样品的XRD图谱;(b) SrAl2O4:Eu2+,Dy3+样品的荧光光谱图,插图为样品在紫外灯下实物图
图3b为SrAl2O4:Eu2+,Dy3+样品的激发-发射光谱图。在400 nm的近紫外光激发下,样品发出最大波长为520 nm的宽谱带绿光。在发射波长为520 nm条件下测定样品的激发光谱,其激发波段为280–450 nm,其最大激发峰位于370 nm,同时在可见光区域也有很高的激发强度,表明这种发光材料能被近紫外光和可见光激发。
图4a为BaAl2O4:Eu2+,Dy3+样品的XRD测试结果,主要的衍射峰峰型尖锐,位置以及相对强度与尖晶石型BaAl2O4相(PDF卡片编号:#17-0306)匹配良好,表明所得样品主要为尖晶石型BaAl2O4相,结晶度良好。值得注意的是,在23.8°和33.1°附近可以观测到微弱的衍射峰,对应于BaCO3相,表明采用溶液燃烧法制备得到的 BaAl2O4:Eu2+,Dy3+样品可能产生少量的BaCO3杂相。

图4 (a) BaAl2O4:Eu2+,Dy3+样品的XRD图谱;(b) BaAl2O4:Eu2+,Dy3+样品的荧光光谱图,插图为样品在紫外灯下实物图
图4b为BaAl2O4:Eu2+,Dy3+样品的激发-发射光谱图。在350 nm的近紫外光激发下,样品发出最大波长位于500 nm的青绿光。在发射波长为500 nm条件下测定样品的激发光谱,其最大激发峰位于350 nm。
三种样品的XRD图谱表明:采用溶液燃烧合成法顺利得到高纯度的尖晶石结构的碱土铝酸盐物相,样品结晶度高。三种样品的激发-发射光谱均为宽带光谱,这是Eu2+的4f–5d跃迁产生的谱带[11],几乎观测不到Eu3+的4f–4f跃迁产生的线状光谱。光谱测定结果表明本实验采用的反应条件,即在封闭式电炉的温度条件下,控制原料中尿素的用量,燃烧过程中产生的还原性气氛能有效将原料中的Eu3+还原为Eu2+。
CaAl2O4:Eu2+,Nd3+、SrAl2O4:Eu2+,Dy3+和BaAl2O4:Eu2+,Dy3+三种样品分别置于360 nm紫外灯下照射10 min,然后关掉紫外灯,同时启动秒表记录荧光衰减时间。采用屏幕亮度计测定余辉亮度,每隔30 s记录一次亮度–时间数据,直至前后2 min内读数基本不变为止。图5为三种样品的余辉衰减曲线。BaAl2O4:Eu2+,Dy3+样品的发光持续时间较短,8 min后亮度计无法有效读数。SrAl2O4:Eu2+,Dy3+和CaAl2O4:Eu2+,Nd3+两种样品持续发光时间较长,在测试时间范围内,其发光亮度仍然远远高于人的肉眼观察下限(0.32 mcd·m−2)。
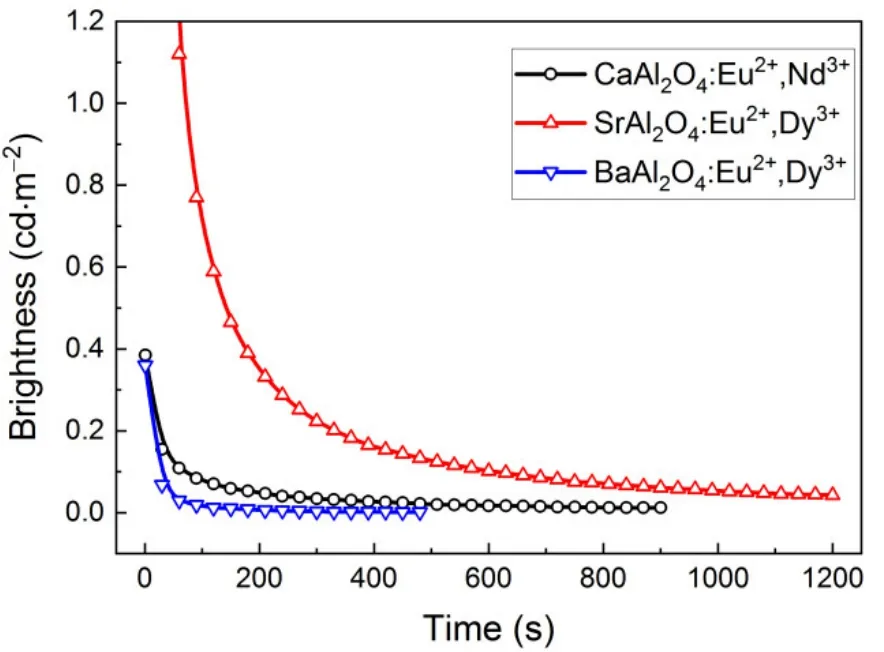
图5 CaAl2O4:Eu2+,Nd3+、SrAl2O4:Eu2+,Dy3+和BaAl2O4:Eu2+,Dy3+三种样品在360 nm紫外灯照射后的余辉衰减曲线
7 教学建议及组织运行方式
(1) 本实验涉及无机材料合成制备、稀土离子发光原理、发光性能的借助测定,以及应用拓展等环节,在数据处理过程中需要使用Origin软件来辅助学生完成XRD图谱、激发–发射光谱图谱,以及荧光衰减曲线的绘制。建议在修完无机化学和仪器分析课程的本科二、三年级学生中以综合实验的形式开设。
(2) 总学时8课时,合成及后处理2课时,发光性能测试、数据处理4课时,长余辉材料应用拓展1课时,讨论1课时。
(3) 可以根据实际情况进一步探究制备条件对材料发光性能的影响规律。在5.1小节的基础上,分别改变尿素、硼酸、Dy3+用量。其中,尿素用量:3.00、4.00、5.00、6.00、7.00、8.00 g;硼酸用量:0、6.0、12.0、18.0、24.0、30.0 mg;Dy3+用量:0、0.5、1.0、1.5、2、3 mL。由于样品较多,溶液燃烧过程可改在箱式炉中进行。箱式炉预热至500 °C,每次可在炉膛中摆放6个坩埚。关上炉门,大约5 min后可观察到溶液在箱式炉中发生爆炸性燃烧反应,伴随有大量气体释放。燃烧过程结束后等待2–3 min,打开炉门,用坩埚钳取出坩埚,在空气中自然冷却,即得系列样品。
(4) 在优化制备条件时,由于实验内容较多,建议分组进行。可采用2人一小组、6人一大组的分组形式。每小组分别测试一个反应条件,三小组完成三个反应条件的测试,最后筛选出最佳制备条件。
8 思考题
(1) 与常规高温固相反应法比较,溶液燃烧法制备碱土金属铝酸盐材料有什么优势?
(2) 长余辉发光材料的构成是什么?可能的长余辉发光机理?
(3) 讨论尿素用量对溶液燃烧反应产生气氛氧化性的影响规律。
9 注意事项
(1) 在制备发光材料时,不同坩埚务必标记,避免混淆;
(2) 由于Fe等过渡金属离子对Eu2+的发光有很强的猝灭作用,在实验过程中,应尽量避免样品与铁质器件直接接触;
(3) 反应物水溶液具有一定腐蚀性,在加热过程中可能出现喷溅,注意防护,操作时必须戴上手套和护目镜;
(4) 溶液燃烧过程可能释放氨气或氮氧化物,实验操作必须在通风橱中进行;
(5) 溶液燃烧火苗的最高温度可达1000 °C以上,故待充分冷却后才能取出样品,以避免烫伤;
(6) 荧光测试粉末样品时使用专用的固体样品支架,在暗室中记录样品的荧光衰减曲线。
10 结语
本实验让学生基本完成了一个从合成、表征到性能测试的科研过程,具有目标明确、过程清晰、现象明显、结果稳定等特点。自2012年以来,本实验作为我校化学、材料各专业大三学生的综合实验项目,备受学生好评。学生对此实验项目表现出了极高的热情,尤其是溶液燃烧过程和长余辉发光现象给学生留下了深刻的印象,并制作了多种实验小视频。在此实验的基础上,还增加了拓展性的研究项目,参与的学生年年都能在本实验项目的基础上取得新的科研创新成果,从而进一步培养学生的科研创新能力。
