研究型分析化学综合实验教学模式探究
——以“海藻酸盐微胶囊的制备、药物包封及缓控释分析实验”为例
2024-03-04胡国梁颜鑫灏陈睿希刘红瑜1姚奇志1李娇1李玲玲1
胡国梁,颜鑫灏,陈睿希,刘红瑜1,,*,姚奇志1,,李娇1,,李玲玲1,
1 化学国家级实验教学示范中心(中国科学技术大学),合肥 230026
2 中国科学技术大学化学与材料科学学院,合肥 230026
中国科学技术大学分析化学实验课程分I型、II型二种类型。I型实验是以基本操作、基本技能和基本方法的验证性实验训练为主,以综合实验、设计实验为辅。II型分析化学实验是以综合型实验为主导的实验模式,是在I型实验的基础上,培养学生的科研能力和创新意识。“海藻酸盐微胶囊的制备、药物包封及缓控释分析实验”是II型分析化学实验中非常典型的一个研究型实验,实验教学中涵盖了微胶囊形成原理探究、实验条件设计、微胶囊性能表征等科研基本能力的训练[1–5]。对于提升学生综合实验能力有非常好的帮助。
微胶囊是利用天然或合成高分子材料,将分散的物质包裹起来,形成具有特定几何结构的微型容器,直径一般为1–1000 μm。由于微胶囊化可以使芯材与外界隔离,保持物理性质(如颜色、溶解性等),提高稳定性,具有物质控释性、释放靶向性、生物相容性及可降解性等特点,该技术的应用已经涵盖化工、食品、药物、生物制品、医学等诸多领域。海藻酸钠由于与其他物质能够形成良好吸附性能的凝胶而广受关注,由于其吸附性,在制备药物微胶囊中也有十分重要的作用。海藻酸钠无毒无害,拥有肠溶性,能将药物送入肠道并吸收,并能起到缓释作用,延长药物作用时间,并将药物浓度控制在一定范围内。可以利用海藻酸盐制备微胶囊,对药物具有较好的缓释效果[6,7]。
1 方法原理
当海藻酸钠遇见二价阳离子或聚阳离子时,会发生离子转移,形成既具有强度性能又具有弹性的凝胶(一种介于固态和液态之间的状态),由此制得海藻酸盐微胶囊。
在静电力作用下,海藻酸钠溶液通过注射剂挤出针尖,在针尖处形成球状液面,液面在注射器推动下增长,依次形成月牙形液面、倒锥形液面和细丝状液柱,在静电作用下崩解形成小液滴,当液柱的重力(Fg)、注射器推动力(Fp)和静电力(Fe)之和大于表面张力时,液柱崩解。海藻酸钠液柱崩解后在自身表面张力作用下变成直径为d的球形,进入含凝胶化盐氯化钙溶液中,生成海藻酸钙凝胶微球。
2 试剂与仪器
2.1 主要试剂
海藻酸钠、壳聚糖、亚甲基蓝(MB)、冰乙酸、氯化钙、盐酸、三羟甲基氨基甲烷(Tris),所有试剂均为分析纯。
2.2 主要仪器
注射器、移液枪、集热式磁力搅拌器(德国IKA)、pHS-3C酸度计(仪电科学仪器股份有限公司)、美谱达P4分光光度计(上海美谱达)。
3 实验步骤
3.1 微胶囊的制备
① 海藻酸钠-Ca2+微胶囊的制备:先采用注射器将一定浓度的海藻酸钠溶液(10 mL)注射到3%(海藻酸钠质量对水体积的百分比)浓度的氯化钙溶液(10 mL)中,搅拌数分钟,使海藻酸钠液滴钙化成球。
② 海藻酸钠-壳聚糖微胶囊的制备:同3.1 ①,但将氯化钙换为1% (壳聚糖质量对水体积的百分比)壳聚糖。
3.2 缓释实验
选择亚甲基蓝模拟小分子药物作为缓释研究对象。具体方法如下:
① 海藻酸钠-Ca2+微胶囊做缓释研究:将0.5 mg·mL−1MB加到10 mL一定浓度的海藻酸钠溶液中,然后注射到一定浓度的氯化钙溶液(10 mL)中,搅拌数分钟,使海藻酸钠液滴钙化成球。过滤,然后测定滤液中MB含量。再将等量的Alg-Ca2+微胶囊放入一定体积的Tris-HCl缓冲溶液中,以后每隔15 min测定MB的含量,做缓释曲线。
② 海藻酸钠-壳聚糖微胶囊做缓释研究:同3.2 ①,但将氯化钙换为1%壳聚糖。同样做缓释实验,做缓释曲线。
4 第一节课实验记录
4.1 海藻酸钠-CaCl2体系
取海藻酸钠溶液和氯化钙溶液各10 mL,制备微胶囊后滤液吸光度:1.354,溶液中亚甲基蓝吸光度随时间的变化数据见表1。

表1 海藻酸钠-CaCl2体系吸光度和时间关系(以0时刻作为参比)
4.2 海藻酸钠-壳聚糖体系
取海藻酸钠溶液和壳聚糖溶液各10 mL,制备微胶囊后滤液吸光度:0.897,溶液中亚甲基蓝吸光度随时间的变化数据见表2。

表2 海藻酸钠-壳聚糖体系吸光度和时间关系(以去离子水作为参比)
5 数据处理和结果分析
5.1 数据处理
海藻酸钠-CaCl2体系,亚甲基蓝吸光度随时间的变化如图1所示。海藻酸钠-壳聚糖体系,吸光度随时间的变化如图2所示。
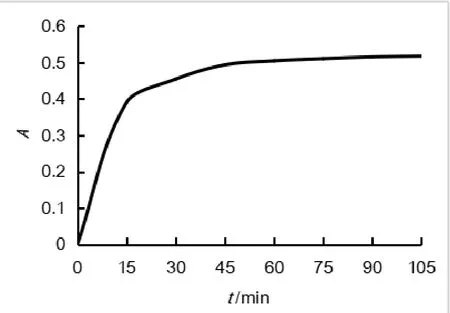
图1 海藻酸钠-CaCl2体系吸光度–时间关系图
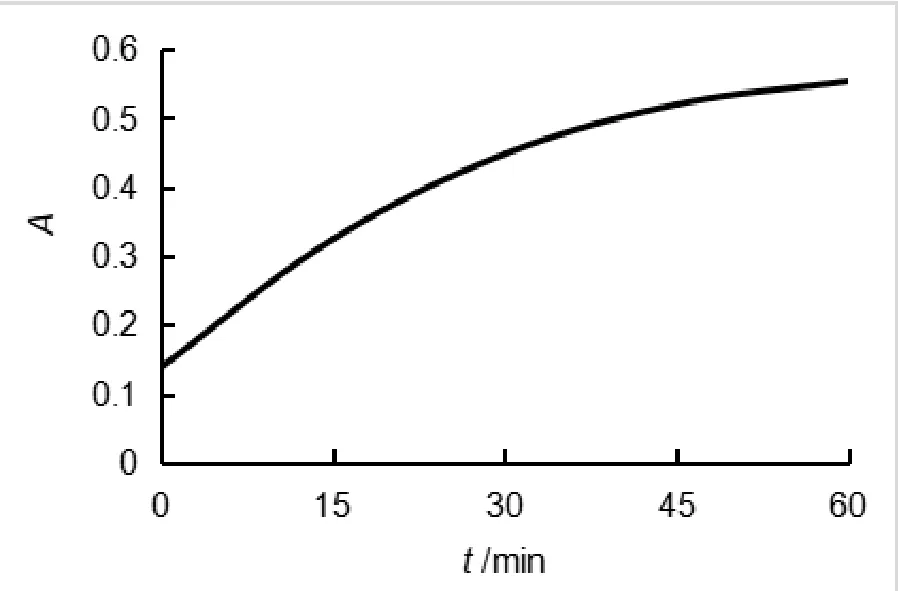
图2 海藻酸钠-壳聚糖体系吸光度–时间关系图
5.2 结果分析与总结
对比两种体系,最终可以得出海藻酸钠-壳聚糖体系的缓释效果更好。海藻酸钙-CaCl2体系在开始时释放速度较快,在1 h左右时释放较为完全;而海藻酸钠-壳聚糖体系释放速度较慢,对药物有很好的缓释效果。
但CaCl2体系制备出的微胶囊结构性能较好,易过滤,且不发生破裂,胶囊稳定性较强。而壳聚糖体系制备出的微胶囊较软,易破损。
对两种体系的包埋率进行对比,由于海藻酸钠-壳聚糖体系的滤液吸光度较小,故其包埋率较高,对药物的包埋效果更好。
6 第二节课研究型实验设计及实施
6.1 实验思路
考虑到两种不同体系制备出的微胶囊各有优点,因此,综合性实验考虑进行多元体系的制备,以制备出缓释性能和稳定性能均良好的微胶囊。
经过查阅文献,最终决定以一步法和两步法对微胶囊进行制备[6],并对两个方法所制备出来的微胶囊进行对比,得出优缺点。同时,文献中提到采用葡萄糖作为增塑剂可以提高微胶囊稳定性[2],其效果可能与CaCl2所起到的作用相似,在此进行验证。
6.2 实验方案
6.2.1 一步法制备微胶囊
配制壳聚糖-CaCl2混合溶液,将0.5 mg·mL−1MB加到10 mL一定浓度的海藻酸钠溶液中,然后注射到一定浓度的混合溶液(15 mL)中,搅拌数分钟,使海藻酸钠液滴钙化成球。过滤,然后测定滤液中MB含量。再将等量的微胶囊放入一定体积的Tris-HCl缓冲溶液中,以后每隔15 min测定MB的含量,做缓释曲线。
6.2.2 两步法制备微胶囊
将0.5 mg·mL−1MB加到10 mL一定浓度的海藻酸钠溶液中,然后注射到一定浓度的CaCl2溶液(15 mL)中,搅拌数分钟,使海藻酸钠液滴钙化成球。过滤,然后测定滤液中MB含量。再将等量的海藻酸钠-Ca2+微胶囊放入一定浓度的壳聚糖溶液(15 mL)中,搅拌数分钟,过滤。将等量的微胶囊放入一定体积的Tris-HCl缓冲溶液中,以后每隔15 min测定MB的含量,做缓释曲线。对比组则先放入壳聚糖溶液中,再放入氯化钙溶液中,其余步骤均相同。
6.2.3 探究葡萄糖对海藻酸钠-壳聚糖体系微胶囊制备的影响
将0.5 mg·mL−1MB加到10 mL一定浓度的海藻酸钠溶液中,然后注射到一定浓度的壳聚糖溶液(15 mL)中,搅拌数分钟,使海藻酸钠液滴成球。过滤,然后测定滤液中MB含量。再将等量的微胶囊放入6%葡萄糖溶液(15 mL)中,搅拌数分钟,过滤。将等量的微胶囊放入一定体积的Tris-HCl缓冲溶液中,以后每隔15 min测定MB的含量,做缓释曲线。
6.3 实验结果和分析
6.3.1 一步法制备微胶囊
制备微胶囊后滤液吸光度:1.047,溶液体积:13.0 mL。
此时包埋率:
由于理论上该体系药物释放符合零级动力学,故用单位时间释放的药物量作为释放效率,在这里用吸光度代替药物量。
释放效率:
吸光度与时间关系见表3,图像见图3,图4为一步法制得的微胶囊的照片。

图3 一步法体系吸光度-时间关系图
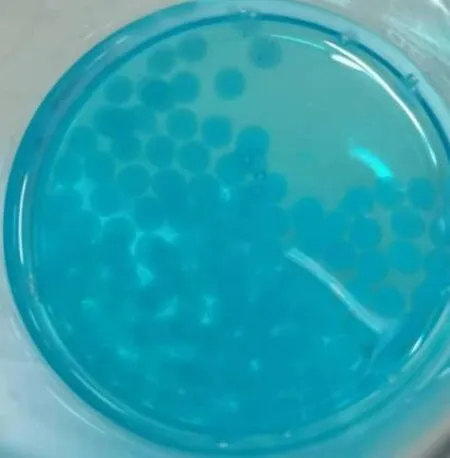
图4 一步法体系微胶囊形貌图

表3 一步法制备微胶囊体系吸光度和时间关系(以去离子水作为参比)
结果分析:计算得到的包埋率较高,包埋效果良好。从图4可以看出,微胶囊的形貌较好,稳定性较高,且易分离。与海藻酸钠-CaCl2二元体系相比,缓释效果明显提高;与海藻酸钠-壳聚糖二元体系相比,微胶囊的稳定性增强。即一步法将两种体系的优点结合起来,所制备出来的微胶囊稳定性和缓释性均良好,具有很高的应用价值。
6.3.2 两步法制备微胶囊
1) 先加入至CaCl2溶液,后加入至壳聚糖溶液。
制备微胶囊后滤液吸光度及溶液体积分别为:0.585、8 mL;0.764、10 mL。
包埋率:
释放效率
吸光度与时间关系见表4,图像见图5,图6为该方法制得的微胶囊的照片。
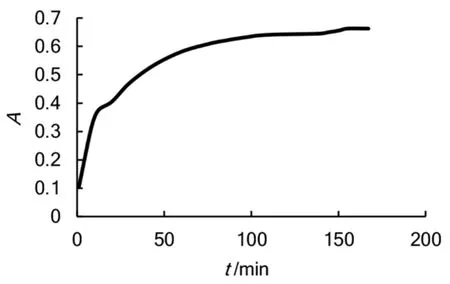
图5 两步法体系(先加至CaCl2溶液后加至壳聚糖溶液)吸光度–时间关系图
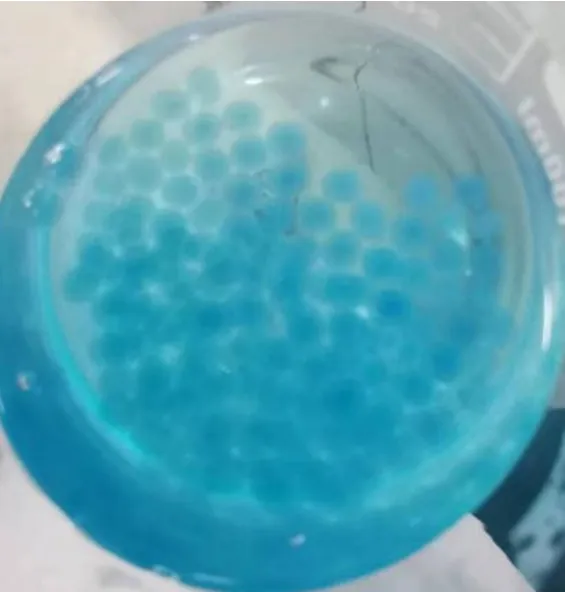
图6 两步法体系(先加至CaCl2溶液后加至壳聚糖溶液)微胶囊形貌图
表4 两步法制备微胶囊体系(先加至CaCl2溶液后加至壳聚糖溶液)吸光度和时间关系(以去离子水作为参比)
2) 先加入至壳聚糖溶液,后加入至CaCl2溶液。
吸光度与时间关系见表5,图像见图7,图8为该方法制得的微胶囊的照片。
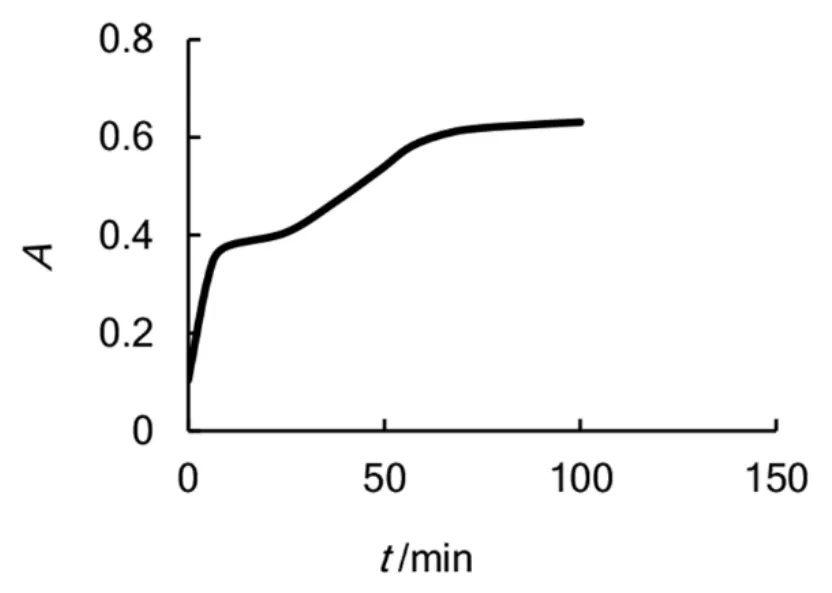
图7 两步法体系(先加至壳聚糖溶液后加至CaCl2溶液)吸光度–时间关系图
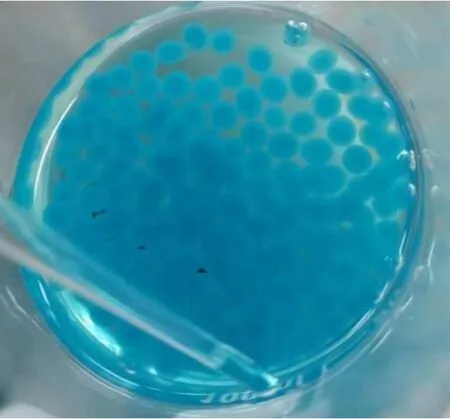
图8 两步法体系(先加至壳聚糖溶液后加至CaCl2溶液)微胶囊形貌图

表5 两步法制备微胶囊体系(先加至壳聚糖溶液后加至CaCl2溶液)吸光度和时间关系(以去离子水作为参比)
结果分析:对比两步法制备的两种微胶囊,可得出溶液的顺序会对微胶囊的缓释性能产生较大的影响。两种顺序制备的微胶囊稳定性均较强,但缓释性有所区别,按照CaCl2-壳聚糖顺序制备出来的微胶囊缓释性较好,在接近100 min时缓释曲线才趋于平缓。可能是由于CaCl2-壳聚糖体系中海藻酸钠液滴先钙化成球,壳聚糖包裹在求外,起到很好的缓释效果。
6.3.3 探究葡萄糖对海藻酸钠-壳聚糖体系微胶囊制备的影响
本部分最初是打算采用两步法制备微胶囊,但最后制备出来的微胶囊放入缓冲溶液中,溶液中出现葡萄糖晶体,对溶液吸光度测量产生较大影响(图9)。

图9 两步法制备后溶液浑浊图像
故采用一步法直接进行制备,一步法最后缓释时溶液澄清,可以对吸光度进行测量,结果如下。
制备微胶囊后滤液吸光度:0.546,溶液体积:11.5 mL。
此时包埋率:
释放效率
吸光度与时间关系见表6,图像见图10。图11为该方法制得的微胶囊的照片。

图10 海藻酸钠-壳聚糖-葡萄糖体系吸光度-时间关系图

图11 海藻酸钠-壳聚糖-葡萄糖体系微胶囊形貌图

表6 海藻酸钠-壳聚糖体系-葡萄糖体系吸光度和时间关系(以去离子水作为参比)
结果分析:加入葡萄糖后制得的微胶囊颜色为深蓝色,与其余方法制备的微胶囊不同,这应该是葡萄糖的影响。在制备过程中,注意到该微胶囊与不加葡萄糖制得的壳聚糖微胶囊相比,外部覆盖了一层白色的膜,它有效地遏制了微胶囊的粘连。但最终得到的微胶囊为椭球形,形貌不好。注意到该体系的包埋率较高,远高于其他体系,这说明加入葡萄糖可有效提高包埋效果;而缓释效果与采用CaCl2一步法相比较差。两种体系各有优点,但考虑到微胶囊的形貌及稳定性,使用CaCl2溶液更好,制备得到的微胶囊更稳定。
7 实验总结
(1) 本次实验先对二元体系的微胶囊进行制备,发现海藻酸钠-CaCl2体系制得的微胶囊稳定性较强,缓释效果较差;海藻酸钠-壳聚糖体系则相反。因此,在综合实验中,对多元体系进行探究,采用一步法和两步法分别对微胶囊进行制备,同时还探究葡萄糖对海藻酸钠-壳聚糖体系微胶囊制备的影响。经过对比,两步法中按照CaCl2-壳聚糖顺序制备得到的微胶囊性能最佳。一步法中将CaCl2换为葡萄糖后,包埋效果大大提高,但微胶囊的形貌结构以及缓释效果并没有太大改变。
(2) 对比三类微胶囊的释放效果,发现两步法制备出来的氯化钙-壳聚糖微胶囊释放速度最慢,葡萄糖-壳聚糖微胶囊释放速度最快,一步法居中,这与缓释效果一致。可以考虑通过调控溶液的pH,以及在合成前对各组分含量进行调整,从而达到调控胶囊壁层厚度及孔隙大小来实现对释放速度和释放量的调控,得到效果最佳的微胶囊。
(3) 海藻酸钠中有非常多羟基基团,能够通过络合作用与钙离子进行络合。在络合后,海藻酸钠由于电荷斥力会迅速分离。而通过多条海藻酸钠链与多个钙离子络合,能够形成交联网状结构的微球。而空隙则能够吸附药物分子。由于为固体颗粒,海藻酸钙微球的机械强度较高,能够形成尺寸均匀、弹性强的微珠,但由于其表面有许多空隙,缓释效果较差,且对药物的包埋率较低。
(4) 壳聚糖中含有许多胺基。在酸性条件下,胺基会与氢离子结合而带有正电荷。而海藻酸有很多羟基。其中海藻酸钠中氧原子带负电荷。因此海藻酸钠能够与壳聚糖通过静电作用进行结合。而两者带电荷强弱都与pH有关,壳聚糖的溶解也与酸度有关,因此pH对微胶囊的制备十分重要。由于是静电作用结合,因此壳聚糖与海藻酸钠形成的凝胶机械强度较低,很容易粘连。但具有非常好的缓释效果。
(5) 结合二者的优点,在含药物分子的海藻酸钠与氯化钙溶液混合时,会先形成具有交联网状结构的海藻酸钙微球。将海藻酸钙微球放入壳聚糖溶液后,由于海藻酸钙微球表面会有海藻酸钠伸出的羟基,能够使壳聚糖在海藻酸钙表面通过静电作用形成一层膜,从而得到微胶囊。这样得到的微胶囊不仅机械强度高,不易粘连,而且缓释效果也大大提高了。
8 结语
该研究型实验利用两节实验课完成(共16学时),第一节课主要是通过实验设计选择最佳的微胶囊制备实验条件,为第二节课继续开展探究奠定基础;第二节课学生首先汇报第一节课探究的实验结果并进行分组讨论,之后基于第一节课中发现的问题,进一步拓展实验设计,提升微胶囊的缓释性能。这种研究型教学方式让学生完成了一次小型的科研体验,既锻炼了学生的沟通交流能力,又拓展了学生的实验设计思路,还提升了学生的课堂参与积极性,充分增强了课堂教学效果。
