肟的立体选择性合成概述
2024-03-04张圳杨凯宋秋玲
张圳,杨凯,宋秋玲
福州大学化学学院,福州 350108
Beckmann重排反应是基础有机化学中的一大重点,其在现代有机合成中有着非常重要的地位,最重要用途就是方便地用酮来制备酰胺[1]。该反应由德国化学家E. O. Beckmann于1886年首次报道,工业上广泛利用环己酮肟发生Beckmann重排反应来大量生产己内酰胺[2]。机理研究表明,Beckmann重排反应具有立体选择性(图1),其特点有:(1) 离去基团与迁移基团处于反式位置;(2) 基团的离去与基团的迁移是同步的;(3) 迁移基团在迁移前后构型不变。
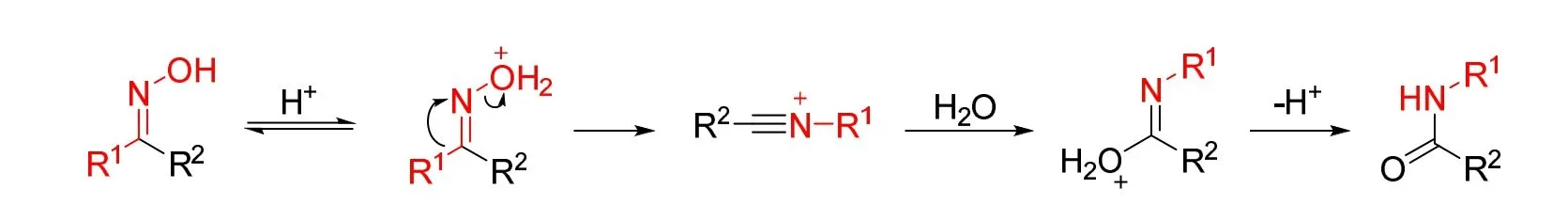
图1 Beckmann重排反应机理
目前国内有机化学教材关于肟相关的内容只有醛或酮与羟胺的缩合产生肟以及Beckmann重排,鲜有提及其肟的立体化学[3]。笔者认为如果能将肟的立体化学内容引入到有机化学的立体化学章节或者醛、酮章节的教学中,既能拓展学生的视野,也有助于激发学生发现和解决难题的兴趣。
1 肟
肟是一类非常重要的有机化合物,其通式结构是(R1R2)C=NOH,当R2为氢原子的肟为醛肟,当R2为其他有机侧链的肟称为酮肟[4]。从结构上来看,肟有Z/E两种异构体,大多数情况下醛肟主要以E构型异构体存在,而酮肟以Z/E两种异构体混合形式存在。立体化学纯的肟在合成、药物、食品添加剂等领域有着非常重要的应用。肟是Beckmann重排反应[5]的起始原料,受立体选择性的影响,非立体化学纯的肟进行Beckmann重排反应无疑会导致两种难分离的酰胺(图2a)。此外,肟在涉及金属的反应中也有重要的用途,比如肟可以作为碳氢官能团化反应中的导向基团,如Beckmann重排反应一样,该类反应也具有立体选择性(图2b)。肟还广泛存在于药物、生物活性分子以及食品添加剂中(图2c)[6,7]。生物活性评价试验表明,肟的Z/E两种构型的生物活性不一样[8]。因此,发展立体选择性合成立体化学纯肟的方法具有重要的意义。
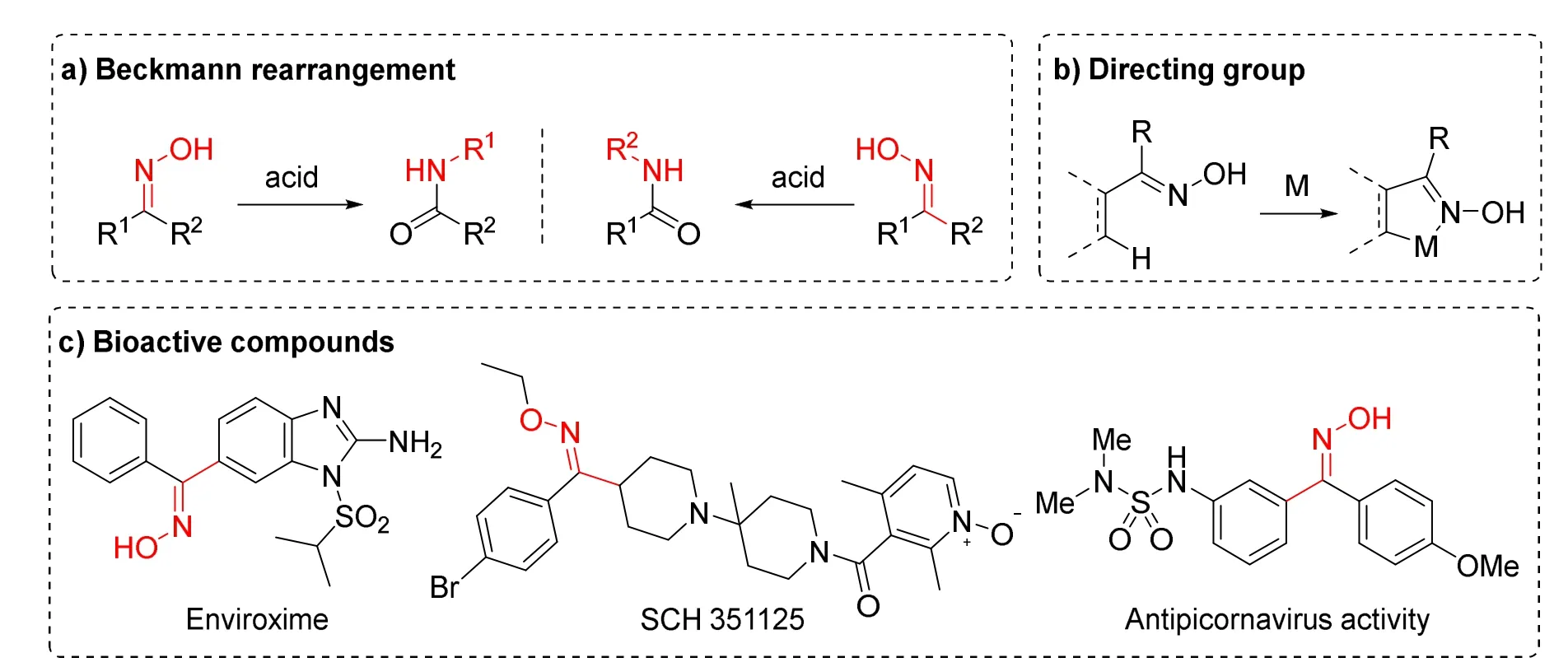
图2 立体化学纯肟的应用
2 肟的合成进展
2.1 肟的传统合成
肟的合成可以追溯到19世纪,其传统合成方法是醛或酮与羟胺的脱水缩合,或者是亚硝基化合物的互变异构[3]。这两种方法合成的通常是Z/E两种异构体混合的肟,其比例取决于底物两边取代基的空间位阻,如果两边取代基越接近,Z/E两种异构体约接近于1 : 1,通常存在分离纯化问题,难以获得单一的异构体(图3),因此,立体化学纯的酮肟,尤其是热力学上不稳定的酮肟的直接立体选择性合成,在现代合成化学上仍然是一个挑战。在工业应用、药物化学、金属有机等领域的应用中一般需要立体化学纯的肟,发展从简单原料出发经过简单方法直接立体选择性合成酮肟具有非常重要的意义,是当前迫切解决的问题。

图3 肟的传统合成方法
2.2 肟的立体选择性合成
1974年,Kaiser课题组从α-溴代苯乙酮肟出发实现了立体选择性地合成E构型芳基烷基酮肟[9]。该方法的过程可能是α-溴代苯乙酮肟先缓慢消除一分子溴化氢形成α-亚硝基苯乙烯中间体,然后接受亲核试剂进攻,最后形成E构型芳基烷基酮肟。当亲核试剂为氢负离子(NaBH4)时,能高选择性地合成Z构型苯乙酮肟(图4)。
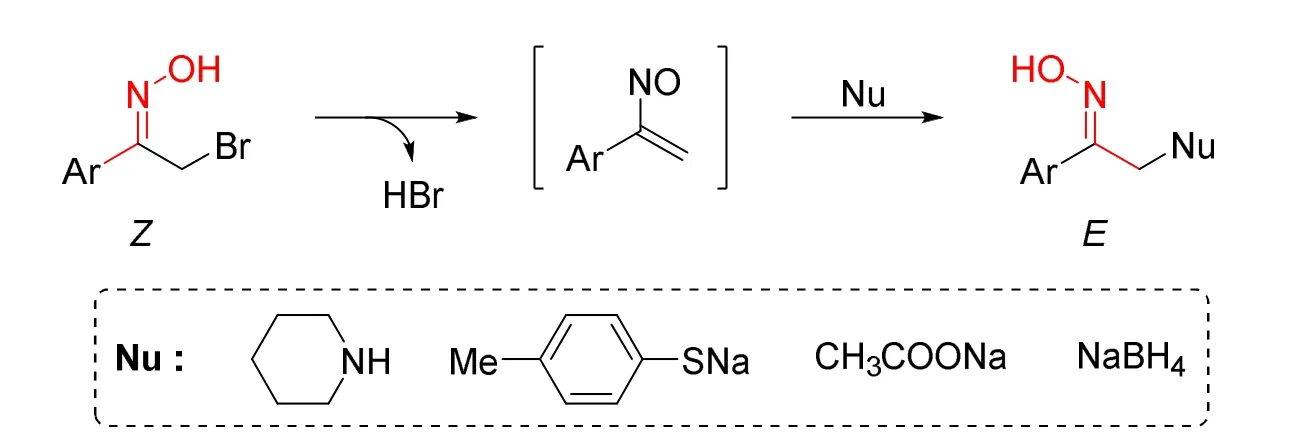
图4 经α-亚硝基苯乙烯中间体立体选择性合成酮肟
2013年,Dolliver课题组报道了钯催化立体专一性交叉偶联的方法合成立体化学纯的酮肟醚[10]。研究者首先从芳香羧酸出发经三步反应合成立体化学纯的Z-芳基碘肟醚,然后经钯催化的Suzuki和Sonogashira偶联反应合成了一系列立体化学纯的二芳基酮肟醚、芳基烯基酮肟醚以及芳基炔基酮肟醚(图5)。值得一提的是,Z-芳基碘肟醚在进行交叉偶联反应过程中构型保持不变,具有立体专一性。与多数Suzuki反应相同,芳基硼酸的取代基为给电子基团时产率明显较高,而缺电子或大位阻取代基不利于该反应的进行。
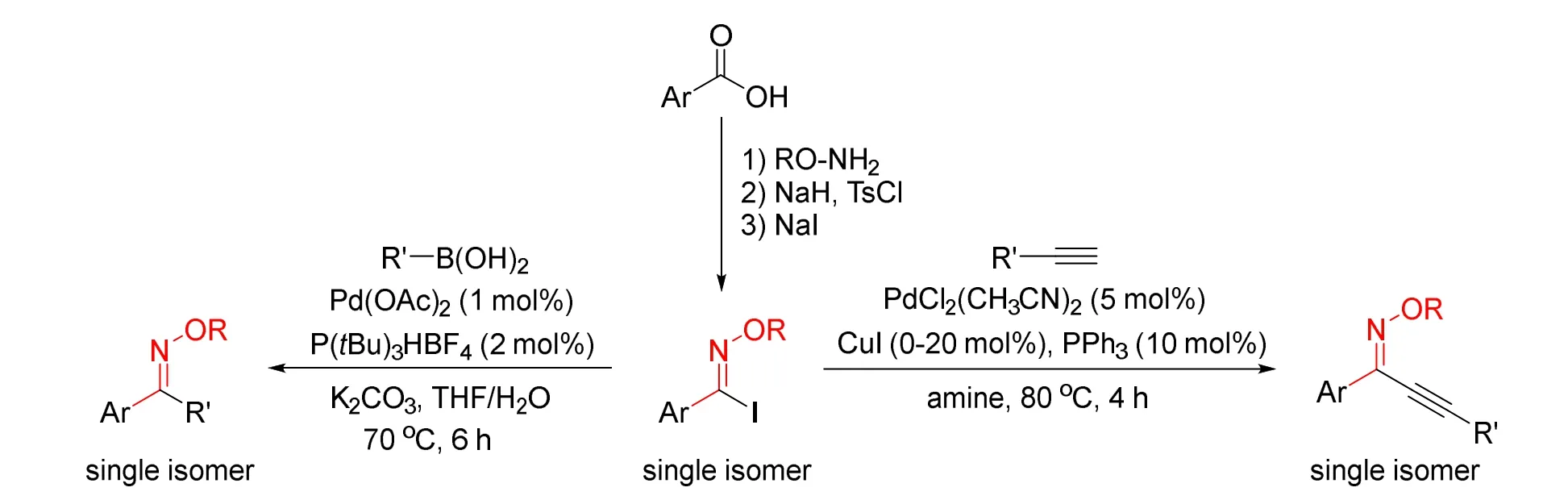
图5 立体专一性交叉偶联反应合成酮肟醚
2019年,宋秋玲课题组发展了立体专一性的1,4-迁移反应策略立体汇聚合成立体化学纯的酮肟,以简单易得的肟氯和芳基硼酸为原料,经该策略可以高效构建立体化学纯的二芳基酮肟、烯基芳基酮肟以及Z-构型芳基烷基酮肟(图6)[11]。在温和的条件下该策略表现出了优秀的立体选择性以及广泛的底物范围。该方法使用的氯代肟原料容易制备,也无需考虑氯代肟的构型,无论是E、Z构型,还是E/Z混合物都能立体选择性得到目标产物。通过与经典缩合反应的对比,通过该策略可以得到两种立体化学纯的二芳基酮肟以及缩合方法难以得到的Z构型芳基烷基酮肟。该策略为化学与制药领域所需的立体化学纯酮肟提供了最为直接的合成方法,将有可能推动肟化学的进一步发展。此外研究者还开发了立体化学纯二芳基酮肟和Z-构型芳基烷基酮肟的碳氢官能团化反应和Beckmann重排反应,在这些反应过程中没有发生构型异构化的现象。不足的是,该反应仅适用于芳基硼酸,无法构建二烷基酮肟。
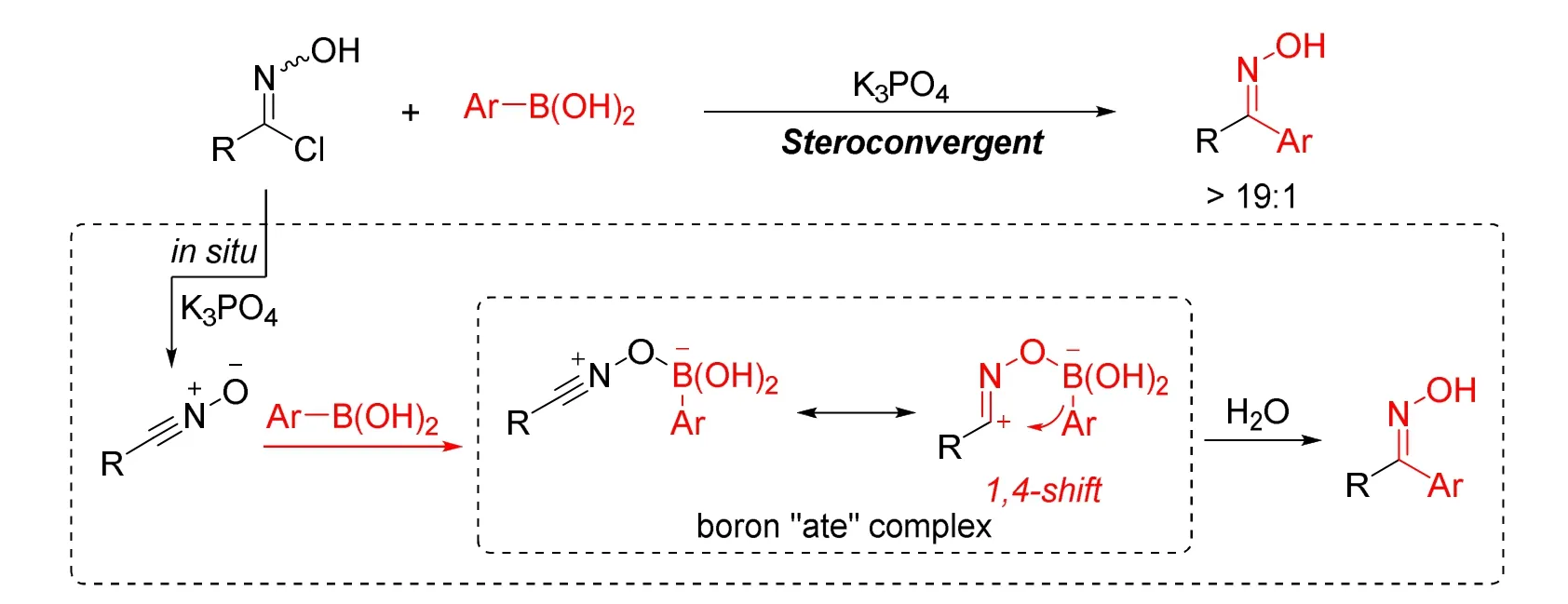
图6 立体汇聚策略合成立体化学纯的酮肟
2.3 通过光介导策略实现肟的合成及构型转化
通过光介导的能量转移策略合成传统方法难以合成的芳基烷基酮肟(醚)备受关注。1972年,Padwa和Albrecht报道了苯乙酮肟醚在254 nm紫外光照射下实现了E构型向Z构型的转化[12]。2021年,刘强课题组报道了光催化的烯烃双官能团化反应合成α-氨基酮肟化合物,该方法以N-甲基-N-亚硝基-对甲基苯磺酰胺为自由基双官能团试剂,通过调控光催化剂的类型可以高立体选择性得到Z和E两种立体化学纯的α-氨基酮肟化合物(图7)[13]。
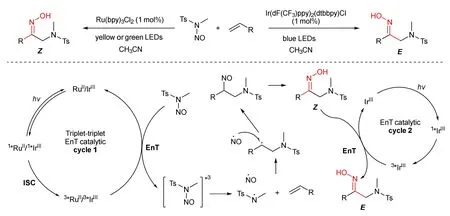
图7 可见光介导的能量转移策略合成立体化学纯酮肟
机理研究表明,RuII或IrIII催化剂在可见光照射下形成激发态,接着经历隙间穿越(ISC)转变为三线态激发态,然后与N-甲基-N-亚硝基对甲苯磺酰胺(NANSs)进行能量转移后形成磺酰胺氮自由基和一氧化氮自由基。瞬态的磺酰胺氮自由基被烯烃捕获以产生碳中心的自由基,接着与一氧化氮自由基偶联,随后发生互变异构生成Z构型α-氨基酮肟。更高能量的三线态激发态的Ir(III)*3与Z构型α-氨基酮肟经能量转移能高选择性地形成E构型α-氨基酮肟。
不久后,Rovis课题组也报道了可见光介导的能量转移催化E构型芳基烷基酮肟的光异构化来合成Z构型的芳基烷基酮肟(图8)[14]。研究者认为该反应的过程可能是光催化剂对E构型肟进行三线态敏化促进电子从C=N的π轨道到π*轨道,生成允许围绕C―Nσ键轴旋转的双自由基中间体进而转化成Z构型肟。在产物Z构型肟中,由于空间位阻的影响使得C―N键的π轨道几乎垂直于苯环的π轨道,导致两个π体系的共轭减少,从而使分子更难激发。此外,还通过光异构化与Beckmann重排反应一锅法合成了一系列传统Beckmann重排反应难以得到的苯甲酰胺类衍生物。

图8 光异构化策略实现肟的构型转化
光异构化策略在肟的合成中具有良好的立体选择性。然而,就目前而言,特别是受体系光照的不均及自由基反应放大时副反应加剧的影响,该类反应无法大规模进行。随着诸如连续流合成[15]等新型技术的发展,相信未来将有望克服系列困难,在生产过程中展示出光催化反应的优势。
3 结语
本文介绍了合成立体化学纯肟的研究进展,包括亲核试剂进攻α-亚硝基苯乙烯中间体、交叉偶联反应以及可见光介导等策略。但这些策略在底物适用范围还存在不足,例如二烷基酮肟的立体选择性合成仍然是一大挑战。此外,在现有的合成方法之上发展立体化学肟的应用也具有重要的意义。鉴于立体化学纯肟的良好应用前景,希望本文能为相关教学科研工作者提供一定的依据和参考。
