第55届国际化学奥林匹克试题(实验部分)
2024-03-04郭玉鹏张丽荣张明涛王颖霞裴坚
郭玉鹏,张丽荣,张明涛,王颖霞,裴坚
1吉林大学化学学院,长春 130012
2 南开大学化学学院,天津 300071
3 北京大学化学与分子工程学院,北京 100871
实验1:漂白剂——一种能改变物质颜色的试剂
实验步骤
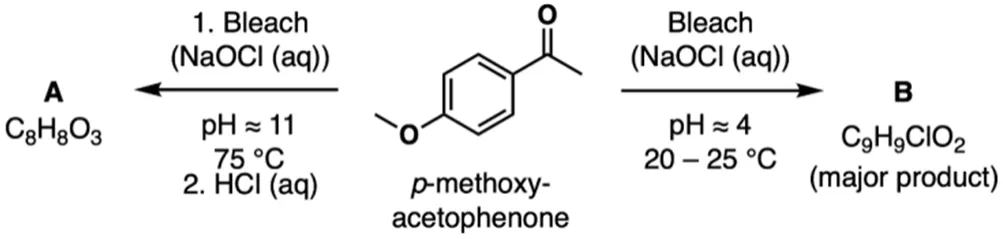
Bleach:漂白剂;p-methoxyacetophenone:对甲氧基苯乙酮;major product:主产物
产物A的制备
1. 打开磁力搅拌器开始加热。为了将水浴温度加热到70–80 °C,需要将控制旋钮设置在100 °C和150 °C之间。搅拌水浴。可以将温度计夹在支架上,监控水浴温度。
2. 在水浴加热的同时,用小镍勺从标记为“SM-A”的小样品瓶中取少量对甲氧基苯乙酮,将其加入到标记为“TLC-SM”的小样品瓶中,放置在一边,以供后续进行薄层色谱(TLC)分析使用(待稍后进行)。
3. 在50 mL圆底烧瓶中,加入橄榄形磁子,500 mg对甲氧基苯乙酮(瓶身标记为“SM-A”的样品瓶中的所有量,可以利用称重纸进行转移),6.7 mL NaOH水溶液(标记为“NaOH(aq)”的样品瓶中所有量),7.5 mL漂白剂(标记为“Bleach-A”样品瓶中的所有量)。
4. 将圆底烧瓶夹在铁架台上,调整铁夹的位置,将烧瓶放入水浴中。确保反应混合液快速搅拌(约750 rpm,即转数约为750转/分钟)。
5. 如图1所示,将分馏柱(Vigreux column)连接到烧瓶上。在分馏柱上端,连接带有塑料软管连接头,该连接头通过塑料软管连接到尾气吸收瓶(瓶中装有NaOH的EtOH/H2O溶液)。用黄色塑料夹固定连接部分。

图1 反应装置示意图
6. 反应在70–80 °C下进行60分钟。
7. 关闭加热开关,调整铁夹的位置,将烧瓶抬高到水浴上方,小心移除水浴(可请监考老师帮助),在搅拌下让反应液冷却,以进行下一步反应。
8. 拆卸与分馏柱连接的带内磨砂玻璃连接头,断开排气管。取下分馏柱(在制备产物B时会继续使用分馏柱)。
9. 向监考老师索要碎冰,并在冰水浴中冷却反应烧瓶,同时继续搅拌约5分钟。
10. 将烧瓶仍放在冰水浴中,用滴管从标有“NaHSO3(aq)”的样品瓶中吸取NaHSO3水溶液(40%),缓慢加入到烧瓶的反应液中,一共需要加入约5 mL;1/2滴管的溶液相当于1 mL (如图2所示)。继续搅拌反应液,稍后会产生白色沉淀(产物A)。
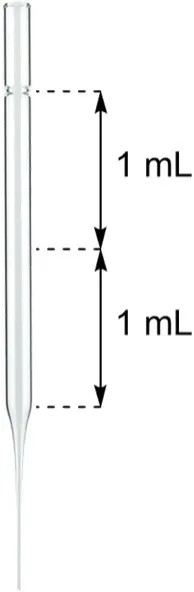
图2 带体积刻度的滴管示意图
11. 用滴管从标记为“2 M HCl(aq)”的螺旋盖玻璃瓶中吸取HCl水溶液约6–8 mL,加入反应液中,将反应液的pH调至1–2。随时可以用pH指示条(参考图3彩色图案)检测反应液的pH。常规的做法为,用干净的滴管从反应瓶中取少量反应液,在pH指示条上滴一滴,不要将指示条直接浸入反应液中。继续加入HCl,直到pH约为1–2,然后停止加入HCl。
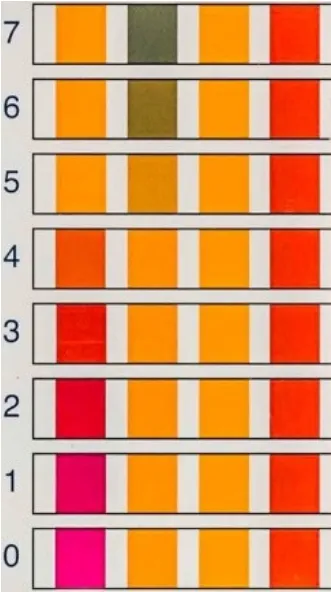
图3 通过与pH试纸条上的色标区进行目视比较来确定pH值
12. 向监考老师索要磁棒。关掉电磁搅拌器,用磁棒从烧瓶中取出磁子。先用水(洗磁子的水必须放入“含水废液”)清洗磁子,然后用丙酮(洗磁子的丙酮必须放入“有机废液”)清洗,然后用纸巾擦干磁子。磁子将在后续反应中继续使用。
13. 安装真空抽滤装置:如图4所示,在铁架台上用铁夹锁紧抽滤瓶,确保锥形橡胶垫圈位于橡胶保护圈上。

图4 抽滤装置示意图
14. 将玻璃砂芯漏斗放在锥形橡胶垫圈上。一定要确保固定抽紧。
15. 抽真空,将待过滤固体的悬浮液倒入玻璃砂芯漏斗中。根据反应液的量,可以分批倒入玻璃砂芯漏斗中。
16. 每次用10 mL水彻底洗涤固体,一共2次(可用量筒量取水)。
17. 将大部分水分抽走,尽可能使滤渣干燥(但不要超过10分钟),然后断开真空体系,并关闭真空。
18. 用小镍勺取少量产物A,放入在标记为“TLC-A”的样品瓶中,以备后续薄层色谱(TLC)分析用(待稍后进行)。
19. 用镍勺将产物从磨砂玻璃漏斗中转移入标有“产物A + [参赛号]”的样品瓶中。
20. 将标有“产物A + [参赛号]”的样品瓶盖子盖上。所有实验结束后,将其交给监考老师。
21. 将抽滤瓶中的滤液倒入“含水废物”瓶中。
产物B的制备
1. 取一个未用过的50 mL圆底烧瓶,加入一个橄榄形磁子,将烧瓶用铁夹固定在铁架台上。
2. 在烧瓶中加入500 mg对甲氧基苯乙酮(p-methoxyacetophenone,“SM-B”瓶的全部量,可以利用称量纸进行转移)和4 mL冰醋酸(“AcOH”瓶的全部量)。
3. 一边搅拌,一边用滴管将4.0 mL漂白剂(“Bleach-B”样品瓶的全部量)慢慢滴加入烧瓶中,大约需要1–2分钟。
4. 将分馏柱连接到烧瓶上。
5. 将电磁搅拌转速控制在750转/分钟,在室温下快速搅拌,反应45分钟。
6. 取下分馏柱,用滴管将约3 mL亚硫酸氢钠水溶液(40%) (装NaHSO3(aq)小样品瓶的剩余量)慢慢滴加入反应液中,约需1分钟。在滴加过程中,反应液会变热。
7. 向监考老师索要磁棒。关掉电磁搅拌器,用磁棒从烧瓶中取出磁子。
8. 用铁夹将一个50毫升的分液漏斗固定在铁架台上。加入10 mL水(可用量筒量取)。
9. 利用玻璃漏斗将反应液从圆底烧瓶倒入分离漏斗中。
10. 加入约10 mL甲苯(可用量筒从标有“Toluene”的螺旋盖瓶中量取),然后取下分液漏斗。
11. 用塞子塞紧分液漏斗,并用力摇晃一会儿。停止摇晃时,及时排气,可以重复几次。确保分液漏斗的口远离自己和他人。
12. 停止摇晃,再次放气,然后将其夹在铁架台上。把塞子取下,然后放置分层。
13. 将下面的(水)层排到反应所用的圆底烧瓶中。将含有产物B的上层(有机层)倒入50 mL的锥形瓶中。
14. 重复步骤9至步骤13两遍,用甲苯再萃取水相两次。将所有的有机萃取液收集在同一个锥形瓶中。
15. 用丙酮润洗玻璃漏斗(用过的丙酮倒入标有“有机废液(Organic Waste)”的瓶中),放置,使其干燥。
16. 将硫酸钠(标着“Na2SO4”样品瓶的全部量)加入锥形瓶中,干燥有机萃取液。加入棒状磁子,在电磁搅拌器上搅拌有机萃取液,约3分钟,然后关闭搅拌器。
17. 将玻璃漏斗放在铁架台的铁夹上,将漏斗嘴放入标有“产物B + [参赛号]”的容量瓶中。将一张滤纸放入玻璃漏斗中,用滴管取少量甲苯浸湿滤纸。
18. 将锥形瓶中的有机萃取液过滤到“产物B + [参赛号]”的容量烧瓶中(溶液未达到标记线)。用同一根滴管,用约5 mL甲苯冲洗锥形瓶,并将这些溶液一起倒入玻璃漏斗中。
19. 用滴管将4滴“产物B”溶液转移到标有“TLC-B”的样品瓶中。
20. 将容量瓶的塞子盖上。待所有实验结束后,将其交给监考老师。
21. 将以上过程中产生的所有废水倒入标有“水溶性废液(Aqueous Waste)”的瓶子中。
薄层色谱(TLC)分析
1. 准备展开瓶:将展开液(比例为80 : 20的正己烷/乙酸乙酯混合物,盛在标有“Eluent”的旋盖瓶中)倒入瓶中,展开液的高度约为0.5 cm,并盖上盖子。如果有必要,你可以向监考老师索要更多的展开液,且不会被罚分。
2. 准备你的样品:用滴管分别向标有“TLC-SM”“TLC-A”和“TLC-B”的样品瓶中加入约0.5 mL展开液,溶解或稀释样品。盖上标有“TLC-A”样品瓶的瓶盖摇晃约半分钟以加快溶解。
3. 准备一个用于分析产物A的TLC板(固定相:涂在铝箔上的SiO2) (如图5左所示):用铅笔和尺子,在TLC板上约1厘米处轻轻画上起始线,并标记3个点的位置,分别写上为“SM”(原料,对甲氧基苯乙酮)、“A”(产物A),“SM + A”(SM和产物A的混合物的共点,将两种溶液用毛细管点在同一个位置处)。在TLC板的左上角,写下你的参赛号。
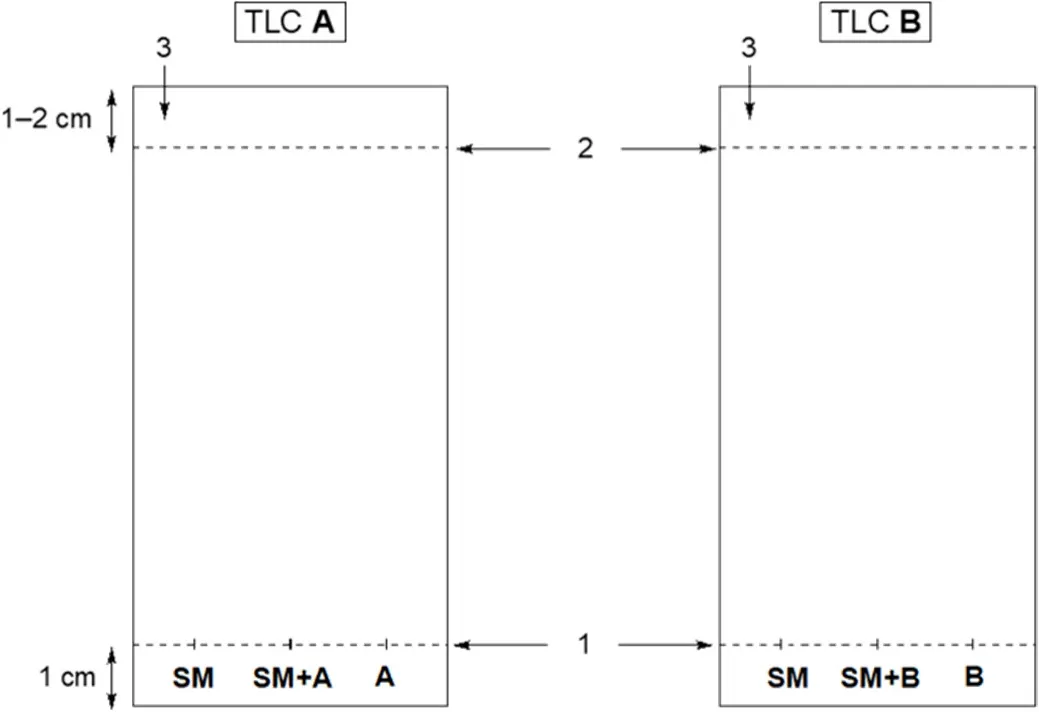
图5 TLC分析示意图
4. 用同样方法准备另一个TLC板,用于分析产物B (如图5右所示)。
5. 根据刚刚完成的标记,使用毛细管在起始线上对两个TLC板进行滴加分析样品的溶液(图5)。每个样品均需使用不同的毛细管。等待溶剂挥发,样品点变干。
6. 展开TLC板(可同时进行,或者依次进行:一块TLC板完成后,再展开另一块板):用镊子将TLC板放入展开瓶中,并盖上盖子。让展开液到达TLC板顶部下方1–2 cm处。打开盖子,用镊子将TLC板从瓶子中取出。用铅笔轻轻在展开液的前沿处划线,然后让TLC板自然风干。
7. 将干燥后的TLC板放在公用实验台上,在紫外灯下观察。用铅笔轻轻圈出所有可见的样品点。
8. 在图5所示的模板上,将TLC板在紫外灯下观察到的样品点照样画出,并按照这些结果回答答题纸中与TLC相关的问题。
9. 小心地将干燥的薄层色谱板放入标有你的参赛号的塑料自封袋中。避免TLC板互相划伤。
10. 准备好以下物品,待监考老师收取:
• 装有你产物的玻璃样品瓶和容量瓶。这些瓶子上标有你的参赛号和相应产物的名称(“产物A + [参赛号]”和“产物B + [参赛号]”)。
• 一个标有你的参赛号的塑料自封袋,里面有两块TLC板(产物A和B的TLC板)。
回答问题
Bleach:漂白剂;p-methoxyacetophenone:对甲氧基苯乙酮;major product:主产物
回答以下问题,勾选正确选项的答案框(每个问题只有一个正确答案;模棱两可的答案将被视为不正确)
1.1 根据上述的TLC板分析结果回答以下问题a–d (固定相:涂在铝箔上的SiO2;展开液:比例为80 :20的正己烷/乙酸乙酯)。如果TLC板的结果没有画在答题纸上,将不给分。
a. 比较产物A和B,哪个极性更强?勾选正确的答案。
□ 产物A (Product A)
□ 产物B (Product A)
b. 比较产物A和起始原料SM,哪个极性更强?勾选正确的答案。
□ 产物A (Product A)
□ 起始原料(Starting Material)
c. 你的产物A中是否还有剩余的起始原料?勾选正确的答案。
□ 是(Yes)
□ 否(No)
d. 你的产物B中是否还有剩余的起始原料?勾选正确的答案。
□ 是(Yes)
□ 否(No)
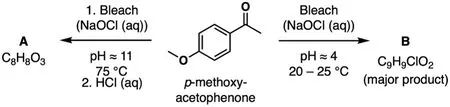
1.2 判断产物A的结构(分子式为C8H8O3)。从下述选项中选择可能的答案。

1.3 从产物A (C8H8O3)的分子式可以明显看出,在A的形成过程中,一个C1 (只含有一个碳原子)片段从起始原料(C9H10O2)上裂解下来,反应后,这个C1片段转化的产物中含有氯。判断其结构,从如下选项中选择正确答案。
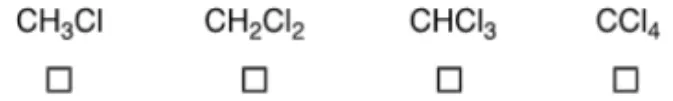
1.4 产物A的形成为氧化还原反应。
a. 在这个反应中,哪种原子(元素)的氧化态升高?选择正确答案。

b. 在这个反应中,哪种原子(元素)的氧化态降低?选择正确答案。

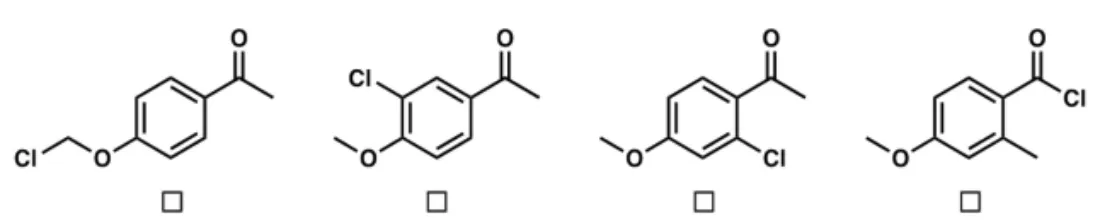
1.5 判断产物B的结构(实验式C9H9ClO2),选择正确答案。
1.6 在产物B的形成过程中,在反应体系中加入NaHSO3(aq)。在反应过程中,亚硫酸氢负离子(HSO3−)会发生化学变化。判断亚硫酸氢负离子转化为哪种物种,勾选正确答案。注意,这个结果不是指该物种的质子化状态(这里忽略酸碱平衡)。

实验2:滴定之变幻
介绍
历史上,瑞士曾有19个州开采和加工铁,以满足当地和周边区域的需求。这种活动的痕迹仍有留存,特别是在瑞士汝拉(Jura)。为了有效地生产钢铁,必须了解铁矿石的组成。络合滴定法是一种分析溶液中各种金属的通用方法,由ETH的Gerold Schwarzenbach教授在20世纪40年代首创。
提供给你的样品中只含有溶解在盐酸中的FeCl3和CaCl2的水合物。这是用盐酸消化的铁矿石样品的模拟体系。你的实验工作是通过络合滴定确定铁的浓度和样品的整体组成。该实验中,任何含水废弃物都被认为含有重金属,应收集在标“Waste P2”的烧杯中。
实验步骤
第一部分 未知铁矿石样品的稀释
1. 你拿到的是一个含大约1200毫克模拟铁矿石的样品。准确质量写在你的小瓶标签上。在答题纸的表格中记下质量。样品已经溶解在pH为1的盐酸中。
2. 在100 mL容量瓶中配制100 mL样品溶液,将标有“样品 + [参赛号]”的小瓶中的全部物质转入,加蒸馏水,转移过程可以用漏斗。此溶液被称为A,将在第二部分和第四部分使用。
第二部分 铁矿溶液的直接滴定
3. 将标记为“EDTA”的10.0 mM EDTA溶液加入滴定管。你可以用漏斗和烧杯。
4. 在300 mL的锥形瓶中:
• 使用移液管加入5.00 mL溶液A;
• 使用玻璃滴管加入10滴0.1 M盐酸;
• 在锥形瓶中加入去离子水至锥形瓶100 mL刻度线;
• 用药匙加入少量的凡拉明蓝(variamine blue)。
5. 滴定锥形瓶中的物质,直到溶液变成黄色。在答题纸上记录滴定体积V1。
6. 将锥形瓶中滴定后的物质倒入标有“Waste P2”的烧杯中。
7. 根据需要,重复上述步骤(步骤3–6)。
8. 在答题纸的最后一行报告你的最终结果。
第三部分 滴定准备
9.你拿到一个含约550 mg纯氯化钙二水合物(CaCl2·2H2O)的样品。准确质量写在小瓶标签上。把质量写到答题纸的表格中。
10. 利用250 mL容量瓶,配制250 mL氯化钙溶液,将全部CaCl2⋅2H2O (MW= 147.0 g mol−1)固体转入容量瓶,溶于蒸馏水。你可能需要一个漏斗来转移固体。这个溶液记为B,它将在第四部分中使用。
第四部分 铁矿石溶液的间接滴定
11. 清空滴定管。先用蒸馏水充分润洗滴定管,然后再用溶液B润洗。你可以借助烧杯。将冲洗液放入标有“Waste P2”的烧杯中。
12. 将溶液B加入滴定管。你可以借助漏斗和烧杯。
13. 在300 mL的锥形瓶中:
• 使用移液管,加入5.00 mL溶液A;
• 使用移液管,加入40.0 mL标有“EDTA”的10.0 mM EDTA溶液;
• 用滴管加入10滴缓冲液(注意:打开缓冲液时要小心,因为可能会有氨放出);
• 用量筒量取25 mL去离子水;
• 用量筒量取30 mL乙醇。你的样品可能出现浑浊。
14. 从标有铬黑T (“ErioT”)的小瓶中取出少量铬黑T指示剂,加入300 mL锥形瓶中。你的样品此刻应该显深蓝绿色。加入指示剂后立即进行滴定。
注意:加入指示剂后,无论滴定的进度如何,几分钟后颜色都会变为红色。倘若如此,滴定终点很难再检测到。
15. 滴定锥形瓶中的物质,直到溶液变成灰色。记录滴定体积V2。预期的滴定体积应低于15 mL。
16. 将锥形瓶的滴定体系倒入标有“Waste P2”的烧杯中。
17. 根据需要,重复上述步骤(步骤12–16)。
18. 在答题纸的最后一行报告你的最终结果。
回答问题
2.1 写出直接滴定至等当点所形成的EDTA络合物的化学式。EDTA的结构如下所示。在化学式中,EDTA采用的缩写为“H4Y”,它的共轭碱缩写为“H3Y−”“H2Y2−”等。提示:在这些条件下,溶液中的一种金属离子优先形成EDTA络合物。

EDTA的结构(相当于H4Y)
2.2 计算所给样品中氯化铁(III)的质量百分比(不考虑结晶水),采用wt.%表示。FeCl3的摩尔质量是162.2 g mol−1。
2.3 计算所给样品中氯化钙质量百分比(不考虑结晶水),采用wt.%表示。CaCl2的摩尔质量是111.0 g mol−1。
2.4 计算所给样品中结晶水的质量百分比(wt.%)。
2.5 为什么样品溶液A必须保持pH < 2?
在以下四个选项中选出正确答案。
□ 用化学方法稳定溶液中的Ca2+
□ 用化学方法稳定溶液中的Fe3+
□ 减少溶液中的Ca2+
□ 减少溶液中的Fe3+
2.6 你得到的溶液模拟了用浓盐酸消化的铁矿石。下列哪一种混合物可以用相同的方法?在以下四个选项中选出正确答案。
□ 赤铁矿(Fe2O3) + 石灰石(CaCO3)
□ 磁铁矿(Fe3O4) + 黄铜矿(CuFeS2)
□ 钛铁矿(FeTiO3) + 针铁矿(FeO(OH))
□ 菱铁矿(FeCO3) + 白云石(CaMg(CO3)2)
2.7 为什么对于间接滴定的样品,不论滴定进程如何,颜色都会由蓝变红?
在以下四个选项中选出正确答案。
□ 乙醇会还原Fe3+EDTA络合物
□ 碱性条件下铬黑T会发生水解
□ 铬黑T与Fe3+EDTA络合物的不可逆配体交换
□ 铬黑T被CaCO3沉淀吸附
实验3:简洁之美
说明
本实验提供6个未知成分的溶液S1–S6 (每个溶液大约10 mL)。溶液Sx标记为“[参赛号] + Sx”,其中x为从1到6。你的任务是确定这些溶液中所有的阳离子和阴离子。
提示:
• 在S1–S6的水溶液中含有以下7种阳离子和7种阴离子:
阳离子:Ag+,Ba2+,Ca2+,Fe3+,K+,Mn2+,Na+;
• 每种溶液中总共含有2种或3种离子;
• 每种离子只会出现在一种溶液中;
• Na+和K+同时存在于同一溶液中;
• 在某些情况下,可能需要多达15分钟才可以观察到明显的变化,将你观察到的实验现象填入第3.1小题的表中;
• 某些溶液由于在空气中的氧化而出现变色或沉淀。
回答问题
3.1 在溶液S1–S6之间进行交叉反应。将你观察到的实验现象填入答题纸上的第一个表中,采用如下符号:
• “↓”表示沉淀;
• “↑”表示气体放出;
• “S”表示溶液颜色发生变化;
• “–”表示没有可见的观测结果。用下列字母表示沉淀物的颜色:
• “W”代表白色/无色;
• “B”代表黑色;
• “C”代表有色的。
3.2 根据你观察到的实验结果和以上所给提示,确定S1–S6溶液中的离子。填写在答题纸上的第二张表格中。
3.3 写出可解释你所观察到的实验现象所对应反应的离子方程式,填入答题纸上的第三个表格中。沉淀物加“↓”,气体加“↑”。
补充材料:考试规则、常数、答题纸以及题目赋分与占比见补充材料,可通过链接https://www.dxhx.pku.edu.cn 免费下载。
