无机化学中“酸碱解离”教学内容的重构探讨
2024-03-04李淑妮翟全国王颖袁文玉张鹏胡满成高胜利
李淑妮,翟全国,王颖,袁文玉,张鹏,胡满成,高胜利
陕西师范大学化学化工学院,西安 710062
酸碱解离平衡一章在基础无机化学中占有很重要的地位,起开篇叙述与承化学平衡的作用,因此,大多数教材都将酸碱平衡放在四大平衡之首。近几十年来,酸碱反应及其应用发展很快[1,2]。然而,目前大多数的无机化学教材中相应的内容体系却无太大变动,缺乏最新科学研究成果,体现不出大学课程应有的高阶性、创新性和挑战度[3]。当今大学需要培养的是具有综合素质较强和理论基础扎实的创新型人才,我们为此做了一些探索和尝试,将酸碱解离平衡进行内容重构,以丰富酸碱平衡的教学内容。
1 重构“酸碱解离平衡”教学内容的探索
对酸碱解离平衡教学内容进行重构的探索,着眼于专业基本面知识的完整性和科学性,提高学生学以致用的能力,达到养成科学素质的目标。为了使教材内容逻辑结构清晰,将整个内容整合为5个模块。
1.1 第1模块为电解质溶液基础
人们对酸碱的认识虽然很早,但早期对酸碱的定义却仅凭感觉、味觉和触觉。直到1884年阿伦尼乌斯(S. A. Arrhenius,1859–1927)提出电解质电离理论[4]后,人们才开始逐渐认识酸碱的本质。电解质的行为,尤其是电解质在水溶液中的行为对于理解酸碱的性质就尤其重要。因此,本部分介绍了电解质溶液的基础内容,包括电解质和电解质溶液概念,延伸至离子的溶剂化和离子缔合及其理论;介绍了电解质溶液的活度和活度系数及电导和电导率。初步了解活度和活度系数的意义,对理解电解质溶液的行为有一定的帮助。增加了电解质溶液应用的简介。涉及电解质溶液的领域非常广泛,包括化学、化工、冶金、能源、生物、环保和地质等。对化学反应来说,相对气相或固相中的反应,发生在电解质溶液中的反应更快,更便于控制反应过程。
为了更好地将理论与实际相结合,本节设计了专题——电解质溶液体系活度系数的主要测定方法简介,简单讲解了各种测定方法及其技术。
1.2 第2模块为酸碱理论
这是本章的核心基本面,也是课程设计的重点和难点。在高中学习酸碱电离平衡的基础上,应该在广度和深度上有所扩展。欧拉(G. A. Olah,1927–2017)[5]研究极强酸性的非水溶液体系,获得了稳定的碳正离子,这使得超强酸体系受到关注。因此,本部分初步介绍了超强酸的定义、类型和应用。同时,简单介绍了超强碱的知识。
(1) 与传统教材中主要介绍酸碱电离理论、酸碱质子理论和酸碱电子理论不同,本部分详细介绍了酸碱溶剂理论、酸碱氧离子理论和酸碱正负离子理论。各种酸碱理论,各自有其优缺点及其各自的适用范围。
(2) 非水溶剂的结构、酸碱性、强度和溶剂化能力都对酸碱解离平衡影响极大。非水溶剂包括非水质子溶剂、非质子溶剂、离子液体和超临界流体等。pH标度只适用于水溶液。1932年,哈米特(L.P. Hammett,1894–1987)[6]提出了一种测定弱碱指示剂在酸性溶液中质子化程度的方法来描述非水溶剂中质子酸的强度。哈米特定义酸度函数H0为:
哈米特酸度函数表达的结果与pH相同。在水溶液中,H0相当于pH,因而H0标度可以看作是更一般的pH标度。H0越小,酸度越大;H0值越大,碱性越强。
(3) 超强酸(superacid)是比传统的强布朗斯特酸(如硫酸)或路易斯酸(如三氯化铝)更强的酸性体系。1966年,欧拉实验室的研究人员无意中将蜡烛放进溶液SbF5-HSO3F中,蜡烛竟在室温下被溶解,SbF5-HSO3F被称为“魔酸”(magic acid)。1971年,吉列斯比(R. J. Gillespie,1924–2021)[7]提出,超强酸是任何强于100%硫酸的体系,即H0≤ −11.93 (表1)。现在人们习惯地将酸强度超过100% H2SO4的酸或酸性介质叫做超酸(或超强酸),把SbF5-HSO3F (1 : 1)称作魔酸,其酸强度H0≤ −20。因此,介绍超强酸的某些概念和一些重要超强酸体系很有必要。

表1 液体超强酸的种类和酸强度
超强酸具有强酸性和很高的介电常数,能使非电解质转变为电解质和使很弱的碱质子化。超强酸可作为饱和碳氢化合物的分解、缩聚、异构化、烷基化等反应的催化剂来使用,它是很强的酸性催化剂,这些反应在室温以下的温度也容易进行。
(4) 同样,碱强度超过强碱(即pKa> 26)的碱为超强碱。和超强酸一样,有布朗斯特超强碱和路易斯超强碱。从状态又可分为固体和液体两类超强碱。超强碱的碱强度H─可用下式表示:
碳负离子超强碱在理论上有很大的数量,其中,有机锂试剂是很常用的超强碱。1988年,施洛瑟(M. Schlosser,1934–2013)[8]将有机基锂与醇钾混合,所得正丁基钾和叔丁醇锂的混合碱称为施洛瑟超强碱,它能与各种酸性极弱(pKa为35–50)的碳氢化合物反应。
与固体酸研究相比,固体碱的研究起步较晚,但应用也很广泛。例如用在烯烃和炔烃的异构化、缩合反应和酯交换反应中。
1.3 第3模块为酸碱强度
质子酸碱理论和电子酸碱理论是目前应用较为广泛的两种理论,所以这两类酸碱的强度评估是课程设计的重点和难点之一。
(1) 质子酸可以分为氢酸、含氧酸以及水合酸三种。质子酸碱强弱的常用判断方法有:酸的解离常数;通过离子势z/r(z和r分别为阳离子的电荷和半径)来判断含氧酸或氢氧化物的酸碱性;Pauling的半定量法以及徐光宪规则。
(2) 酸强度的热力学讨论。学生已学了热力学基本知识,因此写出热力学循环,查找并使用热力学数据可以计算得到物质的酸碱性强弱。这种方法使用范围广,也应该是处理复杂问题时的一种基本功训练。例如,对气态二元氢化物HnX的解离,其热力学循环为:
同气相解离相比,水溶液中质子酸解离的热化学循环多了HnX,Hn−1X-和H+三个物质的水合焓。因为离子水合的过程会放出大量的能量,所以,水合焓的影响使HCl在水中的酸式解离成为可能。
(3) 酸强弱的结构讨论。物质的酸碱性与其分子结构是相关的,因此,化合物的酸碱性与元素在周期表中的位置密切相关。对于元素的简单氢化物HnA (A可以是B、C、Si、N、P、As、O、S、Se、Te、F、Cl、Br、I),一般来说,随着非氢元素共价半径增加,酸强度增加。对于水合酸,如[M(H2O)x]n+,酸的强度通常随中心金属离子正电荷的增高和半径的减小而增大[9]。由于质子更容易从高电荷和小半径的阳离子附近移去,所以酸性应该随着阳离子电荷增大和半径减小而增高。
(4) 影响质子酸酸性的因素[10]。对质子酸酸性强度影响的因素很多,如诱导效应、离域效应(也常称作共振效应)、场效应、溶剂效应、氢键效应等。
(5) 路易斯电子酸碱强度的量度。1963年,皮尔森(R. G. Pearson,1919–2022)[11,12]根据实验观察,提出了软硬酸碱(Hard and Soft Acids and Bases,HSAB)原理:硬碱优先与硬酸配位,软碱优先与软酸配位。也就是,硬亲硬,软亲软,交界酸碱两边管。“硬”“软”两词是形容酸碱电子云变形的程度,不管酸和碱,凡是难变形称为硬,而易变形称为软。根据这些特点,可以对周期表中元素的软和硬进行初步判断(图1)。
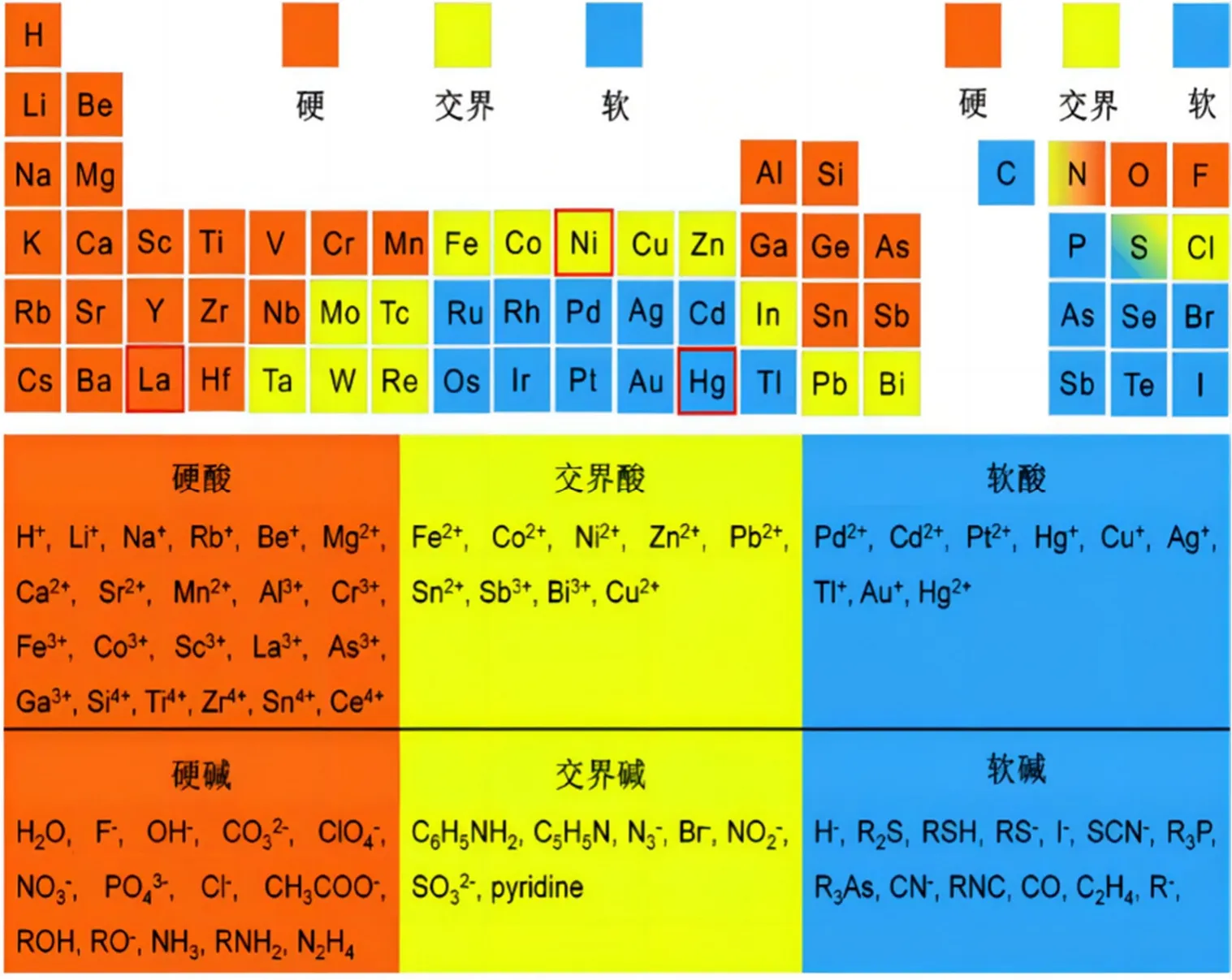
图1 软硬酸碱作用原理[13]
软硬酸碱原理是一个经验规则,仅限于定性应用,并有一定的局限性。因此,建立酸碱软硬标度的定量工作尤其重要。酸碱软硬标度,包括Klopmant量子力学微扰理论法[14]、ECW四参数方程[15]、戴安邦酸碱软硬性的势标度[16]和皮尔森酸碱绝对硬度[17,18]等。
(6) 通过实例更能帮助学生了解路易斯酸碱强度,因此,详细讨论了BX3的路易斯酸性[19]、CO2的路易斯酸性、MX4(M = Si,Ge,Sn;X = F,Cl,Br)的路易斯酸性、SO2和SO3的路易斯酸碱性和卤素路易斯酸。
(7) 学以致用,提高学生处理复杂问题的能力是教学应该追求的目标之一。通过软硬酸碱原理不仅可以很好解释自然界中元素的存在形式、分析化学中掩蔽剂的选择以及判断配合物的稳定性[20],还可以用来判断化学反应的方向和程度、判断盐的溶解度大小等。另外,在有机化学反应中[21,22],如判断反应的方向和有机反应的选择性等方面也有很好的应用。
1.4 第4模块为水溶液中弱酸弱碱的解离平衡
这也是本章教学内容的重点和难点。对水溶液中一元、二元弱酸弱碱的解离平衡及计算、缓冲溶液、酸碱指示剂都给予了充分的讲解。
(1)详细介绍了水溶液中一元、二元弱酸弱碱的解离平衡,介绍了H+浓度和OH−浓度计算的准确式、近似式和最简式;引入分配系数和误差概念;与后续《分析化学》课程相应的质子平衡方程(proton balance equation, PBE)建立联系。
(2) 增加缓冲溶液配制和应用内容。生物体内的生化反应,医学检测,药物生产与保存以及分析实验等都常需缓冲溶液的参与才能正常进行,同时所需要的缓冲液又各有不同。因此,只有掌握缓冲溶液的相关知识及用途,才能正确地根据实际需要选择一定浓度和pH值的缓冲溶液来使用。
(3) 处理复杂体系,即酸碱平衡与沉淀-溶解平衡、氧化还原平衡、配位平衡间的平衡移动计算时,突出多重平衡原理,会使推导过程大为简化。
(4) 增设专题——弱酸解离常数测定方法简介。Ka或Kb可以通过热力学数据的方法或者实验的方法获得。
1.5 第5模块为酸碱滴定和误差基本概念
作为常规的分析方法,滴定分析法操作简便快速,特别是用仪器检测终点具有灵敏度高、选择性好,准确迅速等优点,具有很大的使用价值。因此,在讲述了酸碱理论、强度、平衡、移动之后,应该增加酸碱滴定知识模块,包括从滴定的可行性、终点误差的计算公式、指示剂的作用原理、突跃范围及影响因素、滴定曲线绘制等方面知识点。这对于学生更为深入了解酸碱解离平衡原理和应用都是必要的。另外,酸碱滴定必然涉及到误差基本概念的介绍。
在化学定量分析中,当依据分析结果进行决策时必须充分了解分析结果本身的质量,也就是根据使用目的确认分析结果的可靠程度。不确定度是一种表征被测量值所处范围的评定,是真值以一定置信概率落在测量平均值附近的一个范围内。因此,了解不确定度与误差的区别以及不确定度评定步骤,进而合理评定出不确定度对于测量与分析来说尤其重要。
2 建议的“酸碱理论及反应”教学内容的重构方案
在前期通过文献检索、梳理及综述工作,从各个化学研究领域的文献中找到能够体现酸碱理论及反应新知识、新思想、新方法的精华内容,充分考虑学生的认知规律及知识的内在逻辑与联系,合理规划本章节内容体系,提出了建议的酸碱理论及反应教学内容的重构方案(表2)。考虑到无机化学是大学一年级学生的专业基础课,学时仍与原有教学相同,讲授中突出酸碱发展的实践成果,建立无机化学与其他学科的联系,拓展学生的视野。

表2 建议的“酸碱理论及反应”教学内容重构方案
3 结语
通过学习和实践,对酸碱理论及反应教学内容进行了重构探讨。采取了线上-线下相结合,专题讲座-学生沙龙-课程考评并行的方法进行课程设计。重构后的总体内容丰富,能够体现高阶性、创新性和挑战度的要求,有利于教师备课和学生自主学习。新的模式能体现专业-能力-素质有机融合的教育理念,有助于提高教学质量,而且能推进学生参与创新实践活动的兴趣。
