改良型生物转盘污水处理系统中有氧反硝化菌菌群研究
2024-03-02方纪云
方纪云
(大同市供排水集团公司,山西 大同 037000)
随着城市的快速发展,我国生活污水排放量持续增加,城市生活污水处理成为目前急需解决的重要问题。我国城市生活污水中所包含的主要成分是纤维素、蛋白质、淀粉和矿物油等有机物,水质中所含的生物需氧量(BOD)、化学需氧量(COD)、总氮(TN)和总磷(TP)都比较高,属于典型的C/N 低比型生活污水,其最高的BOD5/TN 为3.03,而最低仅为1.42。虽然大多数生活污水都经过了一级处理和二级处理,但其中的TN、TP 等富营养化指标还是严重超标,排放后会导致水体富营养化等环境问题,更严重的是对人体产生危害[1]。基于此,本文利用改良型生物转盘工艺,进行有氧反硝化菌的富集筛选与多样性分析,对污水处理系统中的有氧反硝化微生物进行研究,对筛选高效生物脱氮微生物提供了技术支持[2]。
1 改良型生物转盘工艺概述
1.1 传统生物转盘工艺
生物转盘是原联邦德国开创的一种污水生物处理技术[3]。传统生物转盘主要由盘片、接触反应槽、转轴和驱动装置组成。转盘在驱动装置的带动下,以较低的线速度在充满污水的接触反应槽内转动,盘片全浸没入或部分浸没入反应槽内的污水中。转盘转动时与空气和污水交替接触,运行一段时间后,转盘盘片上会形成一层厚厚的生物膜,生物膜由大量微生物组成[4]。生物膜交替地与废水和空气相接触,形成一个连续的吸氧、吸附和氧化分解过程,不仅能够维持微生物的生长繁殖,而且能够去除有机污染物。随着运行时间的延长,转盘上的生物膜逐渐增厚老化并脱落下来,经沉淀池沉淀排出,新的生物膜还继续生长,从而形成一个周而复始的过程[5]。
1.2 改良生物转盘工艺
改良型生物转盘BBR(Bacillus Bio-Reactor)工艺是一种新型的污水处理工艺,该工艺是在原来的普通生物转盘法的基础上改良的生物膜污水处理系统,可以看作是A2/O2与RBC相结合的新工艺,其中的1号池和2号池是缺氧池,3号池和4号池是有氧池,溶氧分别为(0.08±0.04)mg/L、(0.34±0.34)mg/L、(2.99±1.11)mg/L、(2.04±1.28)mg/L。BBR 生物转盘浸没比为40%,转速为3~8 r/min,溶氧为(0.88±0.42)mg/L。创新点是该工艺通过一次性在BBR 装置和曝气池内加入粉末状菌剂,该菌剂主要是包含了芽孢杆菌(Bacillus),目的是通过芽孢杆菌的生长与繁殖,针对BOD、COD、T-N 和T-P等污染物进行生物处理。BBR 污水处理技术的基本工艺流程如图1所示。
BBR 系统的优点:处理效果好,对氮、磷污染物的去除效果好,去除速度快;能够分解吸收处理过程中产生的臭气,后续处理中不需要增加臭气处理过程;对COD 去除效果良好,去除能力强,并且工艺简单,便于运行管理;溶解氧要求低,运行费用较低,不易发生污泥膨胀;系统活性污泥浓度高,耐冲击负荷能力强,对BOD 去除率高,运行效果稳定;污泥产量小,脱水性能好,可直接浓缩脱水,便于进一步处理与处置。
2 有氧反硝化菌介绍
有氧反硝化菌是以硝酸盐作为最终电子受体进行反硝化作用,其催化反应顺序为:NO3-→NO2-→NO→N2O→N2。该过程由下面4 种酶参与完成:硝酸盐还原酶(Nar)、亚硝酸盐还原酶(Nir)、一氧化氮还原酶(Nor)和一氧化二氮还原酶(Nos)。反硝化过程中起主要作用的酶是亚硝酸盐还原酶(Nir),亚硝酸盐还原酶(Nir)是催化反硝化作用的限速酶,能够将NO3-催化还原为NO,Nir基因也是在反硝化菌功能基因中研究最多的基因,并作为反硝化菌的分子标记用于研究其种群结构及多样性。Nir分布于细胞膜外周质中,有2种类型:一是可溶性含铜酶,即Cu 型亚硝酸盐还原酶,由NirK 基因编码,这种酶的催化产物是NO 和N2O 的混合物;二是细胞色素还原酶(cd1-Nir),由NirS编码,其催化的产物也是NO和N2O混合物。NirS是反硝化过程中一个极其重要的基因,也是反硝化细菌检测的一个重要靶基因。这两种酶虽然功能相同,但其结构和催化位点却不同,并且不能共同存于同一种细胞中。
根据近年来的研究报道证实,不同菌属的有氧反硝化菌对氧气的耐受能力有显著差异。对于大部分有氧反硝化菌来说,当溶解氧质量浓度在3 mg/L 时,都具有反硝化活性。随着溶解氧含量的上升,反硝化作用过程中相关酶的表达会被抑制,进而减弱反硝化作用。
3 有氧反硝化菌的富集筛选与多样性分析
3.1 菌株筛选
本次样品采集于BBR 反应器、1 号池、2 号池、3 号池、4 号池5 个位点。将5 g 污泥样品加入到100 mL 无菌水中,充分混匀后按1%比例接种于盛有玻璃珠的异养硝化培养基(HM)中培养,在30 ℃震荡培养箱以转速150 r/min 培养10 d,每隔48 h 更换新鲜培养基[6]。驯化培养结束后,按照10%的接种比例接种到有氧反硝化培养基(DM 培养基)中进行初筛,每隔48 h 按照10%的体积比更换新鲜培养基,连续培养8 d。培养结束后,取1 mL经过初筛的菌液均匀涂布在固体GN显色培养基平板上,采用稀释涂布法、连续划线法分离单菌落。在1 mL 灭过菌的离心管中加入100 μL 的菌液,同时加入900 μL 磷酸盐缓冲盐水(1×PBS)进行稀释,此为稀释10-1的菌液[7]。从10 倍菌液中取100 μL 到灭过菌的新离心管中,加入900 μL 磷酸盐缓冲盐水(1×PBS)再进行稀释,此为稀释10-2的菌液。以此类推,依次稀释到10-4。分别在10-3、10-4稀释菌液中取100 μL,均匀涂布到LB 固体培养基上。涂布后的固体培养基在30 ℃培养箱中培养。
选择单菌落能够变为蓝色的菌株作为目的菌株。为进一步验证所挑选的目的菌株具有能够使GN 显色培养基变蓝的特性,在盛有3 mL GN显色培养基的小试管中挑取单菌落接菌,在30 ℃、150 r/min 摇床中培养,观察GN 显色培养基是否变色。能使GN 显色培养基由绿色变成蓝色的菌株作为最终目的菌株。筛菌过程中150 r/min条件下溶氧范围在3.4~5.1 mg/L。
3.2 有氧反硝化菌多样性分析
利用MEGA4.0将分离得到的菌株构建分类学系统发育树,选用“Neighbor jioining”,将bootstrap 值设置为1 000 次重复,利用系统发育树分析不同反应单元样品中有氧反硝化菌的进化关系和地位。利用MOTHUR软件对筛选的菌株序列进行OTU 聚类分析,通过OTU 聚类分析了解不同样品中有氧反硝化菌的多样性、差异性和相对丰度。利用Venn图直观地表述不同采样位点中OTUs 的组成和群落结构相似性。利用丰度图分析了解不同反应单元微生物分布情况。
3.3 结果与分析
通过对BBR 反应器、1 号池、2 号池、3 号池、4 号池样品进行有氧反硝化菌的初筛和复筛,共筛选出226株具有有氧反硝化特性的菌株,这些菌株均因pH 值升高而对BTB 产生阳性反应。根据16s rRNA 的基因测序结果,对筛选出的这些菌株进行分类鉴定,将相似度在98.6%以上的菌株归类为一个OTU,共分为24 个OTUs。226 株菌在24 个OTUs 中的分布情况如表1 所示。在NCBI 16S rRNA 数据库的基础上,分别从24 个OTUs 中挑选出一个代表菌株,代表菌株的分类信息如表2所示。

表1 有氧反硝化菌在不同OUTs中的分布情况Tab.1 Distribution of aerobic denitrifying bacteria in different OUTs

表2 24个OTUs的分类信息Tab.2 Classification information for 24 OTUs
为比较各反应单元中可培养有氧反硝化菌的分布特性,本研究对不同采样点分离出来的有氧反硝化菌多样性进行了分析。图2 是各反应单元有氧反硝化菌的Venn 图,图中所示的数字是不同反应单元中OTUs的数量,重叠部分表示共有OTUs 的数量,通过Venn 图可以直观地了解每个反应单元中共有和特有的OTUs数量。从Venn 图可以看出,BBR 反应单元有13 个OTUs,1 号反应池中有11 个OTUs,2 号反应池中有14个OTUs,3 号反应池中有10 个OTUs,4 号反应池中有10 个OTUs。其中5 个采样位点共有的OTUs 有3 个,分别是OTU1(Pm.stutzeri)、OTU8(Pm.monteilii)、OTU10(G.cholesteroliborans)。在不同反应池中OTUs分布呈现出不均匀性,由此可以表明有氧反硝化菌在不同反应池中的群落结构是存在一定差异性的。
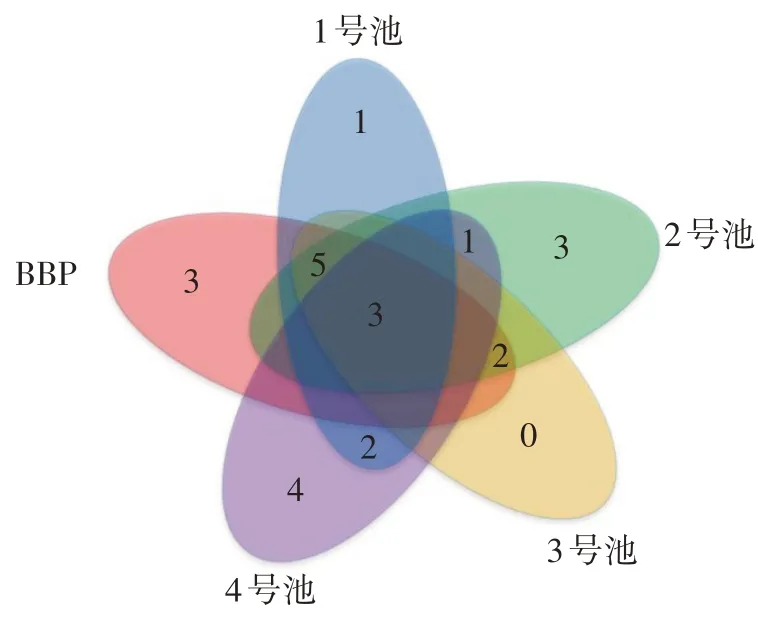
图2 不同反应单元中可培养有氧反硝化菌的Venn 图Fig.2 Venn diagram of culturable aerobic denitrifying bacteria in different reaction units
为了更好地了解不同反应单元可培养有氧反硝化菌的群落结构特点,绘制了相对丰度图,详情如图3 所示。结合Venn 图可知,在5 种样品中相对丰度最大的是OTU1(Pm.stutzeri),在BBR 反应单元、1 号池、2 号池、3 号池、4 号池的相对丰度分别为30.95%、22.81%、24%、52.17% 和23.08%。OTU2(Pm.guguanensis)在BBR、1 号池、2 号池和3 号池中所占比例分别是17.31%、23.81%、15.79%和18%,而在4 号池中没有该OTU 存在。在4 号池中特有的OTUs 有4 中,分别是OTU17(Ac.Xylosoxida),OTU18(An.Haemolyticus),OTU19(Bj.Fluminensis),OTU23(Rc.Ruber),它们所占的比例都是4.35%。OTU9(Az.communis)只在2 号池和4号池中存在,丰度分别为5.26%、13.04%。
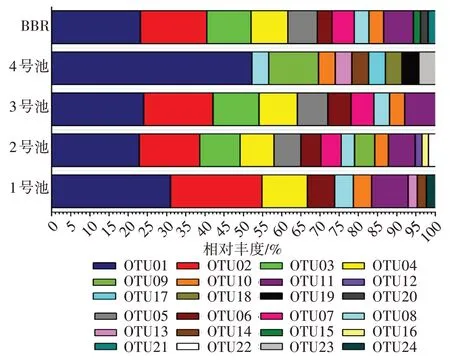
图3 各反应单元中有氧反硝化菌的相对丰度图Fig.3 Relative abundance of aerobic denitrifying bacteria in each reaction unit
在24 个OTUs 中,OTU24(Ar.Protophormiae)只存在于1 号池中,OTU14(Ac.aegrifaciens)、OTU16(N.puris)和OTU22(Pa.phragmitetus)只存在于2 号池中,OTU17(Ac.xylosoxidans)、OTU18(Ac.haemolyticus)、OTU19(Bj.Fluminensis)、OTU23(Rc.Ruber)只存在于4号池中,OTU15(B.unclassified)、OTU20(Pm.pseudoalcaligene)、OTU21(St.acidaminiphila)只存在于BBR 反应单元,3号池中没有特有OTUs存在。
4 讨论
本研究中,有3 个OTUs 同时存在于5 个反应池中,分别是OTU1(Pm.stutzeri)、OTU8(Pm.monteilii)、OTU10(G.cholesteroliborans)。Pm.stutzeri和Pm.monteilii具有有氧反硝化能力均有文献报道过。一株Pm.stutzeriYZN-001 在2011 年被分离出来,并证实在低温条件下能够去除氨基盐。菌株Pm.stutzeriKTB 从活性污泥中被分离出来,并证实具有异养硝化有氧反硝化能力。近年来,Pm.stutzeri被从各种环境样品中分离出来,例如,土壤、污水、地表水等,在自然界中广泛存在。本研究中Pm.stutzeri在所分离的可培养有氧反硝化菌中是所占比例最大的优势菌,因而在用于污水处理生物脱氮方面具有重要的价值。与Pm.stutzeri一样,Pm.monteili也被研究人员从深海底泥、香蕉根际土壤、制革废弃地等各种环境样品中分离筛选出来。已有文献报道过Pm.monteili具有有氧反硝化能力,例如菌株Pm.monteiliiH97 和Pm.monteiliiLKX-1。G.cholesteroliboransChol-3 首次被分离出来是在污泥样品中,目前针对G.cholesteroliborans具有有氧反硝化能力鲜有文献报道。
OTU9(Az.Communis)在4 号池中丰富度较高,而未发现存在于其他反应池中。目前针对Az.Communis具有有氧反硝化能力的研究鲜有报道,在之前的报道中,有研究人员发现从炼油厂含油污泥中分离出的Az.Communis具有严格的需氧代谢特征,能够从硝酸盐中形成N2O。这一结论与本研究结果相一致,4 号池处于好氧条件,说明该菌是好氧菌。此外,有研究人员发现Az.Communis能够为植物提供N2并且能够利用甲苯作为底物进行反硝化作用。推测这一结论可能与Az.Communis有氧反硝化有关。在本研究中,Az.Communis已被证实能够去除硝酸盐,但其反硝化作用途径有待进一步研究。由Venn图所显示的丰富度的不均匀分布表明,可培养有氧反硝化菌群落结构在这5个取样点具有差异性。2 号池和BBR 反应池有氧反硝化细菌群落较丰富,分别有14 个OTU 和13 个OTU,且缺氧池中有氧反硝化菌的结构与其他组相比有显著差异。因此,在这5个采样点中导致可培养群落结构多样性的因素还需要进一步研究。
5 结论
本研究通过利用有氧反硝化培养基、异养硝化培养基等特定培养基,从污水处理系统5个不同反应单元活性污泥样品中共筛选出226株有氧反硝化菌,归类为24 个OTUs,并对5 个不同采样点的微生物群落分布情况进行了分析,结果表明5个不同反应池中微生物群落结构存在一定的差异性。本试验针对污水处理系统中的有氧反硝化微生物进行研究,对筛选高效生物脱氮微生物提供了技术支持,为污水系统中有氧反硝化菌的研究提供了理论依据,但影响不同反应单元微生物群落结构多样性的因素还需要进一步研究。
