锯叶棕果实化学成分分离鉴定及抗前列腺炎活性研究
2024-03-02郝丽亚李冰洁王中林郑新华
郝丽亚,李冰洁,王中林,郑新华
(平顶山学院 医学院,河南 平顶山 467000)
锯叶棕果实为棕榈科灌木植物锯叶棕榈(Serenoarepens(bartr.) small)成熟的干燥果实,又称沙巴棕、蓝棕、锯棕榈[1].锯叶棕主要分布于美国东南部、墨西哥及中国的海南、广西、河南、湖北、安徽、浙江等地.锯叶棕果实具有清热利湿、祛痰平喘、解毒消痈、镇静止痛的功效,临床用于治疗前列腺炎、内分泌紊乱、乳房发育不良、风湿性关节痛、头痛、食欲不振、酒精中毒等50 多种疾病[2].药理作用[3]显示锯叶棕果实具有抗菌、催欲生精、利尿、调节内分泌、祛痰平喘、镇静、解痉、抗肿瘤等活性.锯叶棕果实主要化学成分包括脂肪酸、黄酮、三萜、木脂素、挥发油、生物碱等[4].詹绪新等[5]研究显示锯叶棕果实提取物可有效缓解慢性前列腺炎大鼠的精液炎性指标.锯叶棕果实提取物软胶囊(批准文号Z20170002,德国泰德制药厂)作为治疗良性前列腺增生的新药,可有效缓解前列腺增生患者的临床症状,提高患者的生存质量[6].
本研究组致力于前列腺相关疾病研究,为了进一步探讨锯叶棕果实治疗前列腺炎的活性成分,本文对锯叶棕果实提取物进行分离纯化,并测试所得化合物抗前列腺炎活性.
1 仪器与材料
DRX-600 型核磁共振波谱仪(德国Bruker 公司);Agilent1200 型高分辨质谱仪(美国Agilent Technologies 公司);Sephadex LH-20 葡聚糖凝胶(美国Waters 公司);柱色谱硅胶(青岛海洋化工厂);HR-150A 型分析天平(日本艾安得公司);氘代二甲基亚砜-d6(DMSO-d6,北京昱盛泽生物科技有限公司) ;白介素(IL)-1β,IL-6 酶联免疫试剂盒(上海恒远生化试剂有限公司).所用试剂均为分析纯.
锯叶棕果实采自河南平顶山市,由平顶山学院郑新华教授鉴定为锯叶棕榈[Serenoarepens(bartr.)small]成熟的干燥果实.
2 提取与分离
取锯叶棕果实19.7 kg,加90%乙醇连续回流得到锯叶棕果实浸膏2.3 kg.依次加入石油醚、二氯甲烷、乙酸乙酯、正丁醇萃取,得石油醚部分浸膏 (Fr.A,135.2 g),二氯甲烷部分浸膏 (Fr.B,142.7 g),丙酮部分浸膏 (Fr.C,164.9 g),正丁醇部分浸膏(Fr.D,171.5 g).
取Fr.B,采用硅胶柱分离,以石油醚-乙酸乙酯(体积比90:10→60:40→40:60→10:90)梯度洗脱,得到9 个组分 (Fr.B1~Fr.B9).取Fr.B2,采用硅胶柱进行分离,以石油醚-丙酮 (体积比80:20→50:50→20:80)梯度洗脱,得化合物1(25 mg)、2(26 mg)、10(23 mg)、11(19 mg).取Fr.B5,采用硅胶柱进行分离,以石油醚-乙酸乙酯 (体积比70:30→50:50→20:80)梯度洗脱,得化合物3(21 mg)、4(18 mg)、6(27 mg)、14(26 mg)、20(30 mg)、24(23 mg)、26(19 mg).
取Fr.C,采用硅胶柱行分离,以二氯甲烷-乙酸乙酯 (体积比80:20→50:50→20:80→0:100)梯度洗脱,得到10 个组分 (Fr.C1~Fr.C10).取Fr.C3,采用硅胶柱进行分离,以二氯甲烷-丙酮 (体积比70:30→50:50→20:80)梯度洗脱,得化合物5(23 mg)、8(21 mg)、12(29 mg)、13(22 mg)、21(18 mg).取Fr.C5,采用硅胶柱进行分离,以二氯甲烷-丙酮 (体积比80:20→20:80→0:100)梯度洗脱,得化合物7(25 mg)、9(18 mg)、15(31 mg)、18(23 mg).
取Fr.D,采用硅胶柱进行分离,以乙酸乙酯-甲醇 (体积比80:20→50:50→20:80→0:100)梯度洗脱,得到9 个组分 (Fr.D1~Fr.D9).取Fr.D2,采用硅胶柱进行分离,以丙酮-甲醇 (体积比70:30→50:50→20:80)梯度洗脱,得化合物16(18 mg)、17(26 mg)、18(23 mg)、19(29 mg)、22(27 mg).取Fr.D4,采用硅胶柱进行分离,以丙酮-甲醇 (体积比60:40→30:70)梯度洗脱,得化合物16(18 mg)、23(25 mg)、25(24 mg).
3 结构鉴定
化合物1 无色胶状物 (丙酮).ESI-MSm/z:204.9 [M+Na]+.1H NMR (600 MHz,丙 酮-d6)δ:6.39 (1H,m,H-2),5.32 (1H,m,H-6),5.18 (1H,m,H-5),4.47 (2H,m,H-1),3.12 (1H,m,H-4β),2.71 (1H,m,H-4α),1.93 (3H,s,8-CH3),1.65 (3H,s,9-CH3).13C NMR (150 MHz,丙酮-d6)δ: 60.3 (C-1),142.6 (C-2),128.4 (C-3),37.1 (C-4),76.1 (C-5),124.6 (C-6),139.2 (C-7),25.8 (8-CH3),18.5 (9-CH3).以上数据与文献[7] aglycone 基本一致.
化合物2 白色粉末 (丙酮).波谱数据与文献[8]2,2′,3,3′,4,4′-六羟基-6,6′-联苯二甲酸二乙酯基本一致.
化合物3 白色晶体 (丙酮).波谱数据与文献[9]丁香脂素基本一致.
化合物4 白色针晶 (丙酮).波谱数据数据与文献[10] 3,4,5-三甲氧基肉桂醇基本一致.
化合物5 白色粉末 (丙酮).ESI-MSm/z:558.9 [M+Na]+.1H NMR (600 MHz,丙酮-d6)δ:5.71 (1H,s,H-11),4.38 (1H,d,J=12.0 Hz,H-3),4.16 (1H,m,H-2),3.08 (1H,m,H-18),1.57 (3H,s,H-24),1.43 (3H,s,H-27),1.38 (3H,s,H-29),1.03 (3H,d,J=8.2 Hz,H-30),0.93 (3H,s,H-25),0.87 (3H,s,H-26).13C NMR (150 MHz,丙酮-d6)δ: 49.1 (C-1),67.1(C-2),80.5 (C-3),56.3 (C-4),51.4 (C-5),22.6 (C-6),32.1 (C-7),38.5 (C-8),49.4 (C-9),37.5 (C-10),23.8(C-11),129.2 (C-12),139.1 (C-13),41.8 (C-14),30.5(C-15),27.1 (C-16),49.3 (C-17),54.8 (C-18),72.6 (C-19),43.1 (C-20),28.3 (C-21),40.2 (C-22),179.4 (C-23),15.2 (C-24),18.1 (C-25),17.9 (C-26),24.8 (C-27),179.1 (C-28),28.2 (C-29),18.1 (C-30).以上数据与文献[11] triterpenoster 基本一致.
化合物6 黄色粉末 (甲醇).波谱数据与文献[12] 5,6,7,4′-四羟基-黄酮醇基本一致.
化合物7 白色粉末 (甲醇).波谱数据与文献[13] salicifoneoliganol 基本一致.
化合物8 淡黄色粉末 (甲醇),ESI-MSm/z:215.2 [M+Na]+.1H NMR (600 MHz,丙酮-d6)δ:6.31 (1H,d,J=8.2 Hz,H-3),7.61 (1H,d,J=8.2 Hz,H-4),6.73 (1H,s,H-5),6.59 (1H,s,H-8),3.87 (3H,s,8-OCH3).13C NMR (150 MHz,丙酮-d6)δ: 124.6 (C-1),163.2 (C-2),102.9 (C-3),143.7 (C-4),113.5 (C-5),144.2 (C-6),151.9 (C-7),108.2 (C-8),55.8 (8-OCH3).以上数据与文献[14] scopoletin 基本一致.
化合物9 白色粉末 (丙酮).波谱数据与文献[15]3,5-二甲氧基-4-羟基苯丙酮基本一致.
化合物10 淡黄色粉末 (丙酮),ESI-MSm/z:285.1 [M+Na]+.1H NMR (600 MHz,丙酮-d6)δ:6.41 (1H,s,H-7),6.09 (1H,s,H-5),5.01 (1H,s,8-OH),3.83 (3H,s,10-OCH3),3.07 (2H,t,J=8.2 Hz,H-3),2.93 (2H,m,H-2′),2.63 (2H,m,H-6′),2.48 (2H,m,H-3′),2.37 (2H,m,H-5′),2.19 (2H,m,H-2).13C NMR (150 MHz,丙酮-d6)δ: 48.2 (C-1),36.1 (C-2),38.5 (C-3),147.2 (C-4),78.5 (C-5),98.3 (C-7),153.4 (C-8),125.2 (C-9),53.3 (C-1′),33.2 (C-2′),32.7 (C-3′),211.5 (C-4′),100.8 (C-5′),159.6 (C-6′),55.6 (10-OCH3).以上数据与文献[16] cannabispiran基本一致.
化合物11 棕色粉末 (丙酮),ESI-MSm/z:765.3 [M+Na]+.1H NMR (600 MHz,丙 酮-d6)δ:6.81 (2H,d,J=2.2 Hz,H-5,5′),6.73 (2H,br s,H-2,2′),6.43 (2H,dd,J=8.2,2.2 Hz,H-6,6′),4.97 (2H,t,J=2.2 Hz,H-9α,9′α),3.76 (2H,t,J=2.2 Hz,H-9β,9′β),3.65 (6H,s,3,3′-OCH3),3.52 (6H,s,4,4′-OCH3),2.91 (2H,dd,J=12.0,5.2 Hz,H-7α,7′α),2.52 (2H,dd,J=12.0,2.2 Hz,H-7β,7′β),2.48 (2H,m,H-8,8′).13C NMR (150 MHz,acetone-d6)δ: 126.1(C-1),113.1 (C-2),147.2 (C-3),144.2 (C-4),110.9(C-5),124.6 (C-6),40.3 (C-7),46.2 (C-8),69.5 (C-9),126.1 (C-1′),113.1 (C-2′),147.2 (C-3′),144.2 (C-4′),110.9(C-5′),124.6 (C-6′),40.3 (C-7′),46.2 (C-8′),69.5 (C-9′),56.3 (3-OCH3),55.7 (3′-OCH3).以上数据与文献[17] diarctigenin 基本一致.
化合物12 黄色粉末 (丙酮),ESI-MSm/z:273.4 [M+Na]+.1H NMR (600 MHz,丙 酮-d6)δ:7.61 (1H,s,H-8),7.23(1H,d,J=8.2 Hz,H-4),7.13(1H,s,H-5),6.62 (1H,d,J=8.2 Hz,H-2),2.53 (3H,s,7-CH3).13C NMR (150 MHz,丙酮-d6)δ: 166.8 (C-1),108.5 (C-2),167.2 (C-3),108.2 (C-4),150.3 (C-4α),120.9 (C-5),135.3 (C-6),164.2 (C-7),124.9 (C-8),191.7 (C-9),184.1 (C-10),114.6 (C-8α),108.2 (C-9α),137.1 (C-10α),23.5 (7-CH3).以上数据与文献[18]1,3,7-trihydroxy-6-methyl-anthraquinone 基本一致.
化合物13 白色粉末 (甲醇).波谱数据与文献[19] 3-羟基-4-甲氧基肉桂酸甲酯基本一致.
化合物14 白色粉末 (丙酮),ESI-MSm/z:236.8 [M+Na]+.1H NMR (600 MHz,丙 酮-d6)δ:7.09 (1H,s,H-8),6.53 (1H,s,H-5),6.37 (2H,s,H-2',6'),4.91 (1H,d,J=8.2 Hz,H-1),4.63 (1H,d,J=12.0 Hz,H-4),4.47 (1H,dd,J=8.2,2.2 Hz,H-11α),4.09 (1H,dd,J=8.2,2.2 Hz,H-11β),3.84 (6H,s,3',5'-OCH3),3.79 (3H,s,4'-OCH3),2.96 (1H,dd,J=8.2,2.2 Hz,H-2),2.63(1H,m,H-3).13C NMR (150 MHz,丙 酮-d6)δ: 44.3(C-1),45.7(C-2),43.6(C-3),72.9 (C-4),108.1 (C-5),151.3 (C-6),51.3 (C-7),109.4(C-8),133.2 (C-9),134.3 (C-10),73.1 (C-11),176.3(C-12),137.6 (C-1'),111.5 (C-2'),154.1 (C-3'),137.3(C-4'),154.1 (C-5'),111.5 (C-6'),58.2 (3'-OCH3),60.7(4'-OCH3).以上数据与文献[18] podophyllotoxin 基本一致.
化合物15 白色粉末 (丙酮),ESI-MSm/z:560.9 [M+Na]+.1H NMR (600 MHz,丙 酮-d6)δ:7.15 (1H,d,J=8.2 Hz,H-6′),7.03 (1H,d,J=8.2 Hz,H-2′),6.79 (1H,dd,J=8.2,2.2 Hz,H-6′′),6.65~6.71 (5H,m,H-2,5,6,2′′,5′′),5.51 (1H,d,J=8.2 Hz,H-7′′),4.65 (1H,dd,J=8.2,2.2 Hz,H-7′),4.02 (3H,s,10-OCH3),3.75 (3H,s,10′-OCH3),3.71 (3H,s,10′′-OCH3),3.51 (1H,m,H-8′′).13C NMR (150 MHz,丙酮-d6)δ: 135.7 (C-1),113.8 (C-2),148.1 (C-3),144.9 (C-4),115.3 (C-5),120.7 (C-6),33.8 (C-7),44.0(C-8),73.4 (C-9),136.1 (C-1′),108.4 (C-2′),151.5 (C-3′),148.3 (C-4′),12 8.3(C-5′),1 158.4 (C-6′),83.5 (C-7′),54.0 (C-8′),59.7 (C-9′),134 .2(C-1′′),109.2 (C-2′′),151.5 (C-3′′),146.2(C-4′′),117.6 (C-5′′),120.4 (C-6′′),90.2 (C-7′′),55.3 (C-8′′),65.1 (C-9′′),58.1 (10-OCH3),56.7 (10′-OCH3),56.3 (10′′-OCH3).以上数据与文献[20]herpetriol 基本一致.
化合物16 黄色粉末 (丙酮).波谱数据与文献[21] 4’,5-二羟基-3’,7-二甲氧基黄酮基本一致.
化合物17 白色针晶 (丙酮).波谱数据与文献[22] 对羟基苯甲酸基本一致.
化合物18 白色结晶 (丙酮).波谱数据与文献[22] 羟基苯甲醛基本一致.
化合物19 白色结晶 (丙酮).波谱数据与文献[23] 对羟基肉桂酸基本一致.
化合物20 白色粉末 (丙酮).波谱数据与文献[24] 1,3,5-三甲氧基苯基本一致.
化合物21 白色针晶 (丙酮).ESI-MSm/z:325.1 [M+Na]+.1H NMR (600 MHz,丙 酮-d6)δ:9.57 (1H,s,4-OH) 7.51 (1H,d,J=8.2 Hz,H-2),7.23(1H,dd,J=8.2,2.2 Hz,H-6),6.92 (1H,d,J=8.2 Hz,H-5),3.52 (3H,s,3-OCH3).13C NMR (150 MHz,丙酮-d6)δ: 125.7 (C-1),112.4 (C-2),149.1 (C-3),153.8(C-4),115.4 (C-5),126.1 (C-6),193.7 (C-7),56.5 (3-OCH3).以上数据与文献[25] vanillil 基本一致.
化合物22 黄色粉末 (丙酮).波谱数据与文献[26] 1-(4-hydroxy-3,5-dimethoxyphenyl) ethanone基本一致.
化合物23 白色粉末 (丙酮).波谱数据与文献[27] 对羟基苯丙酸基本一致.
化合物24 黄色粉末 (甲醇).ESI-MSm/z:265.1 [M+Na]+.1H NMR (DMSO-d6,600 MHz)δ:7.85 (1H,d,J=8.2 Hz,H-5),6.31 (1H,d,J=8.2,2.2 Hz,H-1),6.58 (1H,d,J=2.2 Hz,H-6),6.37 (1H,d,J=2.2 Hz,H-8),6.26 (1H,d,J=2.2 Hz,H-3),3.52(3H,4-OCH3),2.61 (4H,s,H-9,10).13C NMR(DMSO-d6,150 MHz)δ: 108.1 (C-1),161.4 (C-2),99.2 (C-3),158.5 (C-4),130.2 (C-5),115.1 (C-6),156.1 (C-7),113.9 (C-8),31.6 (C-9),29.4 (C-10),140.1 (C-1a),118.3 (C-2a),126.1 (C-3a),148.3 (C-4a),57.2 (4-OCH3).以上数值与Leong 等[28]报道的coelonin 数据基本一致.
化合物25 白色粉末 (甲醇).波谱数据与文献[29] isopropylidenkirenol 基本一致.
化合物26 白色粉末 (甲醇).ESI-MSm/z309.3[M+Na]+.1H NMR (DMSO-d6,600 MHz)δ: 7.62(1H,d,J=8.2 Hz,H-4),7.20 (1H,d,J=8.2 Hz,H-5),6.71 (1H,d,J=8.2 Hz,H-6),6.09 (1H,d,J=8.2 Hz,H-3),5.11 (1H,dd,J=12.0,8.2 Hz,H-2'),3.39 (1H,dd,J=12.0,8.2 Hz,H-3'),3.31 (1H,dd,J=12.0,8.2 Hz,H-3'),1.96 (3H,s,H-4″),1.58 (3H,s,1″-CH3),1.39 (3H,s,1 ″-CH3).13C NMR (DMSO-d6,150 MHz)δ: 74.9 (C-1),156.7 (C-2),112.4 (C-3),145.1(C-4),127.2 (C-5),106.8 (C-6),163.2 (C-7),113.4 (C-8),150.6 (C-9),113.2 (C-10),82.4 (C-1'),90.2 (C-2'),28.1 (C-3').以上数值与Liao 等[30]报道的 libanoridin数据基本一致.
4 抗前列腺炎活性
取8 周龄雄性SD 大鼠90 只,体质量(210±20) g,均来源于平顶山学院医学院实验动物中心,动物合格证号:SYXK(豫)2018~0013.大鼠随机分为正常组、模型组、阳性对照组、锯叶棕果实提取物(TQU)组、化合物组(1~26),每组3 只.参照文献[31]造模,正常组、模型组给予纯化水;阳性组给予舍尼通灌胃,100 mg·kg-1;锯叶棕果实提取物组给予锯叶棕果实水提取物灌胃,300 mg·kg-1;化合物组(1~26),分别给予化合物1~26,200 mg·kg-1.每日1 次,连续14 d.末次给药12 h 后,剥离大鼠前列腺,进行组织匀浆,采用按酶联免疫吸附法检测前列腺组织中IL-1β、IL-6 的水平.结果显示(表1):与模型组比较,化合物8、10、12、14、21、25组前列腺组织中IL-1β水平降低(P<0.05).与模型组比较,化合物5、8、12、25组前列腺组织中IL-6 水平降低(P<0.05).
表1 化合物对大鼠前列腺组织中 IL-1β 和 IL-6 的影响(,n=3)Tab.1 Effects of the compound on IL-1β and IL-6 in rat prostate tissue (x¯±s,n=3)
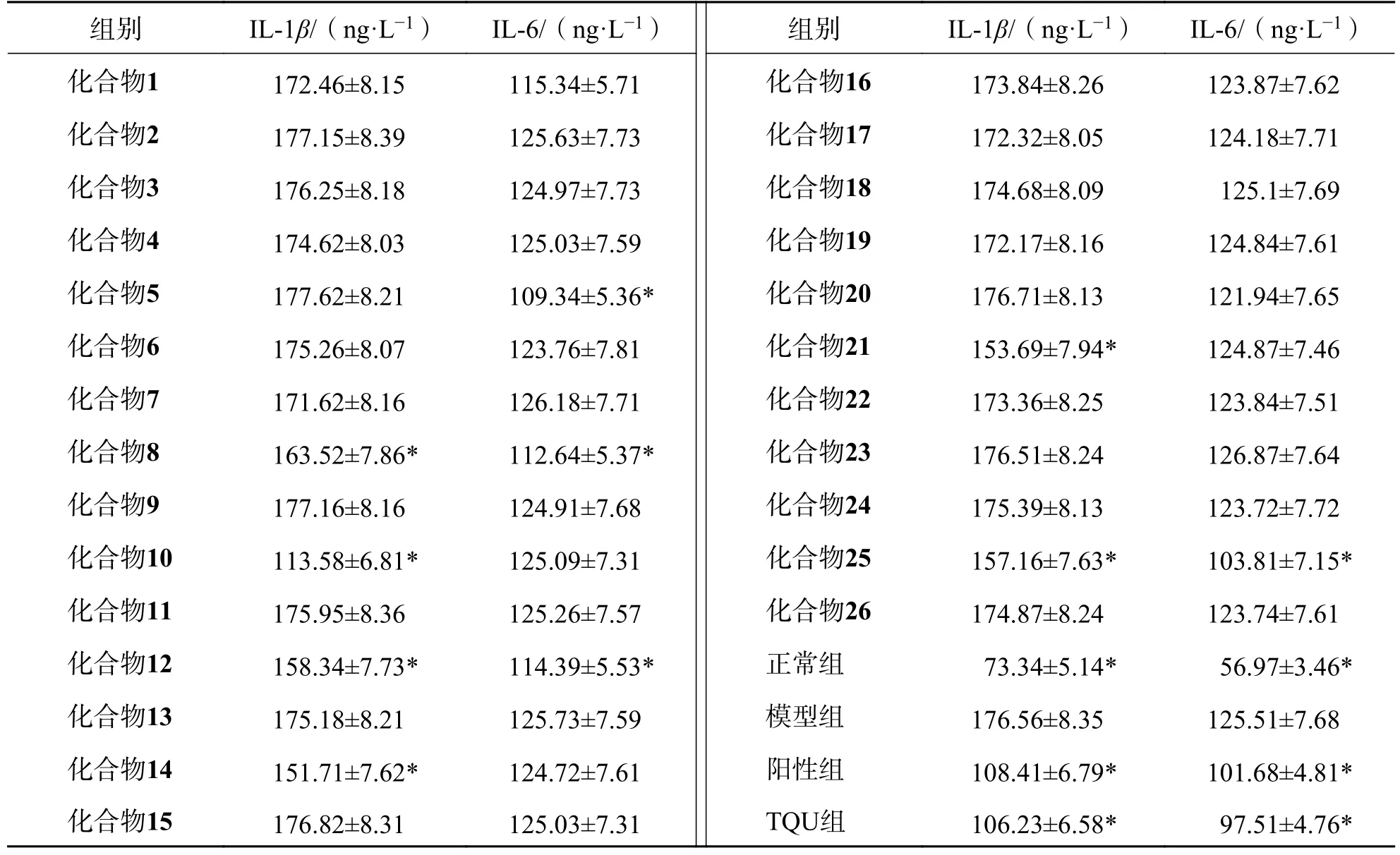
表1 化合物对大鼠前列腺组织中 IL-1β 和 IL-6 的影响(,n=3)Tab.1 Effects of the compound on IL-1β and IL-6 in rat prostate tissue (x¯±s,n=3)
与模型组比较 *P<0.05.
5 讨论
锯叶棕果实为治疗前列腺炎的常用药物,疗效明显[32-35].本研究从锯叶棕果实中分离得26 个化合物,均为首次从锯叶棕果实中分离得到,其中化合物1、5、8、10、12、14、21、22、24、25、26为首次从该属植物中分离得到.对所得化合物的抗前列腺炎活性测试显示:化合物8、10、12、14、21、25对前列腺组织中IL-1β,化合物5、8、12、25对前列腺组织中IL-6 具有抑制作用.本研究结果丰富了锯叶棕果实化学成分的物质基础,对抗前列腺炎活性的新药的研发提供了一定的帮助.
