跨膜蛋白201在肝细胞癌中的表达及其预后意义与作用机制
2024-03-02孙丹费浩然仲成成杨海深司鑫鑫胡伟王仲
孙丹,费浩然,仲成成,杨海深,司鑫鑫,胡伟,王仲
(1.锦州医科大学,辽宁 锦州 121001;2.江苏省连云港市第一人民医院 肝胆外科,江苏 连云港 222001;3.江苏海洋大学药学院,江苏 连云港 222005)
方法:在TIMER中分析TMEM201在泛癌中的表达。下载TCGA与GEO数据库中HCC患者数据,并收集106例HCC患者的手术标本与临床信息,分析TMEM201在肝癌组织与癌旁组织中的表达情况,并绘制生存曲线,分析TMEM201表达与HCC患者的预后关系。用单因素与多因素Cox分析判断HCC相关危险因素。根据TCGA与临床数据,分析TMEM201的表达与HCC患者临床病理特征的关系。应用String和GeneMANIA数据库绘制与TMEM201及其相关基因的网络图谱。通过TCGA数据库分析TMEM201与免疫细胞的关系。通过LinkedOmics数据库分析与TMEM201相关的共表达基因,并对共表达基因进行GO功能分析与KEGG通路预测。
结果:泛癌分析结果显示,TMEM201在绝大部分肿瘤中呈高表达。多数据库及临床HCC标本免疫组化分析显示,TMEM201在HCC组织中的表达明显高于癌旁组织(均P<0.05),且TMEM201高表达患者生存时间明显短于低表达患者。单因素与多因素Cox风险回归提示TMEM201的表达是HCC患者总体生存率的独立危险因素。蛋白质互作网络、GeneMANIA数据库分析显示,TMEM201与SUN1、SUN2、LMNB1、EMD等基因存在明显相互作用。免疫浸润分析结果显示,TMEM201表达与树突状细胞、细胞毒性细胞、Th2细胞等明显有关。此外,功能富集分析显示,TMEM201与共表达基因参与了许多HCC的生物学过程、细胞组成、分子功能和作用通路。通路结果及相关性热图提示TMEM201与细胞周期高度相关。
结论:TMEM201在HCC组织中高表达,是影响HCC患者预后的独立危险因素,TMEM201在HCC中的作用机制可能与免疫浸润的调节、细胞周期的调控有关。
肝癌是常见的消化系统恶性肿瘤,在全球癌症相关死亡中,排名男性第5位,女性第8位[1]。在肝癌分类中,肝细胞癌(hepatocellular carcinoma,HCC)是最常见类型,约占90%[1-2]。尽管近年来对HCC的研究成果不断,治疗有所进展,但因肝癌起病隐匿,发展迅速,仍有绝大部分HCC患者确诊即晚期,导致HCC的治疗仍面临艰巨的挑战。因此,解决HCC治疗难的问题,就首先要研究清楚发生发展机制。
膜蛋白是细胞蛋白质的重要组成部分,其中许多膜蛋白在细胞外环境及细胞质内间传递信息,在一系列生物活动中发挥重要作用。跨膜蛋白(transmembrane protein,TMEM)家族特征性地存在跨膜结构域,参与细胞膜性成分的组成[3]。许多TMEM家族成员作为通道蛋白,允许特定的物质通过生物膜运输,控制跨膜转运。TMEM存在于许多类型的细胞中,并履行重要的生理功能,如表皮角化、自噬、平滑肌收缩、蛋白糖基化以及肝脏的发育和分化[4]。现已观察到TMEM表达的失调与多种肿瘤的发生发展有关,如骨肉瘤[5]、肺癌[6]、胃癌[7]、卵巢癌[8]等。TMEM201是TMEM家族的一员,目前已有研究证明TMEM201与乳腺癌[9-10]相关,而TMEM201在HCC中的作用尚不明确。本研究主要分析了TMEM201在HCC中的表达及其预后的关系,并分析有关的分子机制。
1 材料与方法
1.1 资料收集
在TCGA数据库[11](https://portal.gdc.cancer.gov)、GEO数据库[12](https://www.ncbi.nlm.nih.gov/geo)中搜集关于HCC患者信息,下载TCGA-LIHC、GSE84402、GSE121248数据集,分析TMEM201在HCC中的表达、患者预后等情况。选取2018年5月—2021年4月在江苏省连云港市第一人民医院确诊为HCC的106例患者手术标本与临床信息,患者临床分期按照国际抗癌联盟TNM分期(第8版)[13]标准进行。所有病例术前未进行任何抗肿瘤治疗,本研究通过我院伦理审查(伦理审查意见号:KY20170513001)。
1.2 研究方法
1.2.1 TMEM201在泛癌中的表达 使用TIMER[14]网站Diff Exp版块,Gene Symbol选择TMEM201,即可得到TMEM201在各个癌症中的表达情况。
1.2.2 TMEM201在HCC组织中表达水平和生存预后的分析 使用R语言对TCGA-LIHC、GSE84402、GSE121248数据集进行处理并进行差异分析,应用TCGA临床数据,采用最佳截断值对TMEM201对总生存期(overall survival,OS)和疾病特异性生存期(disease specific survival,DSS)进行分析。
1.2.3 TMEM201与影响HCC预后的因素分析 使用SPSS 25.0软件对TCGA-LIHC数据进行单因素和多因素Cox回归分析,纳入TMEM201基因、患者的年龄、性别、体质量、肿瘤分级、T分期、临床分期,对影响患者预后的可能因素作出解释。并采用χ2检验做出其与临床病理的相关性分析。随后再使用cBioPortal[15]在MSK,Clin Cancer Res 2018、AMC Hepatology 2014、TCGA、Firehose Legacy三个数据库737例HCC患者中分析TMEM201基因的基因组改变对预后的影响。
1.2.4 免疫组织化学检查 手术切除的HCC与癌旁组织(距肿瘤边缘>1 cm)标本进行免疫组化实验验证上述结果。免疫组化评分由2名与本研究无关的病理医师采用双盲法独立评估。通过阳性细胞比率和染色强度进行评分[16-18],阳性细胞比率:<25%为1分,25%~50% 为2分,51%~75%为3分,>75%为4分;染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;将阳性细胞比率和染色强度相乘,阳性细胞率与染色强度之积分为0~4分为TMEM201阴性表达,5~12分为阳性表达。
1.2.5 TMEM201表达量与免疫浸润的关系 采用ssGSEA算法评估24种免疫细胞类型的肿瘤浸润状态,TMEM201表达量与免疫细胞浸润状态、免疫细胞标志物之间的关系采用Spearman相关分析。
1.2.6 TMEM201在HCC中的机制预测 LinkedOmics[19]网站分析与TMEM201相关的共表达基因,并对共表达基因进行GO与KEGG分析,GSEA4.2.2进行单基因富集分析,采用String数据库对TMEM201进行蛋白质相互作用(protein-protein interaction,PPI)网络分析。
1.3 统计学处理
统计分析采用SPSS 25.0软件与R软件。使用R语言中“limma”包进行校正和差异分析,采用Kaplan-Meier法绘制生存曲线;采用Spearman分析基因间相关性,0.1≤|r|≤1.0为存在相关性;SPSS 25.0进行Cox单多因素回归分析,临床病理基线资料表采用χ2分析,P<0.05为差异有统计学意义。
2 结 果
2.1 TMEM201在泛癌及HCC中的表达
TCGA数据库中分析了泛癌中TMEM201的表达,结果表明TMEM201在绝大部分肿瘤中高表达,其中包括HCC(P<0.001)(图1)。此外,TCGALIHC、GSE121248、GSE84402数据集及我院临床样本中,癌组织TMEM201的表达均呈现较高水平(均P<0.05);临床样本免疫组化结果显示,癌组织中阳性表达率为65%(69/106),而癌旁组织阳性表达率仅为11%(12/106)(图2)。

图2 TMEM201在HCC组织与癌旁组织的表达情况 A:TCGA;B:GSE121248;C:GSE84402;D:临床样本;E-F:免疫组化检测TMEM201表达Figure 2 The expression of TMEM201 in HCC tissue and adjacent tissue A: TCGA; B: GSE121248; C: GSE84402; D:Clinical samples; E-F: Immunohistochemical detection of the expression of TMEM201
2.2 TMEM201表达与HCC患者预后的关系
为了研究HCC患者中TMEM201的表达与预后关系,通过TCGA数据库绘制OS、DSS生存曲线,结果显示TMEM201高表达与不良预后有关;我院随访的临床数据使用R语言绘制影响OS、DSS生存曲线,支持上述结论(图3)。
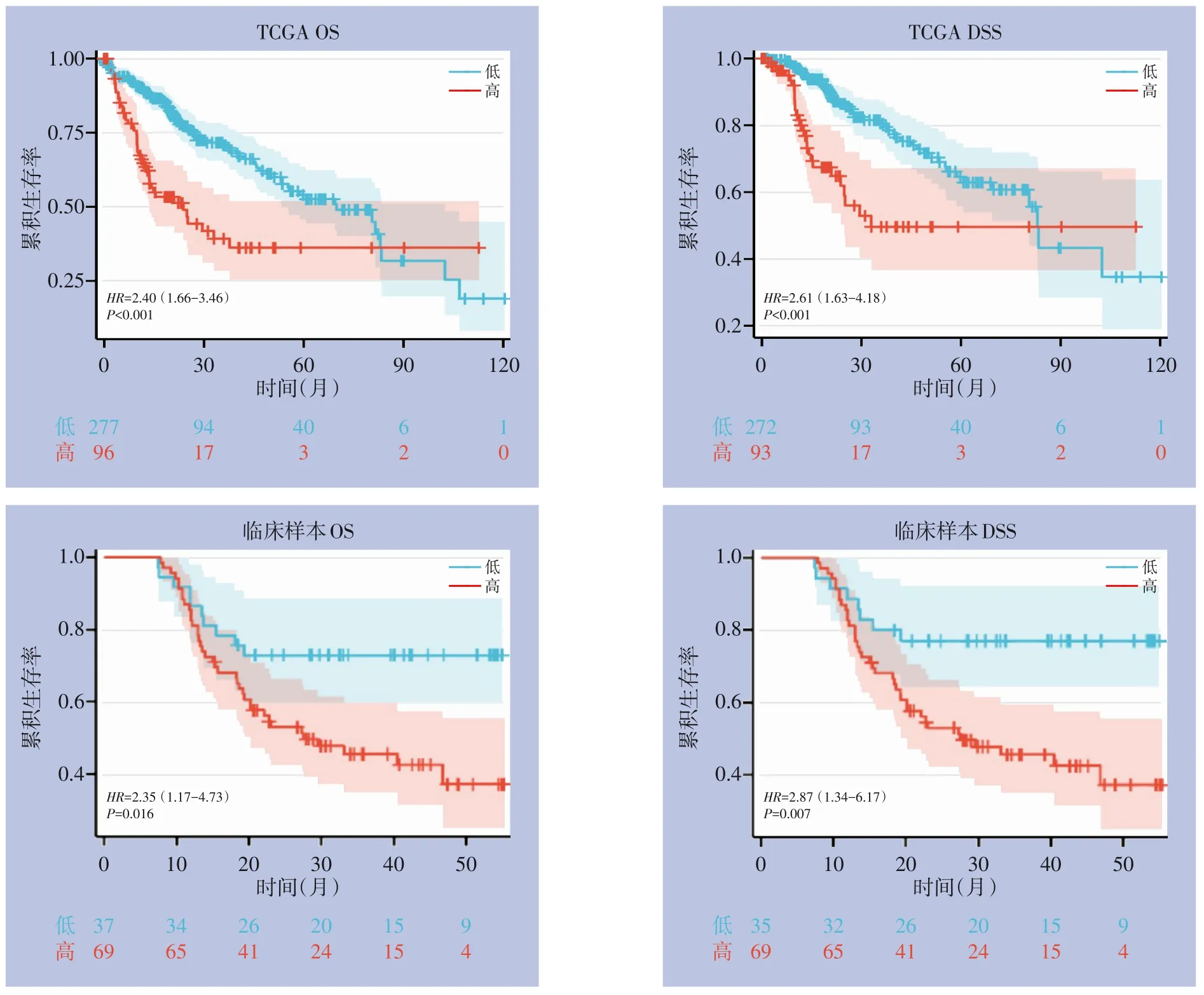
图3 TMEM201表达与OS、DSS的关系Figure 3 The relationship between TMEM201 expression and OS and DSS
2.3 HCC患者OS的危险因素分析
TCGA数据库单因素与多因素Cox回归分析显示,TMEM201的表达、体质量、临床分期、T分期与患者的OS有关(均P<0.05),而年龄、性别、肿瘤分级与HCC预后关系不明显(均P>0.05);将单因素有意义的因子纳入多因素Cox回归分析中,结果表明TMEM201表达是影响HCC患者OS的独立危险因素(HR=2.262,95%CI=1.501~3.410,P<0.001)(表1)。HCC患者的临床病理特征与TMEM201表达量之间分析结果显示,TMEM201表达量的高低在年龄,体质量,肿瘤分级,临床分期,T分期等方面差异有统计学意义(均P<0.05)(表2)。
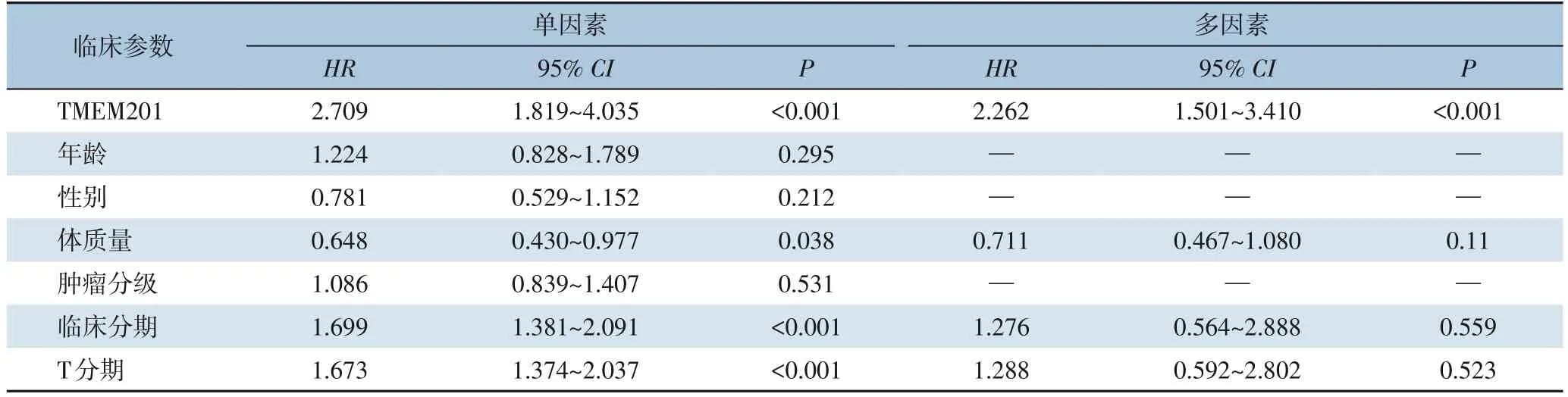
表1 影响HCC患者OS的单因素与多因素Cox回归分析(TCGA数据库)Table 1 Univariate and multivariate Cox Regression analysis of factors influencing OS in HCC patients (TCGA database)
根据临床样本单因素分析结果显示,TMEM201、T分期、临床分期与患者的OS有关(均P<0.05);将单因素分析有意义的结果纳入多因素分析,结果支持TMEM201表达是影响HCC患者预后的独立危险因素(P<0.05)(表3)。同时进行χ2检验分析TMEM201表达量与临床病理的关系,结果显示,T分期、临床分期之间存在明显关系(均P<0.05)(表4)。

表3 影响HCC患者OS的单因素与多因素Cox回归分析(临床病例)Table 3 Univariate and multivariate Cox Regression analysis of factors influencing OS in HCC patients (clinical cases)

表4 TMEM201表达与HCC患者临床病理的关系(临床病例)[n(%)]Table 4 Relationship between TMEM201 expression and clinicopathologic factors in HCC patients (clinical cases) [n (%)]
cBioPortal结果显示,在HCC患者中,仅有2.6%的患者观察到TMEM201基因突变(图4),有无TMEM201基因组改变对患者的OS(P=0.103)、DSS(P=0.576)无明显影响。

图4 TMEM201基因改变与HCC患者生存的关系 A:TMEM201基因改变的OncoPrint总结;B:OS曲线;C:DSS曲线Figure 4 Relationship between TMEM201 gene alterations and survival in HCC patients A: OncoPrint summary of TMEM201 gene alterations; B: OS curve; C: DSS curve
2.4 TMEM201表达水平与HCC组织中免疫细胞浸润的关系
应用ssGSEA算法评价24种[20]免疫细胞在HCC组织中的浸润情况,通过Spearman法分别评估免疫细胞与TMEM201的相关性(图5A)、TMEM201高、低表达组之间免疫浸润结果的差别(图5B)。结果显示,TMEM201与细胞毒性细胞、树突状细胞(dendritic cells,DC)、中性粒细胞、浆细胞样树突状细胞(plasmacytoid DC,pDC)、γδT细胞(T gamma delta,Tgd)、Th17细胞、调节性T细胞(regulatory T cells,TReg)等呈负相关;与CD56(+)NK细胞、辅助T细胞、滤泡辅助性T细胞(T follicular helper,TFH)、Th2细胞等呈正相关。

图5 HCC中免疫细胞浸润与TMEM201表达的关系分析 A:HCC组织中24种免疫细胞浸润水平与TMEM201表达水平的Spearman相关分析结果;B:TMEM201高表达组和低表达组中免疫细胞浸润情况Figure 5 Analysis of the relationship between immune cell infiltration and TMEM201 expression in HCC A: Spearman correlation analysis results of 24 immune cell infiltration levels and TMEM201 expression levels in HCC tissues;B: Immune cell infiltration status in TMEM201 high-expression and low-expression groups
2.5 TMEM201共表达网络及GO、KEGG富集分析
LinkedOmincs在线工具对TCGA-LIHC数据进行分析,分析方法采用Pearson检验,寻找TMEM201的共表达基因(图6)。热图分别显示出与TMEM201前50个正相关、负相关最密切的基因。为了挖掘这些基因在HCC中的作用机制,对TMEM201及上述共表达基因继续进行GO、KEGG分析,GO分析分别对生物过程、细胞成分、分子功能三个方面进行注释。结果显示与DNA复制、细胞周期相关活动、刺激DNA的催化、刺激细胞周期蛋白依赖性蛋白激酶等明显相关。KEGG分析结果发现,TMEM201及其共表达基因在细胞周期通路显著富集。随后应用GSEA4.2.2在GSE84402、GSE121248、TCGA-LIHC数据集进行基因富集分析,同样富集到细胞周期通路(图7A-C)。进一步采用R语言软件绘制TMEM201与细胞周期相关蛋白的相关性,以热图的方式呈现。TMEM201与绝大多数细胞周期相关蛋白呈正相关(图8)。

图6 TMEM201共表达网络及GO功能注释和KEGG信号通路分析 A-C:Pearson检验分析在HCC中TMEM201表达相关的基因;D-F:TMEM201在HCC中表达相关基因GO功能注释;G:TMEM201在HCC中表达相关基因KEGG信号通路分析Figure 6 TMEM201 co-expression network and analysis of GO functional annotation and KEGG signaling pathway analysis A-C: Pearson correlation analysis of genes associated with TMEM201 expression in HCC; D-F: GO functional annotation of genes associated with TMEM201 expression in HCC; G: KEGG signaling pathway analysis of genes associated with TMEM201 expression in HCC

图7 多数据库GSEA富集分析结果 A:GSE84402;B:GSE121248;C:TCGAFigure 7 Multi-database GSEA enrichment analysis results A: GSE84402; B: GSE121248; C: TCGA
2.6 TMEM201的PPI分析
在String数据库中分析与TMEM201相互作用的蛋白,结果显示与TMEM201互作的前20个基因(P<0.001),其中EMD(Emerin)综合得分最高(score=0.999)(图9A)。随后又在GeneMANIA数据库中再次分析(图9B),EMD也在相互作用最强的前20个基因之列。为了进一步分析TMEM201与EMD的关系,利用TCGA数据库分析两者之间的相关性,结果显示TMEM201与EMD正相关(r=0.366,P<0.001)(图9C)。
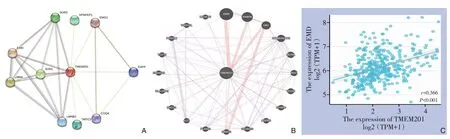
图9 TMEM201的PPI网络 A:String;B:GeneMANIA;C:TMEM201与EMD相关性Figure 9 PPI network of TMEM201 A: String; B: GeneMANIA; C: Correlation of TMEM201 with EMD
3 讨 论
HCC是常见的消化系统恶性肿瘤,约83%病例发生在世界不发达地区,对东亚和东南亚国家的健康构成了极大的威胁[21]。80%~90%的HCC发生在肝硬化的基础上[22],各种原因诱导肝细胞慢性损伤导致肝细胞再生和纤维化的恶性循环,从而增加了HCC发生的风险。HCC发展到晚期前一直处于无症状状态,缺乏监测和早期诊断精度不高是HCC预后差、病死率高的重要原因,如果HCC患者可以早期发现,手术切除可以为其提供良好的预后,这类患者5年OS率可超70%[23],因此,探索与HCC相关的基因及其作用机制不仅有利于HCC的早期诊断和提高HCC患者的预后情况,更有望发展成为新的治疗靶点。
TMEM家族作为一种新发现的蛋白家族,是各种细胞膜的组成部分,如线粒体、内质网、溶酶体和高尔基膜[24]。目前发现TMEM家族有200多个成员,Zhang等[6]通过临床样本和小鼠肺癌模型中证明TMEM116缺失显著抑制PDK1/Akt/FOXO3A信号通路,致使TAp63累积,进而阻碍细胞的生长、迁移、侵袭和转移。Shen等[7]证明敲除TMEM45B通过抑制JAK2/STAT3信号通路,抑制胃癌细胞的增殖、转移和侵袭;另外有研究[25]通过生信分析及生物学功能实验证实了TMEM106C在HCC中过表达,且TMEM106C低表达通过靶向作用CENPM和DLC-1来抑制肿瘤的进一步发展。TMEM201(基因ID:199953)是一种新型的TMEM,包含5个预测的跨膜片段和1个高度保守的含有大量磷酸化位点的C端结构域,这表明其是一种高度保守的蛋白且具有重要的调节功能。研究[10]表明,TMEM201在乳腺癌中表达水平显著升高,并与不良预后相关,RNA测序分析和验证表明TMEM201缺乏通过TGF-β通路抑制了上皮细胞向间质细胞的转变,TMEM201与SMAD2/3相互作用可促进SMAD2/3磷酸化、TGF-β的核转位和转录激活,证明了特异性内核膜成分介导的信号依赖性转录作用促进乳腺癌转移。
本研究基于生物信息学方法,在多数据库中分析TMEM201在HCC组织中的表达情况,结果均提示TMEM201在HCC组织中高表达,通过分析TCGA-LIHC数据发现高表达的患者预后较差,单因素与多因素Cox回归分析发现TMEM201是影响HCC患者总生存期的独立危险因素,TCGA的临床病理分析结果提示TMEM201表达水平与年龄、体质量、肿瘤分级、临床分期、T分期之间的关系非常密切。对TMEM201在HCC的机制研究中发现,其与免疫浸润相关,通路预测中富集到细胞周期通路,基因相关性分析提示TMEM201与细胞周期通路调控正相关。本院临床样本免疫组化实验结果表明TMEM201在HCC组织中高表达,在癌旁组织中低表达,且TMEM201高表达与HCC患者的不良预后有关。单因素与多因素Cox回归分析证实TMEM201是影响HCC患者总生存期的独立危险因素,临床病理分析结果显示TMEM201的表达与T分期、临床分期密切相关,上述研究结果与在TCGA数据库中的研究结果一致。以上结果表明TMEM201在HCC中发挥着重要作用,为HCC提供新的潜在治疗靶点。
肿瘤浸润性免疫细胞几乎存在于所有癌症中,它们可以通过改变肿瘤微环境来改变癌症进展。TMEM家族中TMEM200A在胃癌组织中高表达,具有较好的诊断价值,还可能与免疫细胞浸润,和免疫检查点表达显著相关[26]。TMEM205已被证明在HCC中高表达,并且与多种肿瘤免疫抑制剂负相关[27]。在先前的一项研究中,已有学者[28-29]证明25%的HCC样本中表达了炎症反应的标志物。因此推测TMEM201与HCC的免疫细胞之间也存在联系,生物信息学分析结果发现,TMEM201与多种免疫细胞具有较强的相关性,例如DC[30]、Th17[31]、细胞毒性细胞[32]等具有抗肿瘤作用的免疫细胞与TMEM201表达呈负相关。表明TMEM201可能在HCC免疫调节中抑制免疫系统的抗肿瘤作用,有望成为一个新的免疫治疗靶点。
在本研究中,通过String与GeneMANIA数据库分析相互作用密切的蛋白中,EMD蛋白各项评分均最高。EMD由STA基因编码,其位于Xq28的远端区域,是34 kDa的亲水蛋白,具有疏水区域作为跨膜结构域。它被归类为Ⅱ型整体膜蛋白,其通过膜锚定被动扩散进入细胞核,通过结合A型层蛋白稳定其定位,定位于核膜内/核层[33-34],EMD参与基因表达、细胞信号转导、核和基因组结构的调控等[35]。EMD有22个的磷酸化位点,在有丝分裂中,EMD的磷酸化是细胞周期依赖性的[36]。已有学者[37]证明EMD在HCC中高表达,通过笔者研究发现TMEM201与EMD在PPI中评分最高,且两者正相关,进一步提示两者之间可能存在密不可分的联系。但二者之间在HCC细胞周期调控中如何相互作用等需进一步去研究。
本研究大部分结果仅局限于生物信息学分析,且生物信息学分析的结果需要多数据库进行验证,同时缺少对机制预测的实验验证,需要后期通过实验进一步证实。
综上,以上结果表明TMEM201在HCC中高表达,且高表达的患者预后较差,在机制中可能与免疫浸润的调节及细胞周期的调控相关。有望作为判断HCC预后的标志物,为HCC患者提供潜在的治疗靶点。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:孙丹负责采集及分析数据,文章撰写;费浩然、仲成成、杨海深负责生物信息学和统计分析数据;司鑫鑫负责对文章的知识性内容作批评性审阅及指导;胡伟、王仲负责项目研究经费、审校稿件和指导课题实施。
