腹腔镜胃癌根治术中胃右系膜完整切除的体会
2024-02-29肖海鹏陆艳军钟新强覃吉超
肖海鹏,陆艳军,钟新强,乐 逵,覃吉超
(1.黄冈市中心医院胃肠外科,湖北 黄冈,438000;2.华中科技大学同济医学院附属同济医院胃肠外科)
胃癌是临床常见恶性肿瘤[1],由于非手术治疗不能很好地解决患者预后及生存质量的问题[2-3],手术还是主流治疗方法[4]。D2手术是建立在器官解剖、血管解剖基础上及胃癌四大转移病理基础上的胃癌的标准根治手术,然而其5年生存率及术后局部复发率仍不尽人意。近年基于膜解剖的腹腔镜胃肠道手术得到广泛传播与认可[5],膜解剖手术具有创伤小、微出血、完整切除、局部复发率低、副损伤小等优点[6]。黄冈市中心医院胃肠外科团队自2018年3月开始在武汉同济医院进行了“膜解剖”理论及手术操作的系统学习,手术操作更加标准与规范,2022年3月至2022年12月黄冈市中心医院成功开展了58例基于膜解剖的3D腹腔镜胃癌根治术(远端胃及全胃),疗效满意。现将对胃右系膜切除的体会报道如下。
1 资料与方法
1.1 临床资料
收集2022年3月至2022年12月黄冈中心医院基于膜解剖行3D腹腔镜远端胃及全胃癌根治术的58例患者的临床资料,其中男36例,女22例;42~78岁,平均(59.3±7.2)岁;远端胃17例,全胃41例;术前临床T分期T1期9例、T2期18例、T3期31例。术前均行胃镜及组织活检明确诊断,并常规行胸腹部增强CT、彩超等检查,排除远处转移,术前评估可耐受腹腔镜手术。
1.2 手术步骤
采用全麻气管插管,患者取平卧人字位,采用常规5孔法施术。腹腔镜下探查腹盆腔,了解腹腔转移及肿瘤的局部情况,确定可行腹腔镜手术后,将患者体位调整为头高脚低位。切开胃结肠韧带,见到胃后壁,确认进入网膜囊,操作方向转向右侧,分离大网膜直至结肠肝曲;分离胃网膜右系膜,然后一助左手持钳向胃窦部移动,小弯侧若难以抓持可考虑抓持对应大弯侧,将胃向腹前壁顶起;右手持钳钳夹已游离的十二指肠外侧壁,随主刀分离进程,右手持钳可考虑顶起已分离胃右系膜。主刀用超声刀沿胃十二指肠动脉(gastroduodenal artery,GDA)表面分离,沿十二指肠内侧小弯侧钝性剥离系膜间隙(图1)。主刀沿GDA向肝总动脉分离,至肝总动脉分叉处,左手配合下压肝总动脉分出 GDA处胰腺,术野向肝门方向移动进而沿肝固有动脉表面向肝门处分离胃右系膜,显露并离断胃右静脉及动脉(图2),分离覆盖于肝总动脉及胰腺表面的系膜,并将其完整切除(图3)。其中42例离断十二指肠后,助手将胃及网膜推向左上腹,左手挑肝、右手提拉已分离的胃右系膜,协助主刀显露门静脉并切除胃右系膜(包含但不限于12p组淋巴结);主刀显露门静脉,切除门静脉前方的胃右系膜(图4)。16例离断十二指肠前显露门静脉,切除门静脉前方的胃右系膜。手术均顺利完整游离胃右系膜。
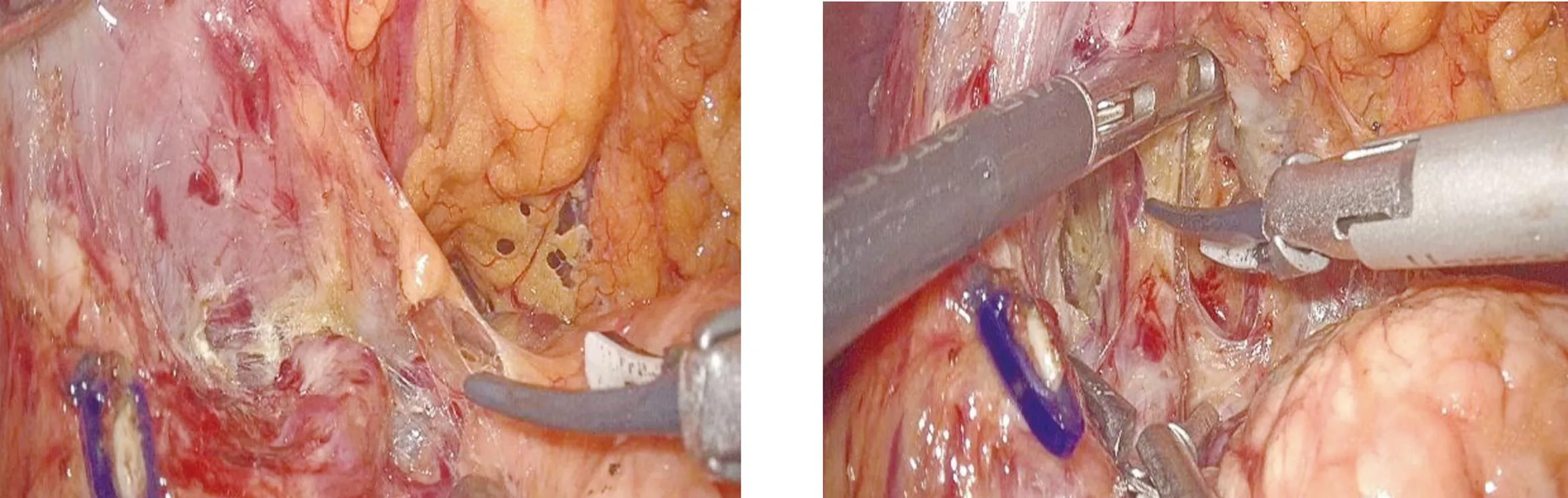
图1 沿GDA表面剥离胃右系膜

图3 分离肝总动脉及胰腺表面的胃右系膜
2 结 果
58例患者均在腹腔镜下成功完成胃右系膜的完整分离、血管离断、淋巴结清扫。分离胃右系膜手术时间平均(20.2±3.6)min,出血量平均(8.0±3.5)mL,胃右系膜平均清扫淋巴结(1.2±0.5)枚。标本病理检查结果显示胃右系膜内淋巴结均为阴性。术后发生1例吻合口出血,1例胃瘫,均经保守治疗后治愈出院,术后病理检查均证实为胃腺癌。
3 讨 论
传统意义上的外科解剖由器官或组织及其血供组成第一、第二元素,龚建平教授于2016年提出了第三元素,即两者都被筋膜与浆膜构成的“信封”所包绕,自此外科解剖由器官、血管的解剖,进入膜解剖,后者包括广义的系膜与系膜床的解剖,也包括构成两者的浆膜与筋膜的解剖[7]。胃系膜由腹侧系膜、背侧系膜两部分组成。龚建平以“桌子模型”提出了胃背侧系膜近侧段理论,以GDA肝动脉、脾动脉主干及其分支前面为界,包括胃网膜右系膜、胃右系膜、胃网膜左系膜、胃左系膜、胃短系膜、胃后系膜共6个系膜[8],胃背侧系膜近侧段的6个系膜可分离,其表面不是筋膜,而是浆膜,其内有相应的血管、淋巴管[9-11]。胃癌根治术也从D2到胃背侧系膜近侧段(6个系膜)完整性的胃切除。按系膜依次切除,我们发现手术操作可达到程序化、规范化,且可复制。在此基础上,胃癌根治术的术中出血量、游离癌细胞泄露比例同步降低,从而降低了手术风险,改善了肿瘤学获益[12-13]。
胃右系膜骑跨在肝十二指肠韧带上,包绕从肝固有动脉发出的胃右血管,系膜的右侧沿肝总动脉向左与胃左血管系膜延续[14]。胃右系膜的分离需紧贴GDA、肝总动脉、肝固有动脉及门静脉等主要血管的表面,稍不注意可能损伤血管,出现大出血,根据胃背侧系膜近侧段模型进行胃癌手术,出血量大幅下降[12,15]。分离胃右系膜时,视野区空间狭小,主刀医生需要具备熟练的操作水平及膜解剖的理解,同时也要求助手能较好地牵拉暴露,才能达到出血少及系膜的完整切除。我们体会,先沿GDA向肝总动脉分离,进而沿肝固有动脉表面向肝门处分离胃右系膜,显露并离断胃右静脉、动脉;助手操作要领为左手持钳向胃窦部移动,小弯侧若难以抓持可考虑抓持对应大弯侧,将胃向腹前壁顶起;右手持钳钳夹已游离的十二指肠外侧壁;随主刀分离进程,右手持钳可考虑顶起已分离胃右系膜;主刀操作要领为沿GDA向肝总动脉解剖,注意辨识肝总动脉发出肝固有动脉GDA分叉处,左手配合下压肝总动脉分出GDA处胰腺,术野向肝门方向移动,寻找胃右血管分出及汇合处,分别或一并结扎离断。离断十二指肠后助手将胃及网膜推向左上腹,左手挑肝,右手提拉已经分离的胃右系膜,协助主刀显露门静脉、切除胃右系膜,主刀继续分离显露门静脉,在门静脉前方切除胃右系膜。
本组58例病例中,42例离断十二指肠后显露门静脉,切除门静脉前方的胃右系膜,离断后可发现视野开阔,操作空间更大,但更容易出血,可能因空间大更容易过度牵拉;16例离断十二指肠前显露门静脉,切除门静脉前方的胃右系膜。离断十二指肠后可由前方分离胃右系膜,也可助手左手挑肝、右手提拉已经分离的胃右系膜,协助主刀从后方分离胃右系膜。从门静脉前方切除胃右系膜时,因胃右系膜骑跨在肝十二指肠韧带上,从后方分离胃右系膜时,助手提拉应恰到好处,过度提拉时容易引起出血,还可能使胆总管向左侧移位引起损伤。个人体会:(1)从后方将胃右系膜抬起分离,较从前方分离能更完整地分离胃右系膜;(2)离断十二指肠前抑或离断后完成门静脉前方胃右系膜的切除各有优势;离断前门静脉前方胃右系膜切除出血少,离断后切除视野开阔;(3)完成门静脉前方胃右系膜切除时应防止过度牵拉导致将胆总管牵拉过来造成胆总管损伤。
胃右系膜因毗邻血管较多且重要,空间狭小,对主刀与助手均提出了更高的要求,但只要按照膜解剖的理念操作可做到操作的程序化与规范化,是安全、可复制的,可以完整切除。
