Al 2 O 3和 B 2 O 3对铝硼硅酸盐玻璃结构和热学性能的影响
2024-02-29青礼平韦奔子凡平文亮陈峰钱奇
青礼平 韦奔 肖 子凡 平文亮 陈峰 钱奇
(1.清远南玻节能新材料有限公司 清远 511650;2.华南理工大学材料科学与工程学院 广州 510640)
0 引言
铝硼硅酸盐玻璃因其具有较好热稳定性、化学稳定性以及优秀的机械性能,被广泛应用于耐热、制药、航空与电子玻璃领域[1-3]。但是其特殊的玻璃组成又导致其生产难度较大,难以通过浮法工艺进行生产[4-5],极大地限制了其应用领域。
在铝硼硅酸盐玻璃组成中,主要组分包括碱金属氧化物、碱土金属氧化物。其中,网络形成体连接组成网络骨架,构建玻璃网络,而网络外体则主要提供游离氧,在玻璃网络结构中起断网作用[6]。因此,对于铝硼硅酸盐玻璃而言,不断地优化组成,合理调整玻璃组成,在不改变其性能的前提下,降低其高温黏度,成为重要的研究内容。在该玻璃体系中,Al2O3与 B2O3成为了比较特殊的存在,两种氧化物在玻璃结构中有多种存在形式:Al2O3可 以形成[AlO4] 、[AlO5]和[AlO6]三种形式,当形成[AlO4]时可以进入玻璃网络结构,而[AlO5]和[AlO6]结构则形成玻璃网络外体[7,8];B2O3在 玻璃中有[BO3]与[BO4]两种结构形式,其中[BO4]可以与[AlO4]和[SiO4]相连进入玻璃网络中,而[BO3]则更多的游离于网络结构外或者是自身富集形成硼氧环[9]。由于Al2O3和 B2O3的特殊性,使得B3+和 Al3+可以形成多种不同配位基团,这类结构基团相对含量变化会显著影响玻璃的性能。
本文研究了Al2O3和 B2O3相 对含量变化对SiO2-Al2O3- B2O3玻璃微观结构的改变,进而对玻璃热学性能的影响规律,为铝硼硅酸盐玻璃的规模化、工业化生产提供帮助。
1 实验
1.1 试剂与材料
铝硼硅酸盐玻璃的化学组成列于表1,其中各玻璃组分中保持Al2O3+ B2O3为14.67%(摩尔分数)值不变。试验所用原料为分析纯的SiO2、MgO、Na2C O3、 Al2O3和 H3B O3。

表1 铝硼硅酸盐玻璃的化学组成(摩尔分数) %
1.2 玻璃样品制备
按表1称取混合料700 g,在陶瓷研钵中充分研磨混合,放入带盖铂坩埚并置于1620 ℃硅钼棒电炉中熔化3 h,搅拌均匀后将玻璃液倒入成型模具中成型。再将成型玻璃移入到马弗炉中退火,退火时先在660 ℃保温2 h,经过10 h降温到200℃,随后断电随炉降温。退火后的玻璃用于性能测试。
1.3 分析和测试
将待测玻璃切割、研磨成3.5 mm×3.5 mm×25 mm的长方形样品。使用DIL 402 Expedis Classic Netzsch型热膨胀仪测量样品在25 ~300 ℃的热膨胀系数,升温速率为5 ℃/min。将待测玻璃样品粉碎为体积较小的块状,将200 g玻璃样品放入150 mL铂金坩埚中,使用Orton RSV 1600型高温旋转黏度计测量玻璃的高温黏度,测量时先升温到1500 ℃,以2 k/min的速率降温,测定1500~1100℃范围内玻璃熔体的黏度。将待测玻璃样品磨成粉末,通过差示扫描量热法(DSC)使用同步热分析仪STA449C-NETZSCH,在N2保护气氛下,以10 ℃·min-1加热速率测定了玻璃化转变温度(Tg)。采用600 MHz超导核磁共振波谱仪测试27A l、11B的化学位移。
2 结果与讨论
2.1 玻璃热学性能
玻璃的转变温度和软化温度是重要的特征温度,转变温度(Tg)为玻璃黏度1012Pa·s时对应的温度,而软化温度(Ts)为玻璃黏度106.65Pa·s对应的温度[10]。
因玻璃黏度测量仅在1500~1100 ℃范围内,无法直接从低温黏度区获得玻璃的Ts温度。为此利用VFT公式中的温度黏度关系:
式中: h 黏度;
T温度;
A,B,T0常数。
依据DSC测量的玻璃Tg温度和玻璃在1500~1100 ℃范围内玻璃熔体的黏度数据,拟合获得大温度范围的黏度-温度关系。图1给出了AB5玻璃拟合曲线,根据这个大温度范围的黏度-温度曲线,可读取黏度为106.65Pa·s时所对应的温度,获得AB5玻璃的Ts温度。对其它玻璃样品进行了同样的拟合可获得相应的Ts值。表2给出了玻璃的热膨胀系数(CTE)、玻璃转变温度和膨胀软化温度。

图1 AB5玻璃大温度范围的黏度-温度拟合曲线
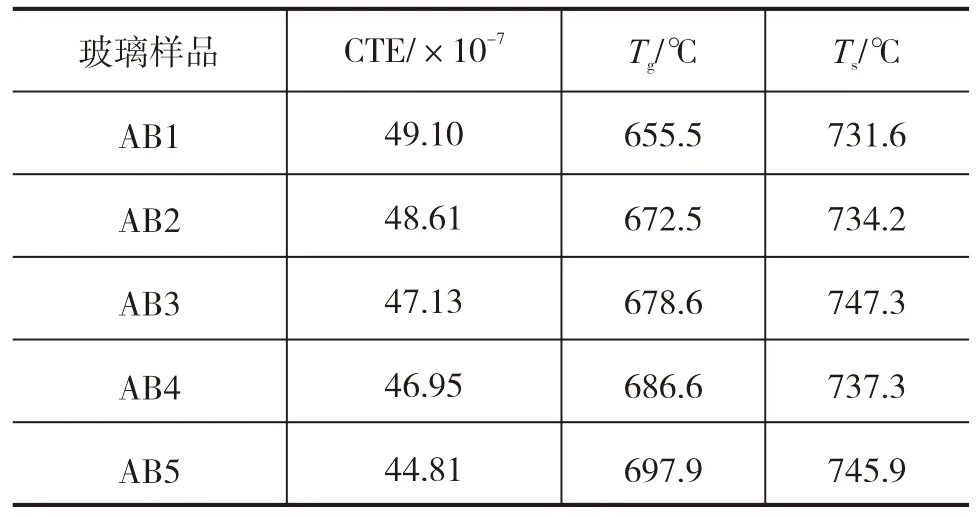
表2 铝硼硅酸盐玻璃的热膨胀系数、转变温度和软化温度
2.2 玻璃结构研究
为了解B3+与 Al3+在玻璃中的存在状态,对上述样品进行核磁共振(NMR)测试,测试参数为:11B核90°脉冲为3.5 μs,化学位移以1 mol的H3B O3溶 液为标 样,定 为19×10-6;27Al核90°脉冲为4.3 μs,化学位移以Al(NO3)为标样,定为0×10-6。图2和图3给出了测量结果。

图2 铝硼硅酸盐玻璃样品的27Al核磁共振谱

图3 玻璃样品的B核磁共
图2(a)~(e)为AB1至AB5玻 璃样品的27A l核磁共振谱。在图2中仅观察到一个50×10-6处共振峰,归属于[AlO4]四面体单元[17],表明该玻璃体系下绝大多数的Al3+都是以四配位形成[AlO4]存在于玻璃结构中。测量了各玻璃Al原子共振峰的半峰宽,展示于图2(f)中。由图2(f)可以发现随Al2O3∶ B2O3比的增加,即随着Al2O3含量的增加,Al原子的NMR谱峰半峰宽在不断增加。基于先前的研究,铝硅酸盐玻璃中铝离子的化学环境不同,共振峰有差异[11]:四配位铝在50×10-6处 有共振峰,五配位铝在30×10-6和六配位铝在0×10-6处也可观察到共振峰。图2(f)显示随着Al2O3含量的增加,Al3+离子周围的半峰宽增加,这个现象应来源于五配位铝和六配位铝含量的增高和二阶四级作用[12],但是高磁场强度的MAS-NMR 能够在一定程度上消除四极作用[12]。 图2中虽然没能直接观察到30×10-6和0×10-6处 存在共振峰,但是50×10-6共振峰的峰形随Al2O3含量的增加而显著变化。图2(a)中的峰基本上成对称形,而随Al2O3含量增加峰的对称性逐渐破坏,到图2(e)可清晰看到峰的左侧线高于右侧线,这表明玻璃中存在少量的五配位[AlO5]和六配位铝[AlO6]结构单元。图2中峰形和峰宽的变化表明,随玻璃中Al2O3含量的增加,玻璃五配位[AlO5]和六配位铝[AlO6]结构单元逐渐增多。
图3(a)至(e)给出了玻璃样品的11B核磁共振谱。每个图中均出现2个共振峰,反映了B3+离子在不同化学环境下的化学位移。两个峰中10×10-6处 峰为三配位[BO3]的共振信号,0×10-6处峰为硼氧四面体[BO4]的共振信号[18]。由图3可观察到,在该玻璃体系中绝大多数的B3+会形成三配位硼,以[BO3]结构存在,而只有少量的B3+会形成四配位的[BO4],进入玻璃网络。利用分峰和标准线性模拟方法[13],可计算出玻璃样品中的[BO3]和[BO4]的比列并列于表3中。
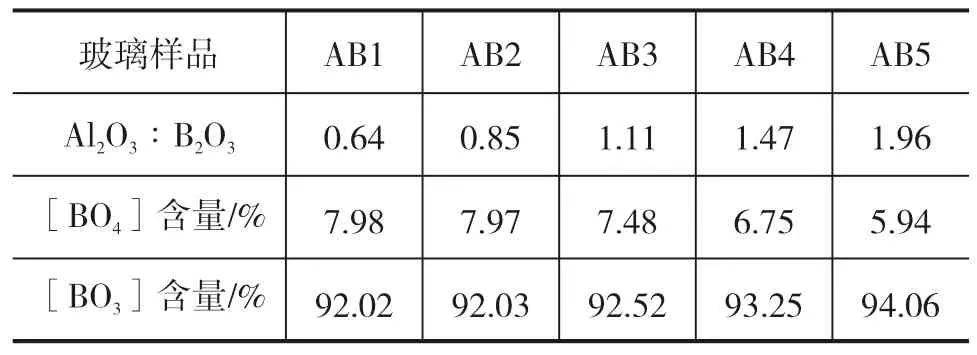
表3 玻璃中四配位硼结构[BO 4]和三配位硼结构[BO 3]含量
从表3可以看出,[BO3]结构基团数量随玻璃中Al2O3∶ B2O3的增加而轻微增大,从92.02%增加到94.06%,而[BO4]结构基团数量相应减少,从7.98%降低到5.94%。因[BO4]结构是进入玻璃网络起网络形成体作用,而[BO3]结构单元不能在玻璃中形成三维网络,表明随玻璃Al2O3含量的增加,玻璃中进入了玻璃网络的硼离子有所减少。
尽管玻璃中[BO4]中B-O单键能为372 kJ/mol,大于[AlO4]结构中Al-O键280 kJ/mol的单键能[19],但是由于[BO4]体积小,O2-排斥力较强,且该体系玻璃结构中存在较多的高场强网络外体阳离子,不利于形成稳定的四配位结构,并且Al3+核 电荷数比B3+大,与游离氧的结合能力更强。因此,在铝硼硅酸盐玻璃中,随Al2O3∶B2O3比的增加,结构中的游离氧会优先与Al3+结合形成更多的[AlO4]进入玻璃网络,同时逐渐形成少量五配位铝[AlO5]和六配位铝[AlO6]结构单元,少量的游离氧才会与B3+结合成[BO4],其余B3+离子则形成[BO3]。在宏观上表现为玻璃的热膨胀系数降低,玻璃转变温度升高以及膨胀软化点增加,如同表2所展示的规律。
3 结论
在铝硼硅玻璃体系中,随着Al2O3∶ B2O3比的增加,玻璃的热膨胀系数降低,玻璃转变温度和玻璃软化温度均增加,这些性能变化关系到玻璃的微观结构。通过核磁共振谱发现,在铝硼硅酸盐玻璃中,Al2O3主要作为网络形成体,形成[AlO4]进入玻璃网络结构,从而增强玻璃结构的紧密性;随Al2O3含量增加玻璃中出现少量五配位[AlO5]和六配位铝[AlO6]结构单元。玻璃中的B3+离子主要作为网络外体以[BO3]存在,随玻璃中Al2O3含 量的增加,而[BO4]结构基团数量减少,从7.98%降低到5.94%。玻璃性能随Al2O3∶ B2O3比增加而改变,起源于玻璃中网络外体[AlO4]、[AlO5]、[AlO6]、[BO4]和[BO3]结构单元数量的变化。
