耳迷走神经电刺激治疗多囊卵巢综合征患者负性情绪的临床观察*
2024-02-28张世科何慧王宇孙嘉婧莫潇林刘晶于淑雪朱婧锦梁杏高维滨
张世科,何慧,王宇,孙嘉婧,莫潇林,刘晶,于淑雪,朱婧锦,梁杏,高维滨
(1.深圳市盐田区人民医院康复医学科,深圳 518081;2.南方科技大学盐田医院康复医学科,深圳 518081;3.黑龙江中医药大学附属第一医院中医妇科,哈尔滨 150040;4.黑龙江中医药大学,哈尔滨 150006;5.黑龙江中医药大学附属第二医院全国名老中医药专家传承工作室,哈尔滨 150001)
多囊卵巢综合征(PCOS)的发病率为5%~10%[1],是引起继发性闭经和无排卵性不孕的主要原因,严重影响妇女身心健康。PCOS 尚缺乏根治方法,临床治疗多以生活方式干预或应用糖皮质激素、促排卵药物等控制为主,但长期服药容易引起肝肾损伤等不良反应[2]。PCOS 不仅影响女性生殖内分泌功能,且易诱发严重的远期并发症并导致抑郁或焦虑等负性情绪,给患者造成长期的身体与精神负担[3]。PCOS 患者更易出现抑郁、焦虑等问题[4],情绪障碍是PCOS 研究的新兴热点。但目前对PCOS 患者心理状态的治疗却鲜有关注,临床迫切需要寻找安全有效的治疗方法,而中医药疗法成为一个重点探讨方向[5]。中医认为PCOS 符合“肾-天癸-冲任-胞宫”的生殖脏象理论,现代医家认为其与下丘脑-垂体-卵巢(HPO)轴理论相符[6],而针灸治疗PCOS 的作用机制与调整HPO 轴密切相关[7]。耳迷走神经电刺激在改善负性情绪方面发挥了显著优势,笔者基于电刺激耳迷走神经能够调整下丘脑功能的理论基础,尝试研究经皮电刺激耳迷走神经治疗PCOS 的积极作用[8-9]。国际普遍将生活方式干预作为PCOS 患者的一线治疗方案[10],课题组采用生活方式干预联合耳迷走神经电刺激疗法治疗PCOS 患者,且与单独的生活方式干预进行比较,观察疗效并初步探讨其作用机制。
1 资料与方法
1.1 一般资料 选取2021年11月—2022年11月于深圳市盐田区人民医院收治的60 例PCOS 患者,根据不同治疗方案,采用随机数字表法分为耳迷走神经电刺激+生活方式干预组(电刺激组)与生活方式干预组(对照组)。电刺激组30 例患者,年龄20~37 岁,平均年龄(28.99±3.58)岁;病程6 个月~4年,平均病程(2.20±0.35)年;平均体质量(64.85±9.50)kg。对照组30 例患者,年龄21~38 岁,平均年龄(29.59±3.76)岁;病程7 个月~5年,平均病程(2.47±0.50)年;平均体质量(65.50±8.90)kg。两组PCOS 患者在一般资料方面比较,差异无统计学意义(P>0.05),具有可比性。
本研究已经获得深圳市盐田区人民医院伦理委员会批准(伦理批号:YY20211106)。电脑随机数由独立调查员生成,并保存在密封的不透明信封中。当符合条件的患者被纳入时,由未实施盲法的医生按照信封上的编号顺序查看其随机分配的小组,并为患者分配治疗师及针灸医生,对专门进行治疗前后量表评估的治疗师实施盲法,由治疗师对所有患者进行生活方式干预,独立的针灸医生对电刺激组患者进行针灸治疗。
1.2 病例选择
1.2.1 诊断标准 依据指南制定PCOS 诊断标准[11-12]。1)必要条件:月经稀发、闭经或不规则子宫出血。2)①痤疮、多毛等高雄激素的临床体征或实验室生化检查提示高雄激素血症;②超声检查提示单侧或双侧卵巢直径2~9 mm 的窦状卵泡≥12 个和(或)卵巢体积≥10 mL。在满足必要条件后,以上两点符合其一即可诊断。
1.2.2 纳入标准 1)年龄20~40 岁。2)符合上述PCOS 的诊断标准。3)肝郁证候评分≥3 分。4)焦虑自评量表(SAS)评分、抑郁自评量表(SDS)评分达到轻度或以上。5)近1年内无生育愿望且无需要进行不孕治疗的计划。6)自愿参加本次研究并签署知情同意书。
1.2.3 排除标准 1)其他可能引起高雄激素和导致排卵异常的疾病。2)合并其他内分泌系统疾病等导致的无排卵性月经失调。3)合并内科、外科严重原发性疾病或伴有恶质性病变。4)近3 个月服用过抗抑郁/焦虑类药物或糖皮质激素类药物、糖代谢调节类药物。5)合并严重躯体疾病而无法配合针刺干预。6)具有严重精神障碍或认知障碍等而难以有效沟通。
1.2.4 剔除、脱落、中止标准 1)未按照规定治疗或资料不全等影响疗效评价。2)发生严重不良事件或不能耐受治疗而被中止试验。3)试验期间检查确定妊娠。
1.3 治疗方法 两组停经3 个月以上的患者,均给予炔雌醇环丙孕酮片(简称达英-35,拜耳医药保健有限公司,国药准字HJ20210029)口服,每次1 片(规格:每片含醋酸环丙孕酮2 mg、炔雌醇0.035 mg),每日1 次,于自然月经或撤退性出血的第5 天开始,连续服用21 d,停药待月经来潮后进入治疗周期。
1.3.1 对照组 予生活方式干预,参照文献制定该方案[13]。饮食指导:改变膳食结构和食量,禁止油炸食品、高脂高糖饮食、快餐饮料等,每日减少500~1 000 kcal 食物摄入(早餐以碳水化物为主者改为牛奶或无糖豆浆,午餐饮食如常,晚餐主食量减半,其他时间饥饿可以增加青瓜、西红柿、苹果、绿色蔬菜等,禁止增加面包或糖果等);运动指导:每日至少完成30~40 min 规律有氧运动(心率>120 次/min),运动速度大于6 km/h,每次运动时间多于10 min,记录为1 次运动量,每日运动量>3 次[跑步运动者以手机软件监测,每次跑步持续10 min 以上且距离>1 km,累计大于3 次(或者满足每日30 min 以上且距离>3 km,监测数据每日汇报给医生进行统计)]。
1.3.2 电刺激组 在对照组治疗基础上予耳迷走神经电刺激疗法。操作:参照参考文献[14],患者取仰卧位,在双侧耳甲区各选取2 个点,常规消毒,选用0.20 mm×25 mm 的一次性针灸针,斜刺2~3 mm,连接KWD-808Ⅱ型电针仪(常州英迪电子医疗器械有限公司),每侧耳甲区连接1 组导线,设置为疏波(2 Hz)、电流0.5 mA,以患者能耐受为宜,2 d 治疗1 次,每次30 min,每周治疗3 次,1 个月为1 个疗程,连续治疗3 个疗程。
1.4 观察指标
1.4.1 量表评分 患者治疗前后完成SAS[15]及SDS[16]评分,客观评估患者抑郁和焦虑状态。SAS 和SDS均有20 个条目,每个条目的评分为1(很少)、2(有时)、3(经常)、4(总是)分,其中SAS 的第5、9、13、17、19 个条目为反序计分,SDS 的第2、5、6、11、12、14、16、17、18、20 个条目为反序计分,将SAS 或SDS中全部问题的得分相加,得到1 个最低20 分、最高80 分的原始分数,然后将其转换为标准分数。SDS 的标准分数(SDS-SS)或SAS 的标准分数(SAS-SS)等于原始分数×1.25(结果取四舍五入至最近的整数)。在中国,SAS-SS≥50 分被认为焦虑,50~59 分为轻度,60~69 分为中度,≥70 分为重度[15]。对中国人群而言,SDS-SS≥53 分为抑郁样状态,53~62 分为轻度,63~72 分为中度,≥73 分为重度[17]。
1.4.2 中医症状评分 参照国家标准《中医临床诊疗术语:证候部分》[18]:1)情志抑郁。2)太息时作。3)胸胁胀满不适。4)少腹胀闷窜痛。5)女性患者月经前乳房胀痛。6)女性患者月经前情志失常。7)脉弦。每1 项分为无症状、轻度、中度、重度4 级,评分为0~3 分,所得总分为该患者的中医症状评分。
1.4.3 体质量指数(BMI) 患者治疗前后由同1 名记录者在固定时间记录体质量、身高并计算BMI,BMI=体质量(kg)/身高(m)2。
1.4.4 血糖代谢指标 患者治疗前后空腹抽取肘静脉血2 mL,检测空腹胰岛素(FINS)、空腹血糖(FBG),并计算稳态模型胰岛素抵抗指数(HOMAIR)[19],HOMA-IR=FBG(mmol/L)×FINS(mmol/L)÷22.5。
1.4.5 炎症因子 患者治疗前后空腹抽取肘静脉血2 mL,在离心半径8 cm、3 000 r/min 条件下离心10 min,取上清液,采用酶联免疫吸附法检测患者血清白细胞介素(IL)-1、IL-6 和肿瘤坏死因子-α(TNF-α)水平[20]。
1.5 统计学方法 使用SPSS 21.0 软件进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,组内不同时间点的比较采用重复测量方差分析,组间同一时间点的比较采用两独立样本t检验;非正态分布的计量资料比较采用Mann-WhitneyU检验,组内不同时间点的比较采用Friedman 秩和检验。计数资料以例数及百分率(%)表示,组间比较采用卡方检验,P<0.05 为差异有统计学意义。
2 结果
2.1 SAS、SDS 评分比较 治疗前,两组患者的SAS、SDS 评分比较,差异无统计学意义(P>0.05)。治疗后,电刺激组患者SAS、SDS 评分较治疗前降低(P<0.05);对照组患者SAS、SDS 评分较治疗前降低,但差异无统计学意义(P>0.05);电刺激组患者SAS、SDS 评分低于对照组(P<0.05)。见表1。
表1 两组患者SAS 和SDS 评分比较(±s)分

表1 两组患者SAS 和SDS 评分比较(±s)分
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别例数SAS 评分SDS 评分治疗前治疗后治疗前治疗后对照组30 61.20±3.14 58.50±2.0159.32±2.98 55.50±3.45电刺激组 30 60.97±3.20 46.10±1.56*# 58.50±2.70 44.26±3.73*#
2.2 中医症状评分比较 治疗前,两组患者的中医症状评分比较,差异无统计学意义(P>0.05)。治疗后,电刺激组患者的中医症状评分较治疗前降低(P<0.05);对照组患者的中医症状评分较治疗前降低(P<0.05);电刺激组患者的中医症状评分低于对照组(P<0.05)。见表2。
表2 两组患者中医症状评分比较(±s)分

表2 两组患者中医症状评分比较(±s)分
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别例数治疗前治疗后对照组3011.87±2.317.76±1.39*电刺激组3012.30±2.404.88±1.56*#
2.3 BMI 比较 治疗前,两组患者BMI 比较,差异无统计学意义(P>0.05)。治疗后,两组患者BMI 较治疗前下降(P<0.05);电刺激组患者BMI 低于对照组,但差异无统计学意义(P>0.05)。见表3。
表3 两组患者BMI 比较(±s)kg/m2

表3 两组患者BMI 比较(±s)kg/m2
注:与本组治疗前比较,*P<0.05。
组别例数治疗前治疗后对照组3026.21±3.2524.28±1.98*电刺激组3026.06±3.0823.56±2.26*
2.4 糖代谢水平比较 治疗前,两组患者FBG、FINS、HOMA-IR 比较,差异无统计学意义(P>0.05)。治疗后,两组患者FBG、FINS、HOMA-IR 较治疗前下降(P<0.05);电刺激组患者FBG、FINS、HOMA-IR 低于对照组(P<0.05)。见表4。
表4 两组患者糖代谢水平比较(±s)

表4 两组患者糖代谢水平比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别 例数时间节点FPG(mmol/L)FINS(mmol/L) HOMA-IR对照组30 治疗前 8.40±1.807.70±1.523.91±1.96 30 治疗后 7.50±2.30*6.20±1.10* 3.32±1.65*电刺激组 30 治疗前 8.50±1.707.67±1.794.08±1.93 30 治疗后 7.10±1.50*#5.02±1.00*# 2.16±1.34*#
2.5 炎症因子水平比较 治疗前,两组患者IL-1、IL-6、TNF-α 比较,差异无统计学意义(P>0.05)。治疗后,电刺激组患者IL-1、IL-6、TNF-α 较治疗前降低(P<0.05);对照组患者IL-1、IL-6、TNF-α 较治疗前降低,但差异无统计学意义(P>0.05);电刺激组患者IL-1、IL-6、TNF-α 低于对照组(P<0.05)。见表5。
表5 两组患者炎症因子水平比较(±s)ng/L
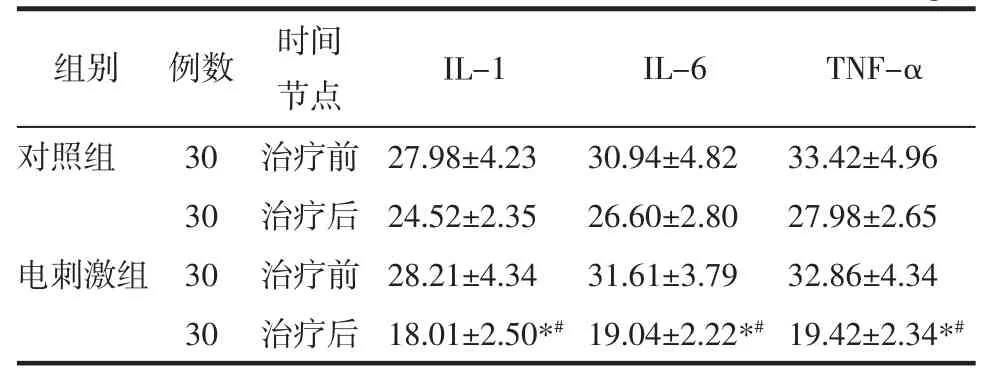
表5 两组患者炎症因子水平比较(±s)ng/L
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别 例数时间节点IL-1IL-6TNF-α对照组30 治疗前 27.98±4.2330.94±4.8233.42±4.96 30 治疗后 24.52±2.3526.60±2.8027.98±2.65电刺激组 30 治疗前 28.21±4.3431.61±3.7932.86±4.34 30 治疗后 18.01±2.50*# 19.04±2.22*# 19.42±2.34*#
2.6 两组患者不良反应情况 治疗期间,两组患者均未出现明显不良反应,电刺激组采用耳迷走神经电刺激疗法的不良反应主要为3 例患者拔针后皮下少量出血,经局部按压处理后好转,部分患者针后偶感耳甲区刺痛,可忍受,无逃避反应,无耳鸣、耳聋等不适发生。
3 讨论
国外报道约21%~40%的PCOS 患者出现抑郁状态,35%左右的PCOS 患者出现焦虑状态[21]。国内报道PCOS 患者出现抑郁状态的约为27%,出现焦虑状态的约为15%,其中14%~44.4%的患者兼具抑郁和焦虑症状[22]。1 项研究指出PCOS 患者比健康人群更容易罹患抑郁症及焦虑症,PCOS 是这两种心理疾病的危险因素[23]。PCOS 患者的抑郁及焦虑评分多处于轻中度状态,因此重视PCOS 患者的负性情绪十分必要,尤其是需要根据其发病机制选择适宜的对症治疗技术。
PCOS 的发病主要集中在女性生育期,《素问·病机气宜保命集》中记载“妇人童幼……天癸既行,皆从厥阴论之……”叶天士在《临证指南医案》中言“女人以肝为先天也”,《胎产指南·调经章》述“女子之性,执拗偏急,愤怒妒忌,以伤肝气”。因此,育龄期妇女更以“肝气”为病最多,一则肝主情志,“妇人经水不调,多因气郁所致”,二则盼子心切出现烦躁焦虑,肝郁不舒,冲任失和。古代中医无PCOS 的具体病名,以疏肝调气为其主要治疗原则,可促进胞脉气血运行。耳迷走神经在耳甲区有唯一的体表分布,耳甲区的耳穴有肝、内分泌、交感穴等可以调节情绪的耳穴,刺激此处使得PCOS 患者肝气得疏,气血、冲任调畅,则病可愈。
焦虑的发病机制之一即神经内分泌功能紊乱,以下丘脑-垂体-肾上腺(HPA)轴等释放的激素异常为主[24],HPA 轴异常也被认为是抑郁症发病的另一机制[25],提示PCOS 患者的HPA 轴紊乱可能增加其产生焦虑或抑郁的风险。PCOS 受HPO 轴及HPA 轴的支配调节,笔者认为经皮耳迷走神经电刺激可能经“耳迷走神经-孤束核-下丘脑”调节HPA 轴和HPO 轴,而对PCOS 起到治疗作用[8-9]。精神障碍通常与自主神经功能紊乱有关,Stener 等[26]研究发现交感神经的兴奋性与PCOS 存在一定关联,且可以通过低频电针刺激降低其兴奋性。迷走神经作为副交感神经,刺激迷走神经可以起到抑制交感神经兴奋性的作用,因此猜测耳迷走神经电刺激改善PCOS 患者负性情绪的作用机制可能与改善PCOS 患者自主神经功能紊乱有关。
肥胖是PCOS 患者常见的代谢紊乱症状之一,人们对与肥胖相关的健康风险研究越来越多。Pastore 等[27]指出肥胖PCOS 患者抑郁症的发生率和严重程度均显著高于正常体质量的PCOS 患者,BMI 是影响PCOS 女性抑郁症的主要因素之一。研究证实PCOS 组焦虑、抑郁状态与BMI 显著相关,表明BMI 对PCOS 不孕患者的身心产生影响[28-29]。肥胖大鼠的即刻早期反应蛋白c-Fos,在进食后迷走神经传入信号整合的第1 个中心部位孤束核的中央区和尾侧较瘦鼠显著降低,表明肥胖与迷走神经传入信号的减少有关[30]。其次,肥胖的发生多伴随迷走神经传入神经元对周围信号的敏感性下降,刺激迷走神经也被证实能够治疗中重度肥胖[31]。本研究还发现耳迷走神经电刺激对降低PCOS 患者BMI效果优于对照组,但差异无统计学意义,可能与样本量较小有关,下一步可以通过大样本研究进一步验证。
Franks 等[32]证实胰岛素抵抗在PCOS 女性的姐妹中具有可遗传特性,是发生PCOS 的原因之一。田国华等[28]研究发现PCOS 患者焦虑、抑郁状态与HOMA-IR 显著相关,HOMA-IR 是影响其发生的重要因素。Ahren 等[33]研究证实副交感神经系统能够调节胰腺分泌胰岛素的第1 个峰值,而迷走神经则是副交感神经系统的主要组成部分。临床研究证实耳甲电针可以显著降低糖耐量受损患者的FBG 及餐后2 h 血糖[34],还能够改善胰岛素抵抗状态[35]。经皮耳迷走神经刺激可以明显改善Zucker 糖尿病大鼠的血清胰岛素浓度[36]。本研究中,耳迷走神经电刺激明显改善了PCOS 患者的FINS、FBG 及HOMAIR,认为耳迷走神经电刺激除能够改善PCOS 患者负性情绪外,还可以改善PCOS 患者的FINS、FBG及HOMA-IR。
2001年Kelly 等[37]首次发现PCOS 患者处于低度慢性炎症状态,Spritzer 等[38]研究证实PCOS 患者血液及卵巢内长期存在较高炎症水平。李昕[22]指出低度慢性炎症状态对PCOS 患者的情绪障碍产生重要影响,炎症因子表达异常与抑郁症、焦虑症的发病高度相关。PCOS 患者长期处于“代谢性炎症”状态,血清炎症水平与胰岛素抵抗呈正相关[39]。对一些因重度抑郁自杀的患者进行检查,发现其TNF-α、IL-6 和IL-1β 表达显著升高[40]。抗抑郁药物能够降低抑郁症患者血清中TNF-α、IL-1β、IL-6 水平,并使抑郁状态得到改善[41]。自此,慢性低级别炎症被广泛认为是PCOS 的发病途径之一,激活抗炎通路可能为PCOS 提供新的治疗靶点。自20世纪90年代末以来,迷走神经一直被认为是抗炎调节通路的核心部分,迷走神经的抗炎功能是通过胆碱能抗炎途径(ChAP)和HPA 轴实现的[42]。在本研究中,耳迷走神经电刺激能够明显降低PCOS 患者血清炎症因子(IL-1、IL-6、TNF-α)水平,认为耳迷走神经电刺激除能够改善PCOS 患者焦虑、抑郁等负性情绪外,还可以改善PCOS 患者的血清炎症因子。
社会的发展导致疾病谱不断发生变化,借助西医关于疾病的病因认识来创新研究中医新治疗技术,可以更好地使患者获益[43]。杨红等[44]认为PCOS的病因与长期处于慢性炎症状态相关,其中IL-6 与PCOS 患者体内的亚临床炎症状态关系最为密切。Zhuang 等[45]发现PCOS 患者体内的IL-6 可以通过调控蛋白激酶B(AKT)/信号转导和转录激活因子3(STAT3)信号通路,调节脂肪细胞增殖,从而引起肥胖与代谢异常[46]。肥胖可以进一步诱发胰岛素抵抗,同时,IL-6 可以通过调节胰岛素受体底物-1(IRS-1)抑制胰岛素信号通路,诱导胰岛素抵抗的发生[47]。胰岛素抵抗可以代偿性引起高胰岛素血症,继而引发PCOS[48]。下丘脑具有内分泌和自主神经调节功能,下丘脑炎症是PCOS 最主要的中枢神经特征性改变[48]。肥胖不仅会在下丘脑引发炎症,还会在大脑的其他区域引发炎症,从而影响情绪。此外,炎性细胞因子水平的增加可以影响HPA 轴功能,HPA 轴在情绪等方面起重要作用。目前的研究发现迷走神经是可以调节下丘脑的外周神经,因此,从刺激迷走神经方面着手研究针刺治疗PCOS 等疾病是可行的。
综上所述,耳迷走神经电刺激可以明显改善PCOS 患者的焦虑和抑郁状态,还可能改善糖代谢及炎症反应,值得进一步研究。
