HPLC 指纹图谱结合化学模式识别和多成分定量不同产地甘松的质量评价
2024-02-28王姿杨邢耀莹付文芮邓小斌崔治家
王姿杨 ,邢耀莹 ,付文芮 ,王 露 ,邓小斌 ,庞 哲 ,崔治家 *,邵 晶 ,
1. 甘肃中医药大学药学院,甘肃 兰州 730000
2. 西北中藏药省部共建协同创新中心,甘肃 兰州 730000
3. 甘肃省高校中(藏)药化学与质量研究省级重点实验室,甘肃 兰州 730000
4. 甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000
甘松NardostachyosRadixet Rhizoma 为败酱科植物甘松NardostachysjatamansiDC.的干燥根及根茎,是我国应用历史悠久的传统中药及藏药,在阿育吠陀和乌纳尼医学体系中也一直用于治疗各种疾病。最早记载于唐代陈藏器所著的药学专著《本草拾遗》中。甘松性辛、甘,温;归脾、胃经;具有理气止痛、开郁醒脾、外用祛湿消肿的功效。临床上常用于治疗脘腹胀满、食欲不振、呕吐;外用治疗牙痛、脚气肿毒[1]。甘松中含有萜类、黄酮类、醌类、糖类、香豆素类、木脂素类等成分[2-6]。现代药理研究表明,甘松具有抗心律失常、抗氧化、抑菌、抗炎、抗疟、抗抑郁、降血压、镇静、抗癫痫、保护心肌细胞等多种生物活性[7-18]。
我国甘松药材以野生为主,主要分布在西藏、四川、甘肃、青海等省份[19]。由于采收、加工、储藏等环节的不规范性,导致市场甘松药材质量差异较大,且常掺杂有其他植物干燥根及根茎,有时难以识别,《中国药典》2020 年版对甘松质量评价以挥发油和甘松新酮含量为指标,文献研究多以挥发油、甘松新酮、绿原酸和蒙花苷等作为指标性成分对甘松药材进行质量控制[20],另有文献研究丁香酸、马兜铃酮同样作为甘松药材的化学成分[21-22],分别具有抗肺癌药理作用[23]、杀伤癌细胞作用[24]。本课题组前期开展的基于“网络药理学-分子对接-药效学验证”的甘松“理气止痛、开郁醒脾”功效质量标志物研究,也表明绿原酸、丁香酸、甘松新酮、马兜铃酮等可作为甘松质量标志成分,相关研究结果另行发表。目前尚无文献报道甘松中丁香酸、马兜铃酮2 种化学成分在HPLC 研究中的指认及定量分析,故对甘松原料药材、饮片、药材粉末的综合质量评价中尚缺乏全面性,因此有必要对甘松建立基于临床有效性的多成分综合评价方法。
本研究以收集到的16 个批次的甘松药材作为研究对象,通过HPLC 法对甘松中绿原酸、丁香酸、蒙花苷、甘松新酮、马兜铃酮5 种化学成分同时进行含量测定,建立不同批次甘松样品指纹图谱,并运用主成分分析(principal component analysis,PCA)和聚类分析(cluster analysis,HCA),对所有样品的图谱进行探索性分析,结合正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)筛选不同批次甘松药材的差异成分,并对其共有峰进行分析,同时构建甘松药材的主成分综合评价模型,为甘松药材的质量综合评价提供方法和参考依据,以期规范当前甘松药材的市场流通及产地采收加工现状,同时保障优质的甘松药材能够应用于中医药临床。
1 仪器与材料
1.1 仪器
ME204E 型电子天平(梅特勒-托利多仪器有限公司);BS110S 型十万分之一电子分析天平(北京赛多利斯仪器系统有限公司);Waters e2695 型高效液相色谱仪(美国 Waters 公司);YH-IS 型远红外电热鼓风干燥箱(上海锦屏仪器仪表有限公司通州分公司);3 号药典筛(浙江上虞市金鼎标准筛具厂)。
1.2 材料
对照品绿原酸(批号A22GB158496)、丁香酸( 批号 S18J10K93270 )、 蒙花苷( 批号A02GB144093)、甘松新酮(批号H30D5X1)、马兜铃酮(批号R09J9F63410),购自上海源叶生物科技有限公司,质量分数均大于98%。甲醇(色谱纯,批号 20220103)、乙腈(色谱纯,批号20230301)、85%磷酸(色谱纯,批号20210415)、乙醇(分析级,批号20220901),购自天津市大茂化学试剂厂。实验用甘松药材为2022 年6、10 月分别于四川、青海、甘肃3 个省野外采集的样品。经甘肃中医药大学崔治家教授鉴定为败酱科植物甘松N.jatamansiDC.的干燥根及根茎,共16 批(编号S1~S16),具体信息见表1。

表1 甘松药材来源Table 1 Sources of N. jatamansi
2 方法
2.1 不同产地甘松样品HPLC 指纹图谱的建立
2.1.1 对照品溶液的制备 精密称取绿原酸、丁香酸、蒙花苷、甘松新酮、马兜铃酮5 种对照品适量,加甲醇分别制成一定质量浓度的母液,分别量取一定体积混合,制成含绿原酸80.0 µg/mL、丁香酸0.8µg/mL、蒙花苷3.5 µg/mL、甘松新酮700.0 µg/mL、马兜铃酮175.0 µg/mL 的混合对照品溶液。
2.1.2 供试品溶液的制备 取甘松药材细粉0.5 g,精密称定,置具塞锥形瓶中,精密加入95%乙醇20 mL,称定质量,超声提取30 min(30 ℃、40 kHz、600 W),放冷,用95%乙醇补足质量,滤过,取续滤液10 mL,水浴蒸干,用甲醇溶解并定容于10 mL量瓶中,摇匀,过0.45 μm 微孔滤膜,即得。
2.1.3 色谱条件 色谱条件参考杨祎辰等[25]研究,并在其基础上加以改善,最终确定色谱条件:Agilent 5 HC-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为0.2%磷酸水溶液(B)-乙腈(D),梯度洗脱(0~20 min,10%~35% D;20~23 min,35%~40% D;23~37 min,40%~54% D;37~42 min,54%~69%D;42~47 min,69%~72% D;47~48 min,72%~10% D);体积流量为1.0 mL/min;检测波长为275 nm;柱温30 ℃;进样量为10 μL。
2.1.4 精密度试验 取甘松样品(S1),按照“2.1.2”项下方法制备供试品溶液,按照“2.1.3”项下色谱条件重复进样6 次,测得各共有峰保留时间的RSD均小于0.35%,峰面积的RSD 均小于1.91%,表明仪器精密度良好。
2.1.5 重复性试验 取甘松样品(S1)6 份,按照“2.1.2”项下方法平行制备6 份供试品溶液,在“2.1.3”项色谱条件下进样测得各共有峰保留时间的RSD 均小于0.35%,峰面积的RSD 均小于2.98%。
2.1.6 稳定性试验 取甘松样品(S1),按照“2.1.2”项方法制备供试品溶液,按“2.1.3”项下色谱条件,分别于制备后的0、2、4、8、12、16、24 h 进样分析,测得各共有峰保留时间的RSD 均小于0.36%,峰面积的RSD 均小于2.47%,表明供试品溶液在24 h 内稳定性良好。
2.1.7 指纹图谱的建立及化学计量学分析 将“2.1.2”项下方法制成的16 批供试品溶液按“2.1.3”项下色谱条件进样分析,记录色谱图。并导入《中药色谱指纹图谱相似度评价系统(2012 版)》,以S1样品为参照指纹图谱(R),设置时间窗宽度为0.2 min,采用多点校正法自动匹配分析法建立指纹图谱,中位数法生成对照指纹图谱,并进行相似度计算。将得到的60 个共有峰的峰面积导入SPSS 25.0进行HCA 分析,SIMCA 14.1 进行PCA 分析、OPLSDA 分析。
2.2 5 个指标成分含量测定
2.2.1 对照品溶液的制备 同“2.1.1”项。
2.2.2 供试品溶液的制备 同“2.1.2”项。
2.2.3 色谱条件 同“2.1.3”项。
2.2.4 线性关系考察 取“2.1.1”项下混合对照品溶液,用甲醇逐次稀释成系列不同浓度,进样测定,记录5 种成分的色谱峰面积,以各成分的峰面积为纵坐标(Y),质量浓度为横坐标(X),绘制标准曲线,分别建立绿原酸、丁香酸、蒙花苷、甘松新酮和马兜铃酮的线性回归方程,计算相关系数(R2),各相关系数均大于0.999 6,表明各成分线性关系良好,见表2。

表2 甘松药材中5 种成分线性关系考察结果Table 2 Results of linear relationship between five components of N. jatamansi
2.2.5 精密度试验 精密吸取“2.1.1”项下混合对照品溶液,在“2.1.3”项条件下连续进样6 次,记录绿原酸、丁香酸、蒙花苷、甘松新酮、马兜铃酮的峰面积积分值,计算RSD 分别为2.02%、2.87%、2.02%、1.08%、2.08%,表明仪器精密度良好。
2.2.6 重复性试验 精密称取甘松样品粉末(S1)6 份,按照“2.1.2”项下方法平行制备6 份供试品溶液,在“2.1.3”项色谱条件下进样测定,计算绿原酸、丁香酸、蒙花苷、甘松新酮、马兜铃酮的平均质量分数分别为1.590 0、0.038 4、0.043 5、10.242 3、1.576 3 mg/g,RSD 分别为2.66%、1.23%、0.90%、1.84%、3.25%,表明该方法重复性良好。
2.2.7 稳定性试验 取甘松样品(S1),按照“2.1.2”项方法制备供试品溶液,按“2.1.3”项下色谱条件,分别于制备后的0、2、4、8、12、16、24 h 进样分析,记录绿原酸、丁香酸、蒙花苷、甘松新酮、马兜铃酮的峰面积积分值,计算RSD 分别为2.47%、2.37%、1.98%、1.47%、1.64%,表明样品溶液在24 h 内稳定性良好。
2.2.8 加样回收率试验 精密称取已知成分含量的甘松粉末9 份(S1),每份约0.25 g,置具塞锥形瓶中,按比例(1∶0.8、1∶1、1∶1.2)分别精密加入一定体积的对照品溶液,每个比例按“2.1.2”项方法平行制备3 份供试品溶液,在“2.1.3”项下方法进样分析,计算加样回收率和RSD 值。结果绿原酸、丁香酸、蒙花苷、甘松新酮、马兜铃酮的平均回收率分别为99.41%、98.96%、99.13%、102.97%、101.03%,RSD 分别为1.33%、1.87%、1.91%、0.96%、1.58%。
2.2.9 样品测定 分别精密称取16 批次甘松样品粉末0.5 g(平行3 份),按照“2.1.2”项下方法制备供试品溶液,在“2.1.3”项条件下进样分析,测定5 个成分峰面积,代入“2.2.4”项下直线回归方程,计算各成分的质量分数。
3 结果与分析
3.1 HPLC 指纹图谱的建立
将16 批次样品色谱数据导入《中药色谱指纹图谱相似度评价系统(2012 版)》,建立16 批样品的HPLC 指纹图谱(图1),以S1 为参照图谱,时间窗口设定为0.2 min,以中位数法建立对照图谱(R),采用多点校正全谱峰自动匹配共得到60 个共有峰,通过与混合对照品溶液图谱(图2)比对,指认出其中5 个共有峰,依次为绿原酸(7 号峰)、丁香酸(13 号峰)、蒙花苷(32号峰)、甘松新酮(50 号峰)、马兜铃酮(55 号峰)。

图1 16 批次甘松的HPLC 叠加指纹图谱和对照指纹图谱 (R)Fig.1 HPLC superimposed fingerprints and control fingerprints of 16 batches of N. jatamansi (R)

图2 混合对照品溶液的HPLC 图Fig.2 HPLC diagram of mixed reference solution
3.2 共有峰面积差异分析
不同产地甘松药材各共有峰峰面积RSD 为26.17%~88.42%,且7(绿原酸)、50(甘松新酮)、52、55(马兜铃酮)号共有峰峰面积相对较高;四川产甘松药材各共有峰峰面积RSD 为1.12%~65.72%,且7、12、35、50、52、55、59 号共有峰峰面积相对较高;青海河南产甘松药材各共有峰峰面积RSD 为22.98%~72.76%,且7、12、35、41、49、50、52、55、59 号共有峰峰面积相对较高;甘肃玛曲产甘松药材7、12、50、52、55 号共有峰峰面积相对较高。不同产地甘松药材的共有峰峰面积差异较大,其中均以50 号共有峰甘松新酮的峰面积最高。
3.3 相似度分析
以生成的对照指纹图谱为标准,计算16 批次甘松样品的相似度,结果如表3 所示,样品相似度为0.943~0.999,其中四川甘松相似度为 0.943~0.974,平均相似度为0.956;青海甘松相似度为0.981~0.999,相似度较高,平均相似度为0.997;甘肃甘松相似度为0.959,表明各批次甘松样品之间不同峰面积对应的成分含量存在一定差异,可通过指纹图相似度结果将青海甘松分别与四川、甘肃甘松进行区分,但甘肃甘松并未能通过指纹图谱相似度与四川甘松进行有效区分。从平均相似度来看,呈现青海>甘肃>四川的趋势。

表3 16 批次甘松样品HPLC 指纹图谱相似度评价结果Table 3 HPLC fingerprint similarity evaluation results of 16 batches of N. jatamansi samples
3.4 化学模式识别
3.4.1 HCA 以指纹图谱60 个共有峰的峰面积为变量,进行min-max 标准化处理,导入SPSS 25.0软件,采用组间联接、欧式距离法进行系统聚类分析,结果如图3 所示,各色块颜色由蓝至红分别代表各化合物峰面积由低到高,当距离为20 时,16 批甘松样品可聚为2 类,其中5 批甘松(S1~S3、S6、S15)聚为第1 类,分别产自四川阿坝州、青海河南县、甘肃玛曲县;其余甘松(S4、S5、S7~S14、S16)聚为第2 类,均产自青海河南县;当距离为15 时,16 批甘松样品可聚为3 类,其中3 批甘松(S1~S3)聚为第1 类,产自四川阿坝州,此类样品各共有峰代表的化学成分含量高低不一;2 批甘松(S6、S15)聚为第2 类,分别产自青海河南县、甘肃玛曲县,此类样品各共有峰代表的化学成分含量均相对较小;其余甘松(S4、S5、S7~S14、S16)聚为第3 类,均产自青海河南,此类样品各共有峰代表的化学成分含量整体分布较为均匀,且各成分相对含量均处于较高水平。HCA 结果表明,不同产地的甘松药材质量存在一定的差异,除S6 外,均可按其产地来源进行有效区分。

图3 甘松60 个共有峰的聚类分析热图Fig.3 Cluster analysis heat map of 60 common peaks of N.jatamansi
3.4.2 PCA 以60 个共有峰的峰面积为变量,得到16×60 阶数据矩阵,导入SIMCA 14.1 软件进行PCA,以主成分特征值>1 为提取标准,得到7个主成分,其累积方差贡献率为94.503%,说明这7 个主成分能充分代表甘松药材的基本特征和主要信息。特征值及贡献率见表4。

表4 特征值及方差贡献率Table 4 Characteristic values and variance contribution rate
进一步通过将各特征向量标准化后,由PC1(52.408%)和PC2(16.338%)为坐标轴构建的PCA得分散点图可以看出不同产地的甘松样品(除S6外)明显分开,如图4,结果显示不同产地的16 批样品被分为3 类,与HCA 结果完全一致。

图4 16 批不同产地甘松样品的PCA 散点得分图Fig.4 Scatter plot of PCA scores of 16 batches of N.jatamansi samples of different origins
因子载荷矩阵反映了各主成分与60 个共有峰即原始变量之间的相关系数,见表5。结果表明,主成分1 主要反映了色谱峰3、4、7、9~22、24、26~31、34、37~39、41、42、44~50、52~56、58、59 的信息,主成分2 主要反映了色谱峰1、2、5、6、23、33、35、36、40、57 的信息,主成分3主要反映了色谱峰8、25、32 的信息,主成分4 主要反映了色谱峰43 的信息,主成分5 主要反映了色谱峰60 的信息,主成分6 主要反映了色谱峰56的信息,主成分7 主要反映了色谱峰51 的信息。

表5 因子载荷矩阵Table 5 Factor load matrix
3.4.3 OPLS-DA 为了更好地分析不同产地甘松样本之间的差异,采用SMICA 14.1 软件对16 批甘松药材60 个共有峰进行有监督的OPLS-DA(模型的拟合效果通常通过R2X、R2Y、Q2这3 个指标来评价,这些指标大于0.5 较为可信,并且越接近1说明模型的拟合效果越好[25-27])散点得分图见图5。结果显示,同HCA 和PCA 一致,分为3 类。200 次置换检验显示该模型不存在过拟合(图6)。变量重要性投影(variable importance in projection,VIP)值是筛选差异性化合物的重要指标,VIP 值越高,对组间差异的影响越大[28]。以VIP>1 筛选出差异化合物,由VIP 得分图(图7)可知,贡献值较大的差异化合物有31 个,依次为35、57、40、33、45、23、28、38、36、30、48、9、52、49、50、41、44、55、7、18、34、59、31、26、13、27、17、46、20、29、54 号峰,其中7 号峰为绿原酸,13 号峰为丁香酸、50 号峰为甘松新酮,55 号峰为马兜铃酮,这些化合物是甘松各批次样品间产生差异的主要标志性成分,提示在甘松的质量控制和品质评价中,应重点关注这些成分的含量变化。而32 号峰为蒙花苷,但32 号峰并未出现在VIP>1 的色谱峰中,则基于本研究样本,提示它可能不是甘松质量差异的主要成分。

图5 16 批甘松药材OPLS-DA 图Fig.5 OPLS-DA analysis of 16 batches of N. jatamansi

图6 不同产地甘松200 次置换检验OPLS-DA 模型验证Fig.6 Validation of OPLS-DA model for 200 times replacement test of N. jatamansi of different origin

图7 不同产地甘松各成分VIP 图Fig.7 VIP diagram of each component of N. jatamansi of different origins
3.4.4 指纹图谱综合评价 运用SPSS 25.0 软件计算16 批次甘松样品的主成分得分,以各主成分对应的贡献率为权重系数计算综合得分,并将其排序,见表6。由表可知,S4、S7、S10 3 个批次甘松综合得分位居前3,因此,以60 个共有峰峰面积为综合评价指标,可得S4、S7、S10 3 个批次甘松质量较好,S6 和S15 排名最后。

表6 16 批次甘松的主成分因子得分和排序Table 6 Principal component factor scores and ranking of 16 batches of N. jatamansi
3.5 不同产地甘松的化学成分含量测定
由甘松HPLC 指纹图谱共指认出5 个共有化学成分,含量测定结果见表7。由表可以看出不同产地批次甘松中5 个指标成分含量存在差异。不同产地甘松药材平均含量为甘松新酮>马兜铃酮>绿原酸>丁香酸>蒙花苷。青海(除S6 的绿原酸质量分数为1.447 6 mg/g 外)、四川、甘肃甘松的绿原酸质量分数分别为均在2.302 9 mg/g 以上、1.046 5~1.670 3 mg/g、1.997 2 mg/g,呈现青海>甘肃>四川的趋势;四川甘松中丁香酸的质量分数均小于0.041 4 mg/g,整体小于甘肃、青海(除S6 的丁香酸质量分数为0.028 4 mg/g 外)甘松中丁香酸的含量,可作为四川甘松与其他产地甘松区分的指标成分;蒙花苷含量在甘肃甘松中达到最低(0.016 7 mg/g),明显低于其他产区甘松,可作为区分甘肃甘松与其他产区甘松的指标成分;甘松新酮在青海、四川、甘肃甘松中质量分数依次降低,分别为14.570 2~37.869 1 mg/g、10.900 6~13.817 1 mg/g、7.442 1 mg/g;青海(除S6 的马兜铃酮质量分数为1.246 1 mg/g 外)、四川、甘肃甘松的马兜铃酮质量分数分别为均在2.506 8 mg/g 以上、1.850 2~2.223 2 mg/g、0.673 7 mg/g;青海(除S6 的5 种成分总质量分数为17.310 5 mg/g 外)、四川、甘肃甘松的5 种成分总质量分数分别为均在30.759 9 mg/g以上、14.137 8~17.369 8 mg/g、10.182 6 mg/g。甘松新酮、马兜铃酮及5 种成分总质量分数均呈现青海>四川>甘肃的趋势,表明绿原酸、甘松新酮、马兜铃酮及5 种成分总含量可作为3 产地甘松相互区分的指标成分。
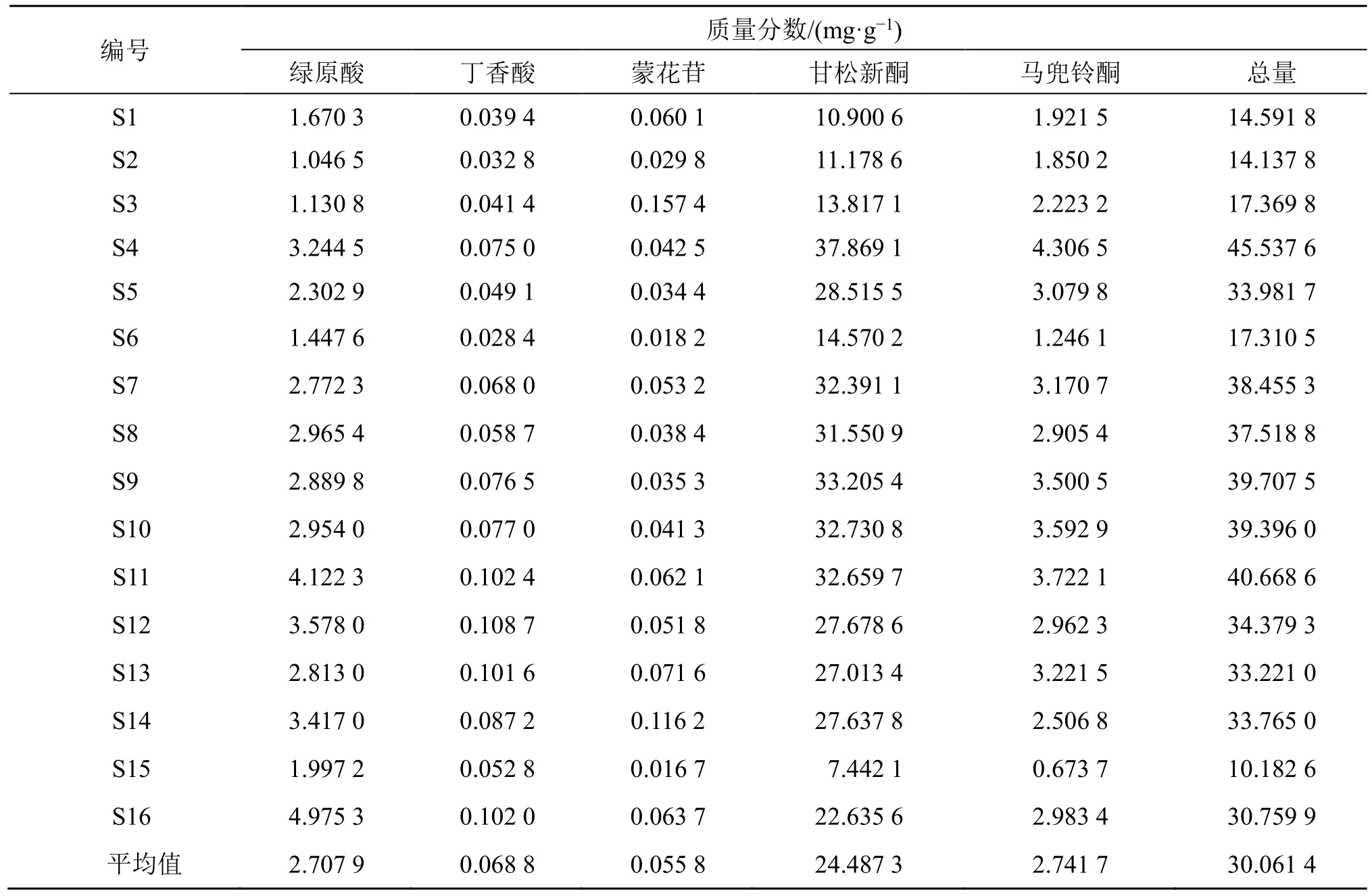
表7 16 批次甘松中5 个化学成分的含量 (n=3)Table 7 Contents of five chemical components in 16 batches of N. jatamansi (n=3)
通过分析含量测定结果柱形图(图8),可以看到VIP>1 的4 个差异性成分(绿原酸、丁香酸、甘松新酮、马兜铃酮)的含量在不同产地间存在显著差异,且均为青海产甘松平均含量最高,且在平均含量水平上,绿原酸和丁香酸呈现青海>甘肃>四川的趋势,甘松新酮和马兜铃酮呈现青海>四川>甘肃的趋势,蒙花苷在不同产地批次样本间也存在显著差异,平均含量为四川>青海>甘肃,但其VIP<1,故基于本研究结果,可将绿原酸、丁香酸、甘松新酮、马兜铃酮4 种指标成分作为评价甘松质量差异潜在的标志成分。

图8 5 个指标成分含量测定柱形图Fig.8 Content determination bar graph of five index components
将绿原酸、丁香酸、甘松新酮、马兜铃酮4 种指标成分含量进行min-max 归一化处理后,采用组间联接、欧式距离法进行系统聚类,结果见图9,可知不同样本间,当欧氏距离为15 时,16 批甘肃样本可分为2 类,其中S4、S5、S7~S14、S16 聚为第1 类,此类含萜类(甘松新酮、马兜铃酮)、苯丙素类(绿原酸)、酚类(丁香酸)成分含量均较高,其中绿原酸、丁香酸、甘松新酮、马兜铃酮含量最高的分别为S16、S12、S4 样本。S1~S3、S6 及S15 聚为第2 类,此类含上述4 种成分含量均较少,其中绿原酸、丁香酸、甘松新酮、马兜铃酮含量最低的分别为S2、S6、S15 样本,此聚类结果与60 个共有峰聚类结果完全相同。而在不同成分间,甘松新酮、马兜铃酮均属于萜类成分,聚为一类,绿原酸、丁香酸分别属于苯丙素类、酚类,各自聚为一类。依据4 种成分含量聚类结果,可将不同产地甘松进行有效区分,进一步验证了这4 种指标成分作为甘松的潜在质量标志物的合理性。
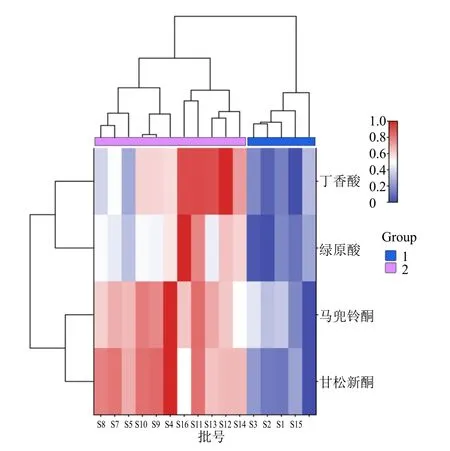
图9 4 种指标成分聚类分析热图Fig.9 Heat map of cluster analysis of four index components
4 讨论
本研究以甘松为研究对象,收集了16 批不同产地甘松样品进行指纹图谱和多成分含量测定研究,并通过相似度分析、HCA、PCA 以及OPLSDA 综合评价甘松的质量。通过考察提取方法(95%乙醇回流提取、95%乙醇超声提取)、提取时间(15、30、45 min)对提取结果的影响,最终确定以95%乙醇超声提取30 min 作为供试品溶液提取方法。考察不同波长(254、275、326 nm)下指纹图谱色谱峰数量、峰型和分离度,同时对各波长下绿原酸、丁香酸、蒙花苷、甘松新酮、马兜铃酮5 种成分进行含量检测,分析发现275 nm 下各色谱峰的响应较高且分离度较好,因此选用275 nm 作为检测波长。
本研究对16 批次不同产地甘松指纹图谱进行研究,结合化学模式识别法分析,首次对甘松中丁香酸和马兜铃酮2 种化学成分于同一HPLC 色谱条件下进行指认并定量分析,对甘松的多成分控制药材质量进行了补充,使其质量评价更为全面客观。在指纹图谱相似度分析中,16 批次样品相似度均高于0.943,表明采集到的16 批甘松的化学成分组成较为相似,但各批次样品之间化学成分含量存在一定差异,指纹图谱相似度结果将青海甘松分别与四川、甘肃甘松进行区分,而甘肃甘松未能通过指纹图谱相似度与四川甘松进行有效区分,可能是因为甘松中不同成分峰面积对应的含量变化对相似度结果有抵消作用[29],进一步分析不同产地甘松平均相似度,呈现青海>甘肃>四川的趋势。
含量测定结果显示,16 批样品中5 种成分含量差异较大,绿原酸的质量分数为1.046 5~4.975 3 mg/g、丁香酸的质量分数为0.028 4~0.108 7 mg/g、蒙花苷的质量分数为0.016 7~0.157 4 mg/g、甘松新酮的质量分数为7.442 1~37.869 1 mg/g、马兜铃酮的质量分数为0.673 7~4.306 5 mg/g。5 种成分在不同产地间均呈现显著性差异,且平均含量从高到低依次为甘松新酮>马兜铃酮>绿原酸>丁香酸>蒙花苷。
HCA、PCA、OPLS-DA 结果均显示,四川阿坝州产甘松(S1~S3)聚为第1 类,青海河南县、甘肃玛曲县产甘松(S6、S15)聚为第2 类,青海河南县产甘松(S4、S5、S7~S14、S16)聚为第3 类。本研究S6 与S15 无法区分的原因可能是因为2 批样品各共有峰代表的化学成分相对含量均较低,且较为接近,导致两者无法区分;也可能是生长年限不同,由于本研究甘松样本均为野生采挖,且甘松为多年草本植物,《中国药典》2020 年版对其生长年限并未作出明确规定,文献研究表明其生长年限的不同会对其次生代谢产物的积累产生影响[25,30],生长年限等信息的不明确,亦会影响聚类分析的结果;另气候环境、经纬度、海拔等的影响,也会导致对样本的区分能力较弱。
本研究结果表明,青海甘松中绿原酸、丁香酸、甘松新酮、马兜铃酮的平均质量分数分别为3.123 5、0.077 9、29.038 2、2.887 5 mg/g,整体高于其他产区,特别是甘松新酮作为《中国药典》2020年版甘松项下限定质控指标成分,在四川甘松中质量分数为10.900 6~13.817 1 mg/g,青海甘松中质量分数为14.570 2~37.869 1 mg/g,甘肃甘松中质量分数为7.442 1 mg/g,甘松新酮可将3 产地甘松完全区分;另OPLS-DA 这4 种成分均属于VIP>1 的差异成分,显著性分析也显示4 种成分的含量在不同产地间存在显著差异,表明本研究确定绿原酸、丁香酸、甘松新酮、马兜铃酮作为甘松的质量差异的特异性标志成分是合理的。
本研究采用HPLC 法对收集到的16 批次甘松药材建立指纹图谱,并对其中绿原酸、丁香酸、蒙花苷、甘松新酮和马兜铃酮的含量进行比较分析,运用PCA 和HCA,对其共有峰进行分析,构建甘松药材的主成分综合评价模型,结合OPLS-DA 筛选不同批次甘松药材的差异成分,为甘松药材的质量控制全面化、规范化、标准化提供参考依据。本研究建立的甘松指纹图谱及5 种成分含量测定方法可为甘松原料药材的质量差异性评价提供科学方法,可为甘松药材市场流通的等级划分提供参考依据,以保障优质的甘松药材能够应用于中医药临床。
本课题组前期已开展了基于“网络药理学-分子对接-药效学验证”的甘松“理气止痛、开郁醒脾”功效质量标志物研究,为确定绿原酸、丁香酸、甘松新酮、马兜铃酮等作为甘松质量标志成分提供了有效支撑,相关研究结果另行发表。另由于甘松药材资源多为野生,且生长环境多为藏区,分布区域有限,资源相对匮乏,样本获取难度较大,课题组近半年通过努力采集收集了甘肃、四川等地产甘松,但样本持有量仍非常有限。但为了尽快推进甘松药材研究,课题组对有限的样本进行了多成分定量及指纹图谱研究,以期为甘松药材的资源整合、有效开发利用提供有益参考。另本课题组后续研究将考虑在HPLC 指纹图谱研究的基础上,通过GC-MS测定甘松挥发性成分、ICP-MS 测定无机元素等,结合甘松药理药效,实现基于甘松挥发性成分、无机元素指纹图谱的谱效相关研究,为甘松产地区分及质量标志物的确立提供更为全面的参考。
利益冲突所有作者均声明不存在利益冲突
